Kofeín citrát: stimulátor (úplné informácie o predpisovaní)
Názov značky: Cafcit
Generický názov: Kofeín Citrát
Dávkovacia forma: injekcia
Kofeín citrát je stimulant centrálneho nervového systému, ktorý je dostupný ako Cafcit a používa sa na liečbu apnoe u detí. Použitie, dávkovanie, vedľajšie účinky.
obsah:
popis
Klinická farmakológia
Indikácie a použitie
varovanie
Opatrenia
Nežiaduce reakcie
predávkovania
Dávkovanie a spôsob podávania
Ako dodávané
Informácie o pacientovi s obsahom kofeínu (v jednoduchej angličtine)
popis
Injekcia kofeín citrátu na intravenózne podanie a perorálny roztok kofeínu citrátu sú číre, bezfarebné, sterilné, nepyrogénne, vodné roztoky bez konzervačných látok upravené na pH 4,7. Každý ml obsahuje 20 mg kofeín citrátu (zodpovedá 10 mg kofeínovej bázy) pripraveného v roztok pridaním 10 mg bezvodého kofeínu, USP do 5 mg monohydrátu kyseliny citrónovej, USP, 8,3 mg dihydrátu citrátu sodného, USP a vody na Injekcia, USP.
Kofeín, stimulátor centrálneho nervového systému, je biely kryštalický prášok alebo granule bez zápachu s horkou chuťou. Pri izbovej teplote je ťažko rozpustný vo vode a etanole. Chemický názov kofeínu je 3,7-dihydro-l, 3,7-trimetyl-lH-purín-2,6-dión. V prítomnosti kyseliny citrónovej tvorí v roztoku citranovú soľ kofeínu. Nasleduje štruktúrny vzorec a molekulová hmotnosť kofeín citrátu.
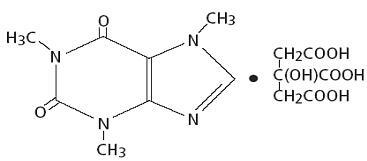
Kofeín citrát
C14H18N409 Mol. Hm. 386,31
top
Klinická farmakológia
Mechanizmus akcie
Kofeín je štruktúrne príbuzný s inými metylxantínmi, teofylínom a teobromínom. Je to bronchiálny relaxant s hladkým svalstvom, stimulátor CNS, stimulátor srdcového svalu a diuretikum.
pokračujte v príbehu nižšie
Aj keď nie je známy mechanizmus účinku kofeínu pri apnoe predčasne narodených, existuje niekoľko hypotéz. Patria sem: (1) stimulácia dýchacieho centra, (2) zvýšená minútová ventilácia, (3) znížená hranica na hyperkapnia, (4) zvýšená odpoveď na hyperkapnia, (5) zvýšený tonus kostrového svalstva, (6) znížená únava bránice, (7) zvýšená rýchlosť metabolizmu a (8) zvýšený kyslík Spotreba.
Väčšina z týchto účinkov bola pripísaná antagonizmu adenozínových receptorov, ako podtypov A1, tak A2, kofeínom, ktorý sa preukázal pri testoch väzby na receptor a pozoroval sa pri koncentráciách približne rovnakých ako terapeuticky dosiahnuté.
farmakokinetika
Absorpcia: Po perorálnom podaní 10 mg kofeínovej bázy / kg predčasne narodeným novorodencom je maximálna hladina v plazme (Cmax) pre kofeín sa pohyboval od 6 do 10 mg / l a priemerný čas na dosiahnutie maximálnej koncentrácie (Tmax) v rozmedzí od 30 minút do 2 hodín. Tmax nebola ovplyvnená kŕmením vzorcom. Absolútna biologická dostupnosť však u novorodencov predčasne narodených nebola úplne skúmaná.
Distribúcia: Kofeín sa rýchlo distribuuje do mozgu. Hladiny kofeínu v mozgovomiechovom moku predčasne narodených novorodencov sa približujú ich plazmatickým hladinám. Priemerný distribučný objem kofeínu u dojčiat (0,8 - 0,9 l / kg) je o niečo vyšší ako distribučný objem u dospelých (0,6 l / kg). Údaje o väzbe na plazmatické bielkoviny nie sú k dispozícii pre novorodencov alebo dojčatá. U dospelých sa uvádza, že priemerná väzba na plazmatické bielkoviny in vitro je približne 36%.
Metabolizmus: Hepatálny cytochróm P450 1A2 (CYP1A2) sa podieľa na biotransformácii kofeínu. Metabolizmus kofeínu u novorodencov predčasne narodených je obmedzený vzhľadom na ich nezrelé systémy pečeňových enzýmov.
U predčasne narodených novorodencov bola hlásená vzájomná premena medzi kofeínom a teofylínom; Hladiny kofeínu sú približne 25% hladín teofylínu po podaní teofylínu a očakáva sa, že približne 3 až 8% podaného kofeínu sa zmení na teofylín.
Eliminácia: U mladých detí je vylučovanie kofeínu omnoho pomalšie ako u dospelých kvôli nezrelým pečeňovým a / alebo obličkovým funkciám. Priemerný polčas (T1/2) a frakcia vylúčená v nezmenenej forme močom (Ae) kofeínu u dojčiat bolo preukázané, že nepriamo súvisia s gestačným / postkoncepčným vekom. U novorodencov je T1/2 je približne 3 až 4 dni a Ae je približne 86% (do 6 dní). Do 9 mesiacov veku sa metabolizmus kofeínu približuje metabolizmu u dospelých (T1/2 = 5 hodín a Ae = 1%).
Osobitné populácie: Štúdie skúmajúce farmakokinetiku kofeínu u novorodencov s hepatálnou alebo renálnou insuficienciou sa nevykonali. Kofeín citrát sa má podávať opatrne u predčasne narodených novorodencov so zníženou funkciou obličiek alebo pečene. Mali by sa monitorovať sérové koncentrácie kofeínu a podávanie dávky kofeín citrátu by sa malo upraviť tak, aby sa predišlo toxicite v tejto populácii.
Klinické štúdie
Jedna multicentrická, randomizovaná, dvojito zaslepená štúdia porovnávala kofeín citrát s placebom u osemdesiatpäť (85) predčasne narodených detí (gestačný vek 28 až <33 týždňov) s apnoe predčasne narodenej. Apnoe predčasnej dospelosti bola definovaná ako epizóda s najmenej 6 epizódami apnoe trvajúcimi viac ako 20 sekúnd v 24-hodinovom období bez inej identifikovateľnej príčiny apnoe. Intravenózne bola podaná 1 ml / kg (20 mg / kg kofeín citrátu poskytujúca 10 mg / kg ako kofeínová báza) úvodná dávka kofeín citrátu, nasledovaná 0,25 ml / kg (5 mg / kg kofeín citrátu poskytujúceho 2,5 mg / kg kofeínovej bázy) denná udržiavacia dávka podávaná buď intravenózne alebo perorálne (zvyčajne prostredníctvom kŕmenia) trubica). Trvanie liečby v tejto štúdii bolo obmedzené na 10 až 12 dní. Protokol umožnil deťom „zachrániť“ liečbu otvoreným kofeínom citrátom, ak ich apnoe zostala nekontrolovateľná počas dvojito slepej fázy pokusu.
Percento pacientov bez apnoe v deň 2 liečby (24-48 hodín po úvodnej dávke) bolo pri kofeín citrát výrazne vyššie ako placebo. V nasledujúcej tabuľke sú zhrnuté klinicky relevantné sledované parametre hodnotené v tejto štúdii:
| Kofeín citrát | placebo | p-hodnota | |
|---|---|---|---|
| Počet hodnotených pacientov * | 45 | 37 | |
| % pacientov s nulovými udalosťami apnoe v deň 2 | 26.7 | 8.1 | 0.03 |
| Sadzba apnoe v 2. deň (za 24 hodín) | 4.9 | 7.2 | 0.134 |
| % pacientov s 50% znížením príznakov apnoe od základnej línie v deň 2 | 76 | 57 | 0.07 |
| * Z 85 pacientov, ktorí dostali liek, 3 neboli zahrnutí do analýzy účinnosti, pretože mali <6 epizód apnoe / 24 hodín na začiatku. |
V tejto 10-12 dňovej štúdii bol priemerný počet dní s udalosťami s nulovou apnoe 3 v skupine s obsahom kofeínu a 1,2 v skupine s placebom. Priemerný počet dní s 50% znížením oproti východiskovým hodnotám pri apnoe bol 6,8 v skupine s kofeín citrátom a 4,6 v skupine s placebom.
top
Indikácie a použitie
Injekcia kofeín citrátu a perorálny roztok kofeín citrátu sú indikované na krátkodobé liečenie predčasného apnoe u dojčiat vo veku od 28 do 33 týždňov tehotenstva.
top
kontraindikácie
Injekcia kofeínu citrátu a perorálny roztok kofeínu citrátu sú kontraindikované u pacientov, u ktorých sa preukázala precitlivenosť na niektorú z jeho zložiek.
top
varovanie
Počas dvojito zaslepenej, placebom kontrolovanej klinickej skúšky sa u 85 študovaných dojčiat vyvinula 6 prípadov nekrotizujúcej enterokolitídy (kofeín = 46, placebo = 39), pričom 3 prípady viedli k úmrtiu. Päť zo šiestich pacientov s nekrotizujúcou enterokolitídou bolo randomizovaných alebo vystavených kofeín citrátu.
Správy v publikovanej literatúre vyvolali otázku týkajúcu sa možného vzťahu medzi použitím metylxantínov a rozvoj nekrotizujúcej enterokolitídy, hoci kauzálny vzťah medzi užívaním metylxantínu a nekrotizujúcou enterokolitídou nebol stanovené. Preto, ako u všetkých predčasne narodených detí, aj u pacientov liečených kofeín citrátom je potrebné starostlivo sledovať vývoj nekrotizujúcej enterokolitídy.
top
Opatrenia
všeobecný
Apnoe predčasnej dospelosti je diagnóza vylúčenia. Iné príčiny apnoe (napr. Poruchy centrálneho nervového systému, primárne ochorenie pľúc, anémia, sepsa, poruchy metabolizmu, kardiovaskulárne abnormality alebo obštrukčná apnoe) by sa mali vylúčiť alebo náležite liečiť pred začatím liečby kofeínom Citrát.
Kofeín je stimulátor centrálneho nervového systému a v prípade predávkovania kofeínom boli hlásené záchvaty. Kofeín citrát sa má používať opatrne u dojčiat s kŕčovými poruchami.
Trvanie liečby predčasného apnoe v placebom kontrolovanej štúdii bolo obmedzené na 10 až 12 dní. Bezpečnosť a účinnosť kofeín citrátu po dlhšiu dobu liečby nebola stanovená. Bezpečnosť a účinnosť kofeín citrátu na použitie pri profylaktickej liečbe náhlej smrti dieťaťa Syndróm (SIDS) alebo pred extubáciou u mechanicky vetraných dojčiat tiež nebol stanovené.
kardiovaskulárne
Aj keď v placebom kontrolovanej štúdii neboli hlásené žiadne prípady srdcovej toxicity, v publikovaných štúdiách sa ukázalo, že kofeín zvyšuje srdcový rytmus, produkciu ľavej komory a objem mŕtvice. Preto sa kofeín citrát musí používať opatrne u dojčiat s kardiovaskulárnym ochorením.
Renálne a pečeňové systémy
Kofeín citrát sa má podávať opatrne dojčatám s poškodenou funkciou obličiek alebo pečene. Mali by sa monitorovať sérové koncentrácie kofeínu a podávanie dávky kofeín citrátu by sa malo upraviť tak, aby sa predišlo toxicite v tejto populácii. (Pozri Klinická farmakológia, Eliminácia, špeciálne populácie.)
Informácie pre pacientov
Rodičia / opatrovatelia pacientov, ktorí dostávajú perorálny roztok kofeín citrát, by mali dostať nasledujúce pokyny:
- Kofeín citrát perorálny roztok neobsahuje žiadne konzervačné látky a každá injekčná liekovka je len na jedno použitie. Akákoľvek nepoužitá časť lieku sa musí zlikvidovať.
- Je dôležité, aby sa dávka kofeín citrátového perorálneho roztoku merala presne, t.j. pomocou 1 cc alebo inej vhodnej injekčnej striekačky.
- Ak sa u dieťaťa stále vyskytujú príznaky apnoe, obráťte sa na svojho lekára; nezvyšujte dávku perorálneho roztoku kofeínu citrátu bez lekárskej konzultácie.
- Ak dieťa začne prejavovať znaky gastrointestinálnej intolerancie, ako je brušná distenzia, zvracanie alebo krvavá stolica alebo sa zdá byť letargická, poraďte sa so svojím lekárom.
- Pred podaním sa má perorálny roztok kofeínu citrátu vizuálne skontrolovať, či neobsahuje častice a či nedošlo k zmene jeho farby. Injekčné liekovky obsahujúce odfarbený roztok alebo viditeľné pevné častice sa musia zlikvidovať.
Laboratórne testy
Pred začatím liečby kofeínom citrátom by sa mali odmerať základné hladiny kofeínu v sére Dojčatá predtým liečené teofylínom, pretože predčasne narodené deti metabolizujú teofylín na kofeín. Podobne by sa mali zmerať východiskové sérové hladiny kofeínu u dojčiat narodených matkám, ktoré konzumovali kofeín pred pôrodom, pretože kofeín ľahko prechádza placentou.
V placebom kontrolovanej klinickej štúdii sa hladiny kofeínu pohybovali od 8 do 40 mg / l. Terapeutické rozmedzie plazmatickej koncentrácie kofeínu nebolo možné určiť z placebom kontrolovanej klinickej skúšky. V literatúre bola hlásená závažná toxicita, keď hladiny sérového kofeínu prekročia 50 mg / l. Možno bude potrebné pravidelne monitorovať sérové koncentrácie kofeínu počas liečby, aby sa zabránilo toxicite.
V klinických štúdiách uvádzaných v literatúre sa pozorovali prípady hypoglykémie a hyperglykémie. Preto môže byť potrebné pravidelne monitorovať hladinu glukózy v sére u detí, ktoré dostávajú citrát kofeínu.
Liekové interakcie
Je známe, že cytochróm P450 1A2 (CYP1A2) je hlavným enzýmom podieľajúcim sa na metabolizme kofeínu. Preto má kofeín potenciál interagovať s liekmi, ktoré sú substrátmi pre CYP1A2, inhibujú CYP1A2 alebo indukujú CYP1A2.
Existuje len málo údajov o liekových interakciách s kofeínom u predčasne narodených novorodencov. Na základe údajov pre dospelých môžu byť po súbežnom podaní liekov, o ktorých sa uvádza, že znižujú vylučovanie kofeínu (napr. Cimetidín), potrebné nižšie dávky kofeínu. a ketokonazol) a vyššie dávky kofeínu môžu byť potrebné po súčasnom podaní liekov, ktoré zvyšujú elimináciu kofeínu (napr. fenobarbitál a fenytoín).
Kofeín podávaný súbežne s ketoprofénom znížil objem moču u štyroch zdravých dobrovoľníkov. Klinický význam tejto interakcie u novorodencov predčasne narodených nie je známy.
U predčasne narodených novorodencov bola hlásená vzájomná premena medzi kofeínom a teofylínom. Súčasné užívanie týchto liekov sa neodporúča.
Karcinogenéza, mutagenéza, poškodenie plodnosti
V dvojročnej štúdii na potkanoch Sprague-Dawley nebol kofeín (ako kofeínový základ) podávaný v pitnej vode karcinogénny u samcov potkanov pri dávkach do 102 mg / kg alebo u samíc potkanov v dávkach do 170 mg / kg (približne 2-násobok a maximálne 4-násobok maximálnej odporúčanej intravenóznej úvodnej dávky pre dojčatá na mg / m2 základ). V 18-mesačnej štúdii na myšiach C57BL / 6 sa nepozoroval žiadny dôkaz tumorigenicity pri dietetických dávkach do 55 mg / kg (menej ako maximálna odporúčaná intravenózna úvodná dávka pre dojčatá v mg / m).2 základ).
Kofeín (ako kofeínová báza) zvyšoval sesterskú výmenu chromatidov (SCE) SCE / bunkovú metafázu (v závislosti od času expozície) pri analýze myšej metafázy in vivo. Kofeín tiež zosilnil genotoxicitu známych mutagénov a zvýšil tvorbu mikrojadier (päťkrát) u myší s deficitom folátov. Avšak kofeín nezvýšil chromozomálne aberácie v in vitro testoch vaječníkových buniek čínskeho škrečka (CHO) a ľudských lymfocytov a bol nie mutagénny v in vitro génovom mutačnom teste na CHO / hypoxantín guanín-fosforibozyltransferázu (HGPRT), s výnimkou cytotoxických koncentráciou. Okrem toho, kofeín nebol klastogénny v in vivo teste na myších mikrojadrách.
Kofeín (ako kofeínový základ) podávaný samcom potkanov v dávke 50 mg / kg / deň subkutánne (približne sa rovná maximálnej odporúčanej intravenóznej úvodnej dávke pre dojčatá v mg / m)2 na báze) po dobu 4 dní pred párením s neošetrenými samicami spôsobili okrem toho, že spôsobili embryotoxicitu, zníženú reprodukčnú schopnosť samcov. Okrem toho dlhodobá expozícia vysokým perorálnym dávkam kofeínu (3 g počas 7 týždňov) bola toxická pre semenníky potkanov, čo sa prejavuje degeneráciou spermatogénnych buniek.
Tehotenstvo: Tehotenstvo Kategória C
Z hľadiska teratogenity kofeínu nie je relevantné, keď sa podáva dojčatám. V štúdiách uskutočnených na dospelých zvieratách sa kofeín (ako kofeínový základ) podával gravidným myšiam ako pelety s predĺženým uvoľňovaním v dávke 50 mg / kg (menej ako maximálna odporúčaná intravenózna úvodná dávka pre dojčatá) na mg / m2 (základ), v období organogenézy, spôsobil nízky výskyt rozštiepeného patra a exencefaliu u plodu. Neexistujú dostatočné a dobre kontrolované štúdie u tehotných žien.
top
Nežiaduce reakcie
Celkovo bol hlásený počet nežiaducich udalostí v dvojito zaslepenom období kontrolovanej štúdie podobný pre skupiny s obsahom kofeínu a placeba. Nasledujúca tabuľka ukazuje nežiaduce účinky, ktoré sa vyskytli v dvojito zaslepenom období kontrolovanej štúdie a ktoré boli častejšie u pacientov liečených kofeínom citrátom ako placebo.
| Nepriaznivá udalosť (AE) | Kofeín citrát N = 46 n (%) |
placebo N = 39 n (%) |
|---|---|---|
| TELO AKO CELÉ | ||
| Náhodné zranenie | 1 (2.2) | 0 (0.0) |
| Intolerancia pri kŕmení | 4 (8.7) | 2 (5.1) |
| sepsa | 2 (4.3) | 0 (0.0) |
| KARDIOVASKULÁRNY SYSTÉM | ||
| krvácanie | 1 (2.2) | 0 (0.0) |
| ZAŽÍVACIE ÚSTROJENSTVO | ||
| Nekrotizujúca enterokolitída | 2 (4.3) | 1 (2.6) |
| zápal žalúdka | 1 (2.2) | 0 (0.0) |
| Gastrointestinálne krvácanie | 1 (2.2) | 0 (0.0) |
| HEMICKÝ A LYMFATICKÝ SYSTÉM | ||
| Diseminovaná intravaskulárna koagulácia | 1 (2.2) | 0 (0.0) |
| METABOLICKÉ A NUTRITÍVNE CHOROBY | ||
| acidóza | 1 (2.2) | 0 (0.0) |
| Neobvyklé liečenie | 1 (2.2) | 0 (0.0) |
| NERVOVÝ SYSTÉM | ||
| Mozgové krvácanie | 1 (2.2) | 0 (0.0) |
| DÝCHACÍ SYSTÉM | ||
| dýchavičnosť | 1 (2.2) | 0 (0.0) |
| Pľúcny edém | 1 (2.2) | 0 (0.0) |
| KOŽA A DOPLNKY | ||
| Suchá koža | 1 (2.2) | 0 (0.0) |
| vyrážka | 4 (8.7) | 3 (7.7) |
| Pokazenie kože | 1 (2.2) | 0 (0.0) |
| ZVLÁŠTNE SNÍMKY | ||
| Retinopatia predčasnosti | 1 (2.2) | 0 (0.0) |
| UROGENITÁLNY SYSTÉM | ||
| Zlyhanie obličiek | 1 (2.2) | 0 (0.0) |
Okrem vyššie uvedených prípadov boli u pacientov, ktorí dostávali kofeín citrát počas otvorenej fázy štúdie, diagnostikované tri prípady nekrotizujúcej enterokolitídy.
Traja z detí, u ktorých sa počas testu vyvinula nekrotizujúca enterokolitída, zomreli. Všetci boli vystavení kofeínu. Dvaja boli randomizovaní na kofeín a jeden pacient s placebom bol „zachránený“ otvoreným kofeínom kvôli nekontrolovanému apnoe.
Medzi nežiaduce udalosti opísané v publikovanej literatúre patria: stimulácia centrálneho nervového systému (t. J. Podráždenosť, nepokoj, nervozita), kardiovaskulárne účinky (t.j. tachykardia, zvýšená produkcia ľavej komory a zvýšený objem mŕtvice), gastrointestinálne účinky (t. j. zvýšený aspirát žalúdka, gastrointestinálna intolerancia), zmeny glukózy v sére (hypoglykémia a hyperglykémia) a renálne účinky (zvýšený prietok moču, zvýšený klírens kreatinínu a zvýšený obsah sodíka a vápnika) vylučovanie). Publikované dlhodobé následné štúdie nepreukázali, že kofeín nepriaznivo ovplyvňuje neurologický vývoj alebo rastové parametre.
top
predávkovania
Po predávkovaní sa hladiny sérového kofeínu pohybovali od približne 24 mg / l (po uvedení na trh) spontánna správa o prípade, keď dieťa malo podráždenosť, slabé kŕmenie a nespavosť) do 350 mg / l. Vážna toxicita bola spojená so sérovými hladinami vyššími ako 50 mg / l (pozri Opatrenia- laboratórne testy a Dávkovanie a spôsob podávania). Medzi príznaky a symptómy hlásené v literatúre po predávkovaní kofeínom u predčasne narodených detí patrí horúčka, tachypnoe, nervozita, nespavosť, jemné chvenie končatín, hypertónia, opisthotonos, tonicko-klonické pohyby, nepohyblivé čeľuste a pohyby pier, zvracanie, hyperglykémia, zvýšený dusík močoviny v krvi a zvýšený celkový leukocyt koncentráciu. Záchvaty boli hlásené aj v prípade predávkovania. Bol hlásený jeden prípad predávkovania kofeínom komplikovaný vývojom intraventrikulárneho krvácania a dlhodobých neurologických následkov. Ďalší prípad predávkovania kofeínom citrátom (z Nového Zélandu) odhadom 600 mg citrátu kofeínu (približne 322 mg / kg) podávaného počas 40 minút bol komplikovaný tachykardia, ST depresia, dýchacie ťažkosti, srdcové zlyhanie, žalúdočné ťažkosti, acidóza a silné extravazačné horenie s tkanivovou nekrózou na periférnej intravenóznej miesto vpichu. U predčasne narodených detí neboli hlásené žiadne úmrtia spojené s predávkovaním kofeínom.
Liečba predávkovania kofeínom je primárne symptomatická a podporná. Hladiny kofeínu sa po výmenných transfúziách znižujú. Kŕče sa môžu liečiť intravenóznym podaním diazepamu alebo barbiturátu, ako je pentobarbitál sodný.
top
Dávkovanie a spôsob podávania
Pred začatím liečby kofeínom citrátom by sa mali odmerať základné hladiny kofeínu v sére Dojčatá predtým liečené teofylínom, pretože predčasne narodené deti metabolizujú teofylín na kofeín. Podobne by sa mali zmerať východiskové sérové hladiny kofeínu u dojčiat narodených matkám, ktoré konzumovali kofeín pred pôrodom, pretože kofeín ľahko prechádza placentou.
Nasleduje odporúčaná úvodná dávka a udržiavacie dávky kofeín citrátu.
| Dávka kofeín citrátu objem |
Dávka kofeín citrátu mg / kg |
trasa | kmitočet | |
|---|---|---|---|---|
| Načítava sa dávka | 1 ml / kg | 20 mg / kg | Intravenózne * (viac ako 30 minút) | Raz |
| Údržbová dávka | 0,25 ml / kg | 5 mg / kg | Intravenózne * (viac ako 10 minút) alebo perorálne | Každých 24 hodín ** |
| * pomocou infúznej pumpy ** počnúc 24 hodinami po naplnení dávky |
POZNÁMKA, ŽE DÁVKA KOFFEÍNOVEJ ZÁKLADY JE JEDNODUCHÁ DÁVKA, KTORÁ JE VYJADRENÁ AKO KOEINOVÝ citrát (napr. 20 mg kofeínového citrátu zodpovedá 10 mg kofeínovej bázy).
Možno bude potrebné pravidelne monitorovať sérové koncentrácie kofeínu počas liečby, aby sa zabránilo toxicite. Vážna toxicita bola spojená so sérovými hladinami vyššími ako 50 mg / l.
Injekcia kofeínu citrátu a perorálny roztok kofeínu citrátu sa majú pred podaním vizuálne skontrolovať na prítomnosť častíc a zmenu farby. Injekčné liekovky obsahujúce odfarbený roztok alebo viditeľné pevné častice sa musia zlikvidovať.
Kompatibilita s liekmi
Na testovanie kompatibility lieku s bežnými intravenóznymi roztokmi alebo liekmi bolo 20 ml injekcie kofeínu citrátu v kombinácii s 20 ml roztoku alebo liekov, s výnimkou prísady Intralipid®, ktorá bola kombinovaná ako 80 mL / 80 mL. Fyzikálny vzhľad kombinovaných roztokov bol vyhodnotený na zrážanie. Zmesi sa miešali 10 minút a potom sa testovali na kofeín. Zmesi sa potom nepretržite miešali 24 hodín, s ďalším odoberaním vzoriek na kofeínové testy po 2, 4, 8 a 24 hodinách.
Na základe tohto testovania je injekcia kofeínu citrát 60 mg / 3 ml chemicky stabilná počas 24 hodín pri izbovej teplote, keď sa kombinuje s nasledujúcimi testovanými produktmi.
- Injekcia dextrózy, USP 5%
- 50% dextróza, injekcia USP
- Intralipid® 20% IV emulzia tukov
- Aminosyn® 8,5% kryštalický roztok aminokyseliny
- Dopamínová HCI injekcia, USP 40 mg / ml zriedená na 0,6 mg / ml s injekciou dextrózy, USP 5%
- Injekcia glukonátu vápenatého, USP 10% (0,465 mekv / Ca + 2 / ml)
- Heparínová injekcia sodíka, USP 1 000 jednotiek / ml zriedená na 1 jednotku / ml pomocou injekcie dextrózy, USP 5%
- Injekcia citrátu fentanylu, USP 50 ug / ml zriedená na 10 ug / ml pomocou injekcie dextrózy, USP 5%
top
Ako dodávané
Injekcia kofeín citrátu a perorálny roztok kofeín citrátu sú dostupné ako číre, bezfarebné, sterilné, apyrogénne vodné roztoky bez konzervačných látok v 5 ml bezfarebných sklenených fľaštičkách. Injekčné liekovky s injekciou kofeínu citrátu sú zapečatené šedou gumovou zátkou a bielym vyklápacím hliníkovým uzáverom vytlačeným červenou farbou „LEN NA INTRAVENOUS POUŽITIE“. Injekčné liekovky perorálneho roztoku kofeínu citrátu sú zapečatené sivou gumovou zátkou a tmavomodrou matná povrchová úprava, odtrhnite hliníkové tesnenie s potlačou „LEN NA ORÁLNE POUŽITIE - ZVYŠOVANIE A SKÚŠKA“ v biely.
Injekčné liekovky aj injekčné liekovky na perorálny roztok obsahujú 3 ml roztoku v koncentrácii 20 mg / ml kofeín citrátu (60 mg / liekovka), čo zodpovedá 10 mg / ml kofeínovej bázy (30 mg / liekovka).
Injekcia citrátu kofeínu, USP
NDC 47335-289-40: 3 ml injekčná liekovka, jednotlivo balené v škatuli.
Kofeín citrát perorálny roztok, USP
NDC 47335-290-44: 3 ml injekčná liekovka (NIE JE DETI ODOLNÁ), 10 injekčných liekoviek na bielu
polypropylénový obal odolný deťom.
Uchovávajte pri teplote 20 ° C až 25 ° C; odchýlky povolené medzi 15 ° a 30 ° C (59 ° až 86 ° F) [pozri regulovanú izbovú teplotu USP].
Konzervačné zadarmo. Len na jedno použitie. Nepoužitú časť zlikvidujte.
POZOR LIEČIVÝ: Oddeľte „Návod na použitie“ z príbalového letáka a vydajte liek na perorálny roztok s obsahom kofeínu citrátu.
Distribuovaný:
Caraco Pharmaceutical Laboratories, Ltd.
1150 Elijah McCoy Drive, Detroit, MI 48202
Výrobca:
Sun Pharmaceutical Ind. Ltd.
Diaľnica Halol-Baroda,
Halol-389 350, Gujarat, India.
naposledy aktualizované 2. 2. 2010
Informácie o pacientovi s obsahom kofeínu (v jednoduchej angličtine)
Podrobné informácie o Známky, príznaky, príčiny, liečba porúch spánku
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
späť k:
~ všetky články o poruchách spánku



