Actos pre diabetes 2. typu
Názov značky: Actos
Všeobecný názov: pioglitazón hydrochlorid
obsah:
popis
farmakológia
Indikácie a použitie
kontraindikácie
varovanie
Opatrenia
Nežiaduce reakcie
predávkovať
Dávkovanie a spôsob podávania
Ako dodávané
Actos, pioglitazón hcl, informácie o pacientovi (v jednoduchej angličtine)
VÝSTRAHA: KONGESTÍVNA PORUCHA SRDCE
- Tiazolidíndióny, vrátane Actosu, u niektorých pacientov spôsobujú alebo zhoršujú kongestívne zlyhanie srdca (pozri časť 4.2) UPOZORNENIE). Po začatí liečby Actosom a po zvýšení dávky pozorne sledujte pacientov, či nevykazujú príznaky a príznaky srdcového zlyhania (vrátane nadmerného, rýchleho prírastku na hmotnosti, dýchavičnosti a / alebo edému). Ak sa tieto príznaky a príznaky objavia, zlyhanie srdca sa má liečiť podľa súčasných štandardov starostlivosti. Ďalej sa musí zvážiť prerušenie liečby alebo zníženie dávky Actosu.
- Actos sa neodporúča u pacientov so symptomatickým srdcovým zlyhaním. Začatie liečby Actosom u pacientov so zavedeným srdcovým zlyhaním triedy NYHA III alebo IV je kontraindikované (pozri časť 4.2) Kontraindikácie a UPOZORNENIE).
popis
Actos (pioglitazón hydrochlorid) je perorálne antidiabetikum, ktoré pôsobí primárne znižovaním inzulínovej rezistencie. Actos sa používa na liečbu diabetes mellitus 2. typu (známeho tiež ako diabetes mellitus nezávislý od inzulínu [NIDDM] alebo diabetes začínajúci u dospelých). Farmakologické štúdie naznačujú, že Actos zvyšuje citlivosť na inzulín vo svalovom a tukovom tkanive a inhibuje pečeňovú glukoneogenézu. Actos zlepšuje kontrolu glykémie a súčasne znižuje hladiny cirkulujúceho inzulínu.
Monohydrochlorid pioglitazónu [(±) -5 - [[4- [2- (5-etyl-2-pyridinyl) etoxy] fenyl] metyl] -2,4-] tiazolidíndión odlišná chemická trieda a má odlišný farmakologický účinok ako sulfonylmočoviny, metformín alebo Î ± glukozidáza inhibítory. Molekula obsahuje jeden asymetrický uhlík a zlúčenina je syntetizovaná a použitá ako racemická zmes. Dva enantioméry pioglitazónu sa vzájomne premieňajú in vivo. Nezistili sa žiadne rozdiely vo farmakologickej aktivite medzi týmito dvoma enantiomérmi. Štrukturálny vzorec je uvedený:
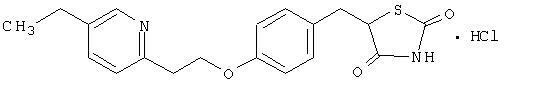
Pioglitazón hydrochlorid je biely kryštalický prášok bez zápachu, ktorý má molekulový vzorec C19H20N2O3S-HCI a molekulová hmotnosť 392,90 daltonov. Je rozpustný v N, N-dimetylformamide, mierne rozpustný v bezvodom etanole, veľmi mierne rozpustný v acetóne a acetonitrile, prakticky nerozpustný vo vode a nerozpustný v éteri.
Actos je dostupný vo forme tablety na perorálne podanie, ktorá obsahuje 15 mg, 30 mg alebo 45 mg pioglitazónu (ako báza) formulovaného s nasledujúce pomocné látky: 1 monohydrát laktózy NF, hydroxypropylcelulóza NF, karboxymetylcelulóza vápenatá NF a stearát horečnatý NF.
top
Klinická farmakológia
Mechanizmus akcie
Actos je tiazolidíndiónové antidiabetikum, ktoré závisí od prítomnosti inzulínu pre svoj mechanizmus účinku. Actos znižuje inzulínovú rezistenciu na periférii a pečeni, čo vedie k zvýšenému ukladaniu glukózy v závislosti od inzulínu a zníženému výtoku glukózy v pečeni. Na rozdiel od sulfonylmočovín, pioglitazón nie je inzulínový sekretagog. Pioglitazón je účinný agonista receptora gama aktivovaného proliferátorom peroxizómov (PPARγ). Receptory PPAR sa nachádzajú v tkanivách dôležitých pre pôsobenie inzulínu, ako je tukové tkanivo, kostrový sval a pečeň. Aktivácia jadrových receptorov PPAR³ moduluje transkripciu niekoľkých génov reagujúcich na inzulín zapojených do kontroly metabolizmu glukózy a lipidov.
Na zvieracích modeloch diabetu pioglitazón znižuje hyperglykémiu, hyperinzulinémiu a hypertriglyceridémiu charakteristickú pre inzulín rezistentné stavy, ako je diabetes typu 2. Metabolické zmeny vyvolané pioglitazónom vedú k zvýšenej reakcii tkanív závislých od inzulínu a sú pozorované v mnohých zvieracích modeloch inzulínovej rezistencie.
Pretože pioglitazón zvyšuje účinky cirkulujúceho inzulínu (znížením inzulínovej rezistencie), neznižuje hladinu glukózy v krvi u zvieracích modelov, ktoré nemajú endogénny inzulín.
Farmakokinetika a metabolizmus liečiv
Sérové koncentrácie celkového pioglitazónu (pioglitazón plus aktívne metabolity) zostávajú zvýšené 24 hodín po podaní dávky jedenkrát denne. Rovnovážne sérové koncentrácie pioglitazónu a celkového pioglitazónu sa dosahujú do 7 dní. V rovnovážnom stave dva z farmakologicky aktívnych metabolitov pioglitazónu Metabolity III (M-III) a IV (M-IV) dosahujú sérové koncentrácie rovnaké alebo vyššie ako pioglitazón. U zdravých dobrovoľníkov aj u pacientov s cukrovkou 2. typu predstavuje pioglitazón približne 30% až 50% maximálna celková koncentrácia pioglitazónu v sére a 20% až 25% celkovej plochy pod krivkou koncentrácia v sére v čase (AUC).
Maximálna koncentrácia v sére (Cmax), AUC a minimálnych sérových koncentrácií (Cmin) pre pioglitazón aj celkový pioglitazón úmerne stúpajú pri dávkach 15 mg a 30 mg za deň. Pri dávke 60 mg za deň je mierne menšie ako proporcionálne zvýšenie pioglitazónu a celkového pioglitazónu.
Absorpcia: Po perorálnom podaní nalačno je pioglitazón najskôr merateľný v sére do 30 minút, pričom maximálne koncentrácie sa pozorujú do 2 hodín. Jedlo mierne oneskoruje čas na dosiahnutie maximálnej koncentrácie v sére na 3 až 4 hodiny, ale nemení rozsah absorpcie.
Distribúcia: Priemerný zdanlivý distribučný objem (Vd / F) pioglitazónu po podaní jednorazovej dávky je 0,63 ± 0,41 (priemer ± SD) L / kg telesnej hmotnosti.
Pioglitazón sa vo veľkom množstve viaže na proteíny (> 99%) v ľudskom sére, hlavne na sérový albumín. Pioglitazón sa tiež viaže na iné sérové proteíny, ale s nízkou afinitou. Metabolity M-III a M-IV sa tiež vo veľkej miere viažu (> 98%) na sérový albumín.
Metabolizmus: Pioglitazón sa extenzívne metabolizuje hydroxyláciou a oxidáciou; metabolity sa tiež čiastočne premieňajú na glukuronidové alebo sulfátové konjugáty. Metabolity M-II a M-IV (hydroxyderiváty pioglitazónu) a M-III (keto derivát pioglitazónu) sú farmakologicky aktívne na zvieracích modeloch cukrovky 2. typu. Okrem pioglitazónu sú M-III a M-IV hlavnými druhmi súvisiacimi s liečivami, ktoré sa nachádzajú v ľudskom sére po viacnásobnom dávkovaní. V rovnovážnom stave, u zdravých dobrovoľníkov, ako aj u pacientov s cukrovkou 2. typu, pioglitazón obsahuje približne 30% až 50% celkovej maximálnej koncentrácie v sére a 20% až 25% celkovej koncentrácie v sére celková AUC.
Údaje in vitro ukazujú, že na metabolizme pioglitazónu sa podieľa viac izoforiem CYP. Zúčastnené izoformy cytochrómu P450 sú CYP2C8 a v menšej miere CYP3A4 s ďalšími príspevkami z rôznych ďalších izoforiem vrátane hlavne extrahepatického CYP1A1. Uskutočnili sa in vivo štúdie pioglitazónu v kombinácii s inhibítormi a substrátmi P450 (pozri časť 6.1) Liekové interakcie). Pomery 6 Ÿ-hydroxykortizolu / kortizolu v moči namerané u pacientov liečených Actosom ukázali, že pioglitazón nie je silný induktor enzýmu CYP3A4.
Vylučovanie a eliminácia: Po perorálnom podaní sa približne 15% až 30% dávky pioglitazónu vylúči močom. Renálna eliminácia pioglitazónu je zanedbateľná a liek sa vylučuje primárne ako metabolity a ich konjugáty. Predpokladá sa, že väčšina perorálnej dávky sa vylučuje do žlče buď nezmenená alebo ako metabolity a vylučuje sa stolicou.
Priemerný sérový polčas pioglitazónu a pioglitazónu v sére je v rozmedzí od 3 do 7 hodín, respektíve od 16 do 24 hodín. Pioglitazón má zdanlivý klírens CL / F, vypočítaný na 5 až 7 l / h.
Osobitné skupiny obyvateľstva
Renálna insuficiencia: Polčas eliminácie pioglitazónu, M-III a M-IV v sére zostáva u pacientov so stredne ťažkým (klírens kreatinínu 30 až 60 ml / min) až závažné (klírens kreatinínu <30 ml / min), poškodenie obličiek v porovnaní s normálnym predmety. U pacientov s dysfunkciou obličiek sa neodporúča žiadna úprava dávky (pozri časť 4.2) DÁVKOVANIE A PODÁVANIE).
Hepatálna insuficiencia: V porovnaní s normálnymi kontrolami majú subjekty s poruchou funkcie pečene (stupeň B / C podľa Childovej-Pughovej klasifikácie) približne 45% zníženie priemerných maximálnych koncentrácií pioglitazónu a celkového pioglitazónu, ale žiadna zmena priemernej AUC hodnôt.
Liečba liekom Actos by sa nemala začať, ak pacient vykazuje klinické dôkazy o aktívnom ochorení pečene alebo hladinách sérovej transaminázy (ALT) prekračujúcich 2,5-násobok hornej hranice normy (pozri pozri časť 4.8). OPATRENIA, Hepatické účinky).
Starší pacienti: Maximálne sérové koncentrácie pioglitazónu a celkového pioglitazónu u zdravých starších jedincov nie sú významne odlišné, ale hodnoty AUC sú mierne vyššie a hodnoty terminálneho polčasu mierne dlhšie ako pre mladšie predmety. Tieto zmeny neboli takého rozsahu, ktorý by sa považoval za klinicky relevantný.
Deti: Farmakokinetické údaje u pediatrickej populácie nie sú k dispozícii.
Pohlavie: Priemerná Cmax a hodnoty AUC sa zvýšili u žien o 20% až 60%. Ako monoterapia av kombinácii so sulfonylmočovinou, metformínom alebo inzulínom Actos zlepšil kontrolu glykémie u mužov aj žien. V kontrolovaných klinických štúdiách hemoglobín A1c (HbA1c) poklesy oproti východiskovým hodnotám boli vo všeobecnosti väčšie u žien ako u mužov (priemerný priemerný rozdiel v HbA)1c 0.5%). Pretože liečba by mala byť individualizovaná pre každého pacienta, aby sa dosiahla kontrola glykémie, neodporúča sa úprava dávky len na základe pohlavia.
Etnicita: Farmakokinetické údaje u rôznych etnických skupín nie sú k dispozícii.
Interakcie liečivo-liečivo
Nasledujúce lieky boli študované na zdravých dobrovoľníkoch pri súčasnom podaní Actos 45 mg jedenkrát denne. Nižšie sú uvedené výsledky:
Perorálne kontraceptíva: Súbežné podávanie Actosu (45 mg raz denne) a perorálnej antikoncepcie (1 mg noretindrónu plus 0,035 mg etinylestradiolu jedenkrát denne) po dobu 21 dní, čo malo za následok zníženie AUC etinylestradiolu o 11% a 11-14% (0-24 h) a Cmax resp. Nezistili sa žiadne významné zmeny AUC noretindronu (0-24 h) a Cmax. Vzhľadom na vysokú variabilitu farmakokinetiky etinylestradiolu nie je klinický význam tohto nálezu známy.
Fexofenadín HCl: Súbežné podávanie Actosu počas 7 dní so 60 mg fexofenadínu podávaného perorálne dvakrát denne nemalo významný vplyv na farmakokinetiku pioglitazónu. Actos nemal významný vplyv na farmakokinetiku fexofenadínu.
Glipizid: Súbežné podávanie Actosu a 5 mg glipizidu podávaného perorálne jedenkrát denne počas 7 dní nezmenilo farmakokinetiku glipizidu v rovnovážnom stave.
Digoxín: Súbežné podávanie Actosu s 0,25 mg digoxínu podaného perorálne jedenkrát denne počas 7 dní nezmenilo farmakokinetiku digoxínu v rovnovážnom stave.
Warfarín: Súbežné podávanie Actosu s warfarínom počas 7 dní nezmenilo farmakokinetiku warfarínu v rovnovážnom stave. Actos nemá klinicky významný účinok na protrombínový čas, keď sa podáva pacientom, ktorí dostávajú chronickú liečbu warfarínom.
Metformín: Súbežné podanie jednej dávky metformínu (1000 mg) a Actosu po 7 dňoch Actosu nezmenilo farmakokinetiku jednorazovej dávky metformínu.
Midazolam: Podávanie Actosu počas 15 dní, po ktorom nasledovala jednorazová dávka 7,5 mg sirupu midazolamu, viedlo k 26% zníženiu midazolamu Cmax a AUC.
Ranitidín HCI: Súbežné podávanie Actosu počas 7 dní s ranitidínom podávaným perorálne dvakrát denne počas 4 alebo 7 dní nemalo významný vplyv na farmakokinetiku pioglitazónu. Actos nepreukázal významný vplyv na farmakokinetiku ranitidínu.
Nifedipine ER: Súbežné podávanie Actosu počas 7 dní s 30 mg nifedipínu ER podávaného perorálne jedenkrát denne počas 4 dní do dobrovoľníci mužského a ženského pohlavia viedli k najmenším štvorcovým priemerom (90% CI) pre nezmenený nifedipín 0,83 (0,73 - 0,95) pre Cmax a 0,88 (0,80 - 0,96) pre AUC. Vzhľadom na vysokú variabilitu farmakokinetiky nifedipínu nie je klinický význam tohto nálezu známy.
Ketokonazol: Súbežné podávanie Actosu počas 7 dní s ketokonazolom 200 mg podaným dvakrát denne viedli k najmenším štvorcovým priemerom (90% CI) pre nezmenený pioglitazón 1,14 (1,06 - 1,23) pre Cmax1,34 (1,26 - 1,41) pre AUC a 1,87 (1,71 - 2,04) pre Cmin.
Kalcium atorvastatín: súčasné podávanie Actosu počas 7 dní s kalcium atorvastatínom (LIPITOR®) 80 mg raz denne viedli k najmenším štvorcovým priemerom (90% CI) pre nezmenený pioglitazón 0,69 (0,57 - 0,85) pre Cmax0,76 (0,65 - 0,88) pre AUC a 0,96 (0,87 - 1,05) pre Cmin. Pre nezmenený atorvastatín boli najmenšie štvorcové stredné hodnoty (90% CI) 0,77 (0,66 - 0,90) pre Cmax0,86 (0,78 - 0,94) pre AUC a 0,92 (0,82 - 1,02) pre Cmin.
Teofylín: Súbežné podávanie Actosu počas 7 dní s teofylínom 400 mg podávaným dvakrát denne nemalo za následok zmenu farmakokinetiky ani jedného z liekov.
Cytochróm P450: Pozri OPATRENIA
Gemfibrozil: Súbežné podávanie gemfibrozilu (perorálne 600 mg dvakrát denne), inhibítora CYP2C8, s pioglitazónom (perorálne 30 mg) u 10 zdravých dobrovoľníkov vopred liečených počas 2 dní pred podaním gemfibrozilu (perorálne 600 mg dvakrát denne) malo za následok expozíciu pioglitazónu (AUC0-24) 226% expozície pioglitazónu v neprítomnosti gemfibrozilu (pozri OPATRENIA).
Rifampín: Súbežné podávanie rifampínu (perorálne 600 mg raz denne), induktora CYP2C8 s pioglitazónom (perorálne 30 mg) u 10 zdravých dobrovoľníci, ktorí boli predtým liečení 5 dní pred rifampínom (perorálne 600 mg raz denne), mali za následok zníženie AUC pioglitazónu o 54% (pozri OPATRENIA).
Farmakodynamika a klinické účinky
Klinické štúdie ukazujú, že Actos zvyšuje citlivosť na inzulín u pacientov rezistentných na inzulín. Actos zvyšuje citlivosť buniek na inzulín, zvyšuje likvidáciu glukózy závislú od inzulínu, zlepšuje citlivosť pečene na inzulín a zlepšuje dysfunkčnú homeostázu glukózy. U pacientov s diabetom 2. typu má znížená inzulínová rezistencia vyvolaná Actosom za následok nižšie koncentrácie glukózy v plazme, nižšie hladiny inzulínu v plazme a nižšie HbA.1c hodnôt. Na základe výsledkov otvorenej rozšírenej štúdie sa zdá, že účinky Actosu na znižovanie glukózy pretrvávajú najmenej jeden rok. V kontrolovaných klinických skúšaniach mal Actos v kombinácii so sulfonylmočovinou, metformínom alebo inzulínom aditívny účinok na kontrolu glykémie.
Do klinických štúdií s liekom Actos boli zaradení pacienti s abnormalitami lipidov. Celkovo mali pacienti liečení Actosom priemerné zníženie triglyceridov, priemerné zvýšenie HDL cholesterolu a žiadne konzistentné priemerné zmeny LDL a celkového cholesterolu.
V 26-týždňovej, placebom kontrolovanej štúdii zameranej na dávkovanie sa priemerné hladiny triglyceridov v skupine s dávkou 15 mg, 30 mg a 45 mg Actosu znížili v porovnaní s priemerným zvýšením v skupine s placebom. Priemerné hladiny HDL sa zvýšili vo väčšej miere u pacientov liečených Actosom ako u pacientov liečených placebom. U pacientov liečených Actosom v porovnaní s placebom neboli žiadne konzistentné rozdiely týkajúce sa LDL a celkového cholesterolu (tabuľka 1).
Tabuľka 1 Lipidy v 26-týždňovej placebom kontrolovanej štúdii zameranej na dávkovanie monoterapie
| placebo | actos 15 mg akonáhle denná |
actos 30 mg akonáhle denná |
actos 45 mg akonáhle denná |
|
| Triglyceridy (mg / dl) | N = 79 | N = 79 | N = 84 | N = 77 |
| Základná hodnota (stredná hodnota) | 262.8 | 283.8 | 261.1 | 259.7 |
| Percentuálna zmena oproti základnej hodnote (priemer) | 4.8% | -9.0% | -9.6% | -9.3% |
| HDL cholesterol (mg / dl) | N = 79 | N = 79 | N = 83 | N = 77 |
| Základná hodnota (stredná hodnota) | 41.7 | 40.4 | 40.8 | 40.7 |
| Percentuálna zmena oproti základnej hodnote (priemer) | 8.1% | 14.1% | 12.2% | 19.1% |
| LDL cholesterol (mg / dl) | N = 65 | N = 63 | N = 74 | N = 62 |
| Základná hodnota (stredná hodnota) | 138.8 | 131.9 | 135.6 | 126.8 |
| Percentuálna zmena oproti základnej hodnote (priemer) | 4.8% | 7.2% | 5.2% | 6.0% |
| Celkový cholesterol (mg / dl) | N = 79 | N = 79 | N = 84 | N = 77 |
| Základná hodnota (stredná hodnota) | 224.6 | 220.0 | 222.7 | 213.7 |
| Percentuálna zmena oproti základnej hodnote (priemer) | 4.4% | 4.6% | 3.3% | 6.4% |
V ďalších dvoch štúdiách monoterapie (24 týždňov a 16 týždňov) a kombinovaných terapeutických štúdiách so sulfonylmočovinou (24 týždňov a 16 týždňov) a metformínu (24 týždňov a 16 týždňov) boli výsledky vo všeobecnosti v súlade s údajmi vyššie. V placebom kontrolovaných štúdiách sa priemerné zmeny korigované placebom oproti východiskovým hodnotám znížili o 5% na 26% pre triglyceridy a zvýšili sa o 6% až 13% pre HDL u pacientov liečených Actosom. Podobné výsledky boli pozorované v 24-týždňových štúdiách kombinovanej terapie Actosu so sulfonylmočovinou alebo metformínom.
V štúdii s kombinovanou terapiou s inzulínom (16 týždňov) bola tiež znížená priemerná percentuálna zmena triglyceridov korigovaná placebom u pacientov liečených Actosom. V skupine s dávkou 15 mg bola pozorovaná priemerná zmena LDL cholesterolu oproti základnej hodnote 7%. Boli pozorované podobné výsledky, aké boli uvedené vyššie pre HDL a celkový cholesterol. Podobné výsledky boli pozorované v 24-týždňovej štúdii kombinovanej terapie s Actosom s inzulínom.
Klinické štúdie
monoterapia
V USA sa uskutočnili tri randomizované, dvojito zaslepené, placebom kontrolované štúdie s trvaním od 16 do 26 týždňov, aby sa vyhodnotilo použitie lieku Actos ako monoterapie u pacientov s diabetom 2. typu. Tieto štúdie skúmali Actos v dávkach do 45 mg alebo placeba raz denne u 865 pacientov.
V 26-týždňovej štúdii zameranej na dávku bolo 408 pacientov s diabetom 2. typu randomizovaných do skupín, aby dostávali 7,5 mg, 15 mg, 30 mg alebo 45 mg Actosu alebo placebo jedenkrát denne. Liečba akýmkoľvek predchádzajúcim antidiabetikom bola prerušená 8 týždňov pred dvojito zaslepeným obdobím. Ošetrenie 15 mg, 30 mg a 45 mg Actosu viedlo v porovnaní s placebom k štatisticky významnému zlepšeniu hladiny HbA1c a plazmatickej glukózy nalačno (FPG) v porovnaní s placebom (obrázok 1, tabuľka 2).
Obrázok 1 ukazuje časový priebeh zmien v FPG a HbA1c pre celú populáciu štúdie v tejto 26-týždňovej štúdii.
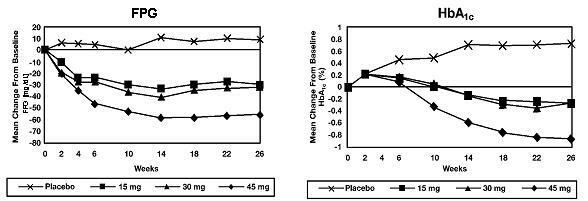
Tabuľka 2 ukazuje HbA1c a hodnoty FPG pre celú študovanú populáciu.
Tabuľka 2 Glykemické parametre v 26-týždňovej placebom kontrolovanej štúdii zameranej na dávkovanie
| placebo | actos 15 mg akonáhle denná |
actos 30 mg akonáhle denná |
actos 45 mg akonáhle denná |
|
| CELKOVÁ POPULÁCIA | ||||
| HbA1c (%) | N = 79 | N = 79 | N = 85 | N = 76 |
| Základná hodnota (stredná hodnota) | 10.4 | 10.2 | 10.2 | 10.3 |
| Zmena zo základnej línie (upravený priemer+) | 0.7 | -0.3 | -0.3 | -0.9 |
| Rozdiel oproti placebu (upravený priemer+) | -1.0* | -1.0* | -1.6* | |
| FPG (mg / dl) | N = 79 | N = 79 | N = 84 | N = 77 |
| Základná hodnota (stredná hodnota) | 268 | 267 | 269 | 276 |
| Zmena zo základnej línie (upravený priemer+) | 9 | -30 | -32 | -56 |
| Rozdiel oproti placebu (upravený priemer+) | -39* | -41* | -65* | |
|
+ Upravené na základnú líniu, združené centrum a združené centrum na základe interakcie s liečbou * p â ‰ ¤ 0,050 vs. placebo |
Populácia v štúdii zahŕňala pacientov, ktorí predtým neboli liečení antidiabetikami (doteraz; 31%) a pacientov, ktorí dostávali antidiabetiká v čase zápisu do štúdie (predtým liečení; 69%). Údaje pre predtým neliečené a predtým liečené podskupiny pacientov sú uvedené v tabuľke 3. Všetci pacienti vstúpili do obdobia 8 týždňov vymývania / zábehu pred dvojito zaslepenou liečbou. Toto obdobie zábehu bolo spojené s malými zmenami HbA1c a hodnoty FPG od skríningu po východiskovú hodnotu pre pacientov bez predchádzajúcej liečby; pre predtým liečenú skupinu však vymývanie z predchádzajúcich antidiabetík viedlo k zhoršeniu glykemickej kontroly a zvýšeniu HbA.1c a FPG. Hoci u väčšiny pacientov v predtým liečenej skupine došlo k poklesu HbA oproti východiskovým hodnotám1c a FPG s Actosom, v mnohých prípadoch sa hodnoty na konci štúdie nevrátili na úroveň skríningu. Dizajn štúdie neumožnil hodnotenie pacientov, ktorí prešli priamo na Actos z iného antidiabetika.
Tabuľka 3 Glykemické parametre v 26-týždňovej placebom kontrolovanej štúdii zameranej na dávkovanie
| placebo | actos 15 mg akonáhle denná |
actos 30 mg akonáhle denná |
actos 45 mg akonáhle denná |
|
| Naveve na terapiu HbA1c (%) |
N = 25 | N = 26 | N = 26 | N = 21 |
| Skríning (priemer) | 9.3 | 10.0 | 9.5 | 9.8 |
| Základná hodnota (stredná hodnota) | 9.0 | 9.9 | 9.3 | 10.0 |
| Zmena oproti základnej hodnote (upravený priemer *) | 0.6 | -0.8 | -0.6 | -1.9 |
| Rozdiel oproti placebu (upravený priemer *) | -1.4 | -1.3 | -2.6 | |
| FPG (mg / dl) | N = 25 | N = 26 | N = 26 | N = 21 |
| Skríning (priemer) | 223 | 245 | 239 | 239 |
| Základná hodnota (stredná hodnota) | 229 | 251 | 225 | 235 |
| Zmena oproti základnej hodnote (upravený priemer *) | 16 | -37 | -41 | -64 |
| Rozdiel oproti placebu (upravený priemer *) | -52 | -56 | -80 | |
| Predtým ošetrené HbA1c (%) |
N = 54 | N = 53 | N = 59 | N = 55 |
| Skríning (priemer) | 9.3 | 9.0 | 9.1 | 9.0 |
| Základná hodnota (stredná hodnota) | 10.9 | 10.4 | 10.4 | 10.6 |
| Zmena oproti základnej hodnote (upravený priemer *) | 0.8 | -0.1 | -0.0 | -0.6 |
| Rozdiel oproti placebu (upravený priemer *) | -1.0 | -0.9 | -1.4 | |
| FPG (mg / dl) | N = 54 | N = 53 | N = 58 | N = 56 |
| Skríning (priemer) | 222 | 209 | 230 | 215 |
| Základná hodnota (stredná hodnota) | 285 | 275 | 286 | 292 |
| Zmena oproti základnej hodnote (upravený priemer *) | 4 | -32 | -27 | -55 |
| Rozdiel oproti placebu (upravený priemer *) | -36 | -31 | -59 | |
| * Upravené pre základnú líniu a združený stred |
V 24-týždňovej placebom kontrolovanej štúdii bolo 260 pacientov s diabetom 2. typu randomizovaných do jednej z dvoch skupín liečených liekom Actos s nútenou titráciou alebo falošnej titračnej skupiny placeba. Liečba akýmkoľvek predchádzajúcim antidiabetikom bola prerušená 6 týždňov pred dvojito zaslepeným obdobím. V jednej liečebnej skupine Actosu dostali pacienti počiatočnú dávku 7,5 mg jedenkrát denne. Po štyroch týždňoch sa dávka zvýšila na 15 mg jedenkrát denne a po ďalších štyroch týždňoch sa dávka zvyšovala na 30 mg jedenkrát denne po zvyšok štúdie (16 týždňov). V druhej skupine s liečbou Actosom dostali pacienti počiatočnú dávku 15 mg jedenkrát denne a podobným spôsobom sa titrovali na 30 mg jedenkrát denne a 45 mg jedenkrát denne. Liečba Actosom, ako je opísané, viedla k štatisticky významnému zlepšeniu HbA1c a FPG v koncovom bode v porovnaní s placebom (tabuľka 4).
Tabuľka 4 Glykemické parametre v 24-týždňovej placebom kontrolovanej nútenej titrácii
| placebo | actos 30 mg+ Raz denne |
actos 45 mg+ Raz denne |
|
| Celková populácia HbA1c (%) |
N = 83 | N = 85 | N = 85 |
| Základná hodnota (stredná hodnota) | 10.8 | 10.3 | 10.8 |
| Zmena zo základnej línie (upravený priemer++) | 0.9 | -0.6 | -0.6 |
| Rozdiel oproti placebu (upravený priemer++) | -1.5* | -1.5* | |
| FPG (mg / dl) | N = 78 | N = 82 | N = 85 |
| Základná hodnota (stredná hodnota) | 279 | 268 | 281 |
| Zmena zo základnej línie (upravený priemer++) | 18 | -44 | -50 |
| Rozdiel oproti placebu (upravený priemer++) | -62* | -68* | |
|
+ Konečná dávka pri nútenej titrácii ++ Upravené na základnú líniu, združené centrum a združené centrum na základe interakcie s liečbou * p â ‰ ¤ 0,050 vs. placebo |
U pacientov, ktorí predtým neboli liečení antidiabetikami (24%), boli priemerné hodnoty pri skríningu 10,1% pre HbA.1c a 238 mg / dl pre FPG. Na začiatku je priemerná hodnota HbA1c bol 10,2% a priemerný FPG bol 243 mg / dl. V porovnaní s placebom viedla liečba Actosom titrovaným na konečnú dávku 30 mg a 45 mg k zníženiu priemernej HbA oproti základnej hodnote.1c 2,3% a 2,6% a priemerný FPG 63 mg / dl a 95 mg / dl. U pacientov, ktorí boli predtým liečení antidiabetikami (76%), sa tento liek pri skríningu prerušil. Priemerné hodnoty pri skríningu boli 9,4% pre HbA1c a 216 mg / dl pre FPG. Na začiatku je priemerná hodnota HbA1c bol 10,7% a priemerný FPG bol 290 mg / dl. V porovnaní s placebom viedla liečba Actosom titrovaným na konečnú dávku 30 mg a 45 mg k zníženiu priemernej HbA oproti základnej hodnote.1c 1,3% a 1,4% a priemerná FPG 55 mg / dl a 60 mg / dl. U mnohých predtým liečených pacientov HbA1c a FPG sa na konci štúdie nevrátili na úroveň skríningu.
V 16-týždňovej štúdii bolo randomizovaných 197 pacientov s diabetom 2. typu na liečbu 30 mg Actosu alebo placeba jedenkrát denne. Liečba akýmkoľvek predchádzajúcim antidiabetikom bola prerušená 6 týždňov pred dvojito zaslepeným obdobím. Liečba 30 mg Actosu viedla k štatisticky významnému zlepšeniu HbA1c a FPG v koncovom bode v porovnaní s placebom (tabuľka 5).
Tabuľka 5 Glykemické parametre v 16-týždňovej placebom kontrolovanej štúdii
| placebo | Actos 30 mg Raz denne |
|
| Celková populácia HbA1c (%) |
N = 93 | N = 100 |
| Základná hodnota (stredná hodnota) | 10.3 | 10.5 |
| Zmena zo základnej línie (upravený priemer+) | 0.8 | -0.6 |
| Rozdiel oproti placebu (upravený priemer+) | -1.4* | |
| FPG (mg / dl) | N = 91 | N = 99 |
| Základná hodnota (stredná hodnota) | 270 | 273 |
| Zmena zo základnej línie (upravený priemer+) | 8 | -50 |
| Rozdiel oproti placebu (upravený priemer+) | -58* | |
|
+ Upravené na základnú líniu, združené centrum a združené centrum na základe interakcie s liečbou * p â ‰ ¤ 0,050 vs. placebo |
U pacientov, ktorí predtým neboli liečení antidiabetikami (40%), boli priemerné hodnoty pri skríningu 10,3% pre HbA1c a 240 mg / dl pre FPG. Na začiatku je priemerná hodnota HbA1c bol 10,4% a priemerný FPG bol 254 mg / dl. V porovnaní s placebom viedla liečba Actosom 30 mg k zníženiu priemernej HbA oproti východiskovým hodnotám1c 1,0% a priemerný FPG 62 mg / dl. U pacientov, ktorí boli predtým liečení antidiabetikami (60%), sa tento liek pri skríningu prerušil. Priemerné hodnoty pri skríningu boli 9,4% pre HbA1c a 216 mg / dl pre FPG. Na začiatku je priemerná hodnota HbA1c bol 10,6% a priemerný FPG bol 287 mg / dl. V porovnaní s placebom viedla liečba Actosom 30 mg k zníženiu priemernej HbA oproti východiskovým hodnotám1c 1,3% a priemerný FPG 46 mg / dl. U mnohých predtým liečených pacientov HbA1c a FPG sa na konci štúdie nevrátili na úroveň skríningu.
Kombinovaná terapia
Tri 16-týždňové, randomizované, dvojito zaslepené, placebom kontrolované klinické štúdie a tri 24-týždňové, randomizované, dvojito zaslepené, dávkovo kontrolované Uskutočnili sa klinické štúdie na vyhodnotenie účinkov Actosu na kontrolu glykémie u pacientov s diabetom 2. typu, ktorí boli neadekvátni riadený (HbA1c - 8%) napriek súčasnej liečbe sulfonylmočovinou, metformínom alebo inzulínom. Predchádzajúca liečba cukrovky mohla byť monoterapia alebo kombinovaná terapia.
Štúdie Actos Plus Sulfonylmočovina
Uskutočnili sa dve klinické štúdie s Actosom v kombinácii so sulfonylmočovinou. Obe štúdie zahŕňali pacientov s cukrovkou 2. typu na sulfonylmočovine, buď samotných alebo v kombinácii s iným antidiabetikom. Všetky ďalšie antidiabetiká boli stiahnuté pred začiatkom liečby štúdiou. V prvej štúdii bolo randomizovaných 560 pacientov, ktorí dostávali 15 mg alebo 30 mg Actosu alebo placeba jedenkrát denne počas 16 týždňov okrem ich súčasného režimu sulfonylmočoviny. V porovnaní s placebom v 16. týždni pridanie Actosu k sulfonylmočovine významne znížilo priemernú HbA1c o 0,9% a 1,3% a priemerné FPG o 39 mg / dl a 58 mg / dl pre dávky 15 mg a 30 mg.
V druhej štúdii bolo randomizovaných 702 pacientov, ktorí dostávali 30 mg alebo 45 mg Actosu jedenkrát denne počas 24 týždňov, okrem súčasného režimu sulfonylmočoviny. Priemerné zníženie HbA oproti východiskovým hodnotám v 24. týždni1c boli 1,55% a 1,67% pre 30 mg a 45 mg dávky. Priemerné zníženie od základnej hodnoty v FPG bolo 51,5 mg / dl a 56,1 mg / dl.
Terapeutický účinok Actosu v kombinácii so sulfonylmočovinou sa pozoroval u pacientov bez ohľadu na to, či pacienti dostávali nízke, stredné alebo vysoké dávky sulfonylmočoviny.
Štúdie Actos Plus metformínu
Uskutočnili sa dve klinické štúdie s Actosom v kombinácii s metformínom. Obe štúdie zahŕňali pacientov s diabetes mellitus 2. typu na metformíne, buď samotných alebo v kombinácii s iným antidiabetikom. Všetky ďalšie antidiabetiká boli stiahnuté pred začiatkom liečby štúdiou. V prvej štúdii bolo randomizovaných 328 pacientov, ktorí dostávali buď 30 mg Actosu alebo placebo jedenkrát denne počas 16 týždňov navyše k súčasnému režimu s metformínom. V porovnaní s placebom v 16. týždni pridanie Actosu k metformínu významne znížilo priemernú HbA1c o 0,8% a znížil priemerný FPG o 38 mg / dl.
V druhej štúdii bolo randomizovaných 827 pacientov, ktorí dostávali buď 30 mg alebo 45 mg Actosu jedenkrát denne počas 24 týždňov, okrem súčasného režimu s metformínom. Priemerné zníženie HbA oproti východiskovým hodnotám v 24. týždni1c boli 0,80% a 1,01% pre dávky 30 mg a 45 mg. Priemerné zníženie od základnej hodnoty v FPG bolo 38,2 mg / dl a 50,7 mg / dl.
Terapeutický účinok Actosu v kombinácii s metformínom sa pozoroval u pacientov bez ohľadu na to, či pacienti dostávali nižšie alebo vyššie dávky metformínu.
Štúdie inzulínu Actos Plus
Uskutočnili sa dve klinické štúdie s Actosom v kombinácii s inzulínom. Obe štúdie zahŕňali pacientov s cukrovkou 2. typu na inzulíne, buď samotných alebo v kombinácii s iným antidiabetikom. Všetky ďalšie antidiabetiká boli stiahnuté pred začiatkom liečby štúdiou. V prvej štúdii bolo randomizovaných 566 pacientov, ktorí dostávali medián 60,5 jednotiek za deň dostávajú buď 15 mg alebo 30 mg Actosu alebo placeba jedenkrát denne počas 16 týždňov spolu s inzulínom režimom. V porovnaní s placebom v 16. týždni pridanie Actosu k inzulínu významne znížilo obidve HbA1c o 0,7% a 1,0% a FPG o 35 mg / dl a 49 mg / dl pre dávku 15 mg a 30 mg.
V druhej štúdii dostalo 690 pacientov, ktorí dostávali medián 60,0 jednotiek inzulínu za deň, buď 30 mg alebo 45 mg Actosu jedenkrát denne počas 24 týždňov, navyše k ich súčasnému inzulínovému režimu. Priemerné zníženie HbA oproti východiskovým hodnotám v 24. týždni1c boli 1,17% a 1,46% pre dávky 30 mg a 45 mg. Priemerné zníženie od základnej hodnoty v FPG bolo 31,9 mg / dl a 45,8 mg / dl. Zlepšená kontrola glykémie bola sprevádzaná priemerným poklesom požiadaviek na dávku inzulínu oproti východiskovým hodnotám o 6,0% a 9,4% za deň pre dávku 30 mg a 45 mg.
Terapeutický účinok Actosu v kombinácii s inzulínom sa pozoroval u pacientov bez ohľadu na to, či pacienti dostávali nižšie alebo vyššie dávky inzulínu.
top
Indikácie a použitie
Actos je indikovaný ako doplnok výživy a cvičenia na zlepšenie kontroly glykémie u dospelých s diabetes mellitus 2. typu.
top
kontraindikácie
Začatie liečby Actosom u pacientov so sídlom v New York Heart Association (NYHA) je srdcové zlyhanie triedy III alebo IV kontraindikované (pozri pozri časť 4.8). VAROVANIE BOXED).
Actos je kontraindikovaný u pacientov so známou precitlivenosťou na tento liek alebo na niektorú z jeho zložiek.
top
varovanie
Srdcové zlyhanie a ďalšie srdcové účinky
Actos, rovnako ako iné tiazolidíndióny, môže spôsobiť retenciu tekutín, ak sa používa samostatne alebo v kombinácii s inými antidiabetikami vrátane inzulínu. Retencia tekutín môže viesť alebo zhoršiť srdcové zlyhanie. U pacientov by sa mali sledovať príznaky a príznaky srdcového zlyhania. Ak sa tieto príznaky a príznaky objavia, zlyhanie srdca sa má liečiť podľa súčasných štandardov starostlivosti. Okrem toho sa musí zvážiť ukončenie liečby alebo zníženie dávky Actosu (pozri časť 4.2) VAROVANIE BOXED). Pacienti so srdcovým stavom NYHA triedy III a IV sa neskúmali počas predbežných schvaľovacích klinických skúšok a Actos sa u týchto pacientov neodporúča (pozri časť 4.8). VAROVANIE BOXED a Kontraindikácie).
V jednej 16týždňovej dvojito zaslepenej, placebom kontrolovanej klinickej štúdii zahŕňajúcej 566 pacientov s typom 2 diabetes, Actos v dávkach 15 mg a 30 mg v kombinácii s inzulínom sa porovnával s inzulínovou terapiou sám. Táto štúdia zahŕňala pacientov s dlhodobým diabetom a vysokou prevalenciou už existujúcich zdravotných stavov: arteriálna hypertenzia (57,2%), periférna neuropatia (22,6%), ischemická choroba srdca (19,6%), retinopatia (13,1%), myokard infarkt (8,8%), cievne ochorenie (6,4%), angína pectoris (4,4%), mozgová porážka a / alebo prechodný ischemický záchvat (4,1%) a kongestívne srdcové zlyhanie (2,3%).
V tejto štúdii dvaja z 191 pacientov užívajúcich 15 mg Actosu plus inzulín (1,1%) a dvaja zo 188 pacientov užívajúcich 30 mg Actos plus inzulín (1,1%) sa vyvinuli kongestívne srdcové zlyhanie v porovnaní so žiadnym z 187 pacientov liečených samotnou inzulínom. Všetci štyria z týchto pacientov mali predchádzajúcu históriu kardiovaskulárnych stavov vrátane ochorenia koronárnych artérií, predchádzajúcich postupov CABG a infarktu myokardu. V 24-týždňovej, dávkovo kontrolovanej štúdii, v ktorej sa Actos podával súčasne s inzulínom, 0,3% pacientov (1/345) pri 30 mg a 0,9% (3/345) pacientov po 45 mg hlásilo CHF ako závažnú nežiaducu udalosť ,
Analýza údajov z týchto štúdií neidentifikovala špecifické faktory, ktoré predpovedajú zvýšené riziko kongestívneho zlyhania srdca pri kombinovanej liečbe s inzulínom.
Pri cukrovke 2. typu a kongestívnom zlyhaní srdca (systolická dysfunkcia)
Bola vykonaná 24-týždňová postmarketingová štúdia bezpečnosti s cieľom porovnať Actos (n = 262) s glyburidom (n = 256) u nekontrolovaných diabetických pacientov (priemerná HbA).1c 8,8% na začiatku štúdie) so zlyhaním srdca NYHA triedy II a III a ejekčnou frakciou menej ako 40% (priemer EF 30% na začiatku). V priebehu štúdie bola nočná hospitalizácia pre kongestívne zlyhanie srdca hlásená u 9,9% pacientov pacientov na Actose v porovnaní so 4,7% pacientov na glyburide s rozdielom v liečbe pozorovaným od 6 týždňov. Táto nežiaduca udalosť spojená s liekom Actos bola výraznejšia u pacientov užívajúcich inzulín na začiatku liečby a u pacientov starších ako 64 rokov. Medzi liečenými skupinami nebol pozorovaný žiadny rozdiel v kardiovaskulárnej úmrtnosti.
Actos sa má začať podávať s najnižšou schválenou dávkou, ak je predpísaná pre pacientov s cukrovkou 2. typu a systolickým srdcovým zlyhaním (NYHA trieda II). Ak je potrebné následné zvýšenie dávky, dávka sa má zvyšovať postupne až po niekoľkých mesiacov liečby s dôkladným sledovaním prírastku hmotnosti, opuchu alebo príznakov a príznakov CHF exacerbácie.
Prospektívny klinický pokus s pioglitazónom pri makrovaskulárnych príhodách (aktívny)
U PROaktívnych bolo 5238 pacientov s cukrovkou 2. typu a anamnézou makrovaskulárnej choroby liečených Actosom (n = 2605), titrovaných silou až do 45 mg raz denne alebo placebom (n = 2633) (pozri pozri časť 4.8). NEŽIADUCE REAKCIE). Percento pacientov, u ktorých došlo k závažnému srdcovému zlyhaniu, bolo vyššie u pacientov liečených Actosom (5,7%, n = 149) ako u pacientov liečených placebom (4,1%, n = 108). Výskyt smrti po hlásení závažného srdcového zlyhania bol 1,5% (n = 40) u pacientov liečených Actosom a 1,4% (n = 37) u pacientov liečených placebom. U pacientov liečených režimom obsahujúcim inzulín na začiatku štúdie bol výskyt závažného srdcového zlyhania 6,3% (n = 54/864) pri Actose a 5,2% (n = 47/896) pri placebe. U pacientov liečených na začiatku liečby režimom obsahujúcim sulfonylmočovinu bol výskyt závažného srdcového zlyhania 5,8% (n = 94/1624) u Actosu a 4,4% (n = 71/1626) u placeba.
top
Opatrenia
všeobecný
Actos má antihyperglykemický účinok iba v prítomnosti inzulínu. Actos by sa preto nemal používať u pacientov s diabetom 1. typu alebo na liečbu diabetickej ketoacidózy.
Hypoglykémia: U pacientov, ktorí dostávajú Actos v kombinácii s inzulínom alebo perorálnymi hypoglykemickými látkami, môže byť riziko hypoglykémie ohrozené a môže byť potrebné zníženie dávky sprievodného lieku.
Kardiovaskulárne ochorenia: V amerických placebom kontrolovaných klinických štúdiách, ktoré vylučovali pacientov so srdcovým stavom triedy III a IV New York Heart Association (NYHA), bol výskyt u pacientov liečených Actosom v monoterapii alebo v kombinácii so sulfonylmočovinami alebo metformínom sa nezvýšili závažné srdcové nežiaduce účinky súvisiace s expanziou objemu vs. pacienti liečení placebom. V štúdiách s kombináciou inzulínu malý počet pacientov s anamnézou predtým existujúcej anamnézy pri srdcovom ochorení sa pri liečbe Actosom v kombinácii s inzulínom vyvinula kongestívne zlyhanie srdca (pozri UPOZORNENIE). Pacienti so srdcovým stavom NYHA triedy III a IV sa v týchto klinických štúdiách s Actosom neskúmali. Actos nie je indikovaný u pacientov so srdcovým stavom triedy NYHA III alebo IV.
V postmarketingových skúsenostiach s Actosom boli hlásené prípady kongestívneho srdcového zlyhania u pacientov so srdcovým ochorením aj bez neho.
Edém: Actos sa má používať opatrne u pacientov s edémom. Vo všetkých klinických štúdiách v USA bol edém hlásený častejšie u pacientov liečených Actosom ako u pacientov liečených placebom a zdá sa, že súvisí s dávkou (pozri pozri časť 4.8). NEŽIADUCE REAKCIE). V postmarketingových skúsenostiach boli hlásené prípady začatia alebo zhoršenia edému. Keďže tiazolidíndióny vrátane Actosu môžu spôsobiť zadržiavanie tekutín, ktoré môže zhoršiť alebo viesť k kongestívnemu srdcovému zlyhaniu, Actos sa má používať opatrne u pacientov s rizikom srdcového zlyhania. U pacientov sa majú sledovať príznaky a príznaky srdcového zlyhania (pozri 4.2 VAROVANIE BOXED, UPOZORNENIEa OPATRENIA).
Prírastok na hmotnosti: Prírastok hmotnosti súvisiaci s dávkou sa pozoroval iba pri Actose a v kombinácii s inými hypoglykemickými látkami (tabuľka 6). Mechanizmus nárastu hmotnosti je nejasný, ale pravdepodobne zahŕňa kombináciu zadržiavania tekutín a hromadenia tuku.
Tabuľka 6 Zmeny hmotnosti (kg) oproti základnej línii počas dvojito slepých klinických pokusov s Actosom
| Kontrolná skupina (Placebo) |
actos 15 mg |
actos 30 mg |
actos 45 mg |
||
| medián (25th/75th percentil) |
medián (25th/75th percentil) |
medián (25th/75th percentil) |
medián (25th/75th percentil) |
||
| monoterapia | -1.4 (-2.7/0.0) n = 256 |
0.9(-0.5/3.4) n = 79 |
1.0(-0.9/3.4) n = 188 |
2.6 (0.2/5.4) n = 79 |
|
| Kombinovaná terapia | sulfonylmočovina | -0.5 (-1.8/0.7) n = 187 |
2.0 (0.2/3.2) n = 183 |
3.1 (1.1/5.4) n = 528 |
4.1 (1.8/7.3) n = 333 |
| metformín | -1.4 (-3.2/0.3) n = 160 |
N / A | 0.9(-0.3/3.2) n = 567 |
1.8(-0.9/5.0) n = 407 |
|
| inzulín | 0.2 (-1.4/1.4) n = 182 |
2.3 (0.5/4.3) n = 190 |
3.3 (0.9/6.3) n = 522 |
4.1 (1.4/6.8) n = 338 |
|
| Poznámka: Skúšobné trvanie 16 až 26 týždňov |
Ovulácia: Liečba Actosom, podobne ako iné tiazolidíndióny, môže u niektorých premenopauzálnych anovulačných žien viesť k ovulácii. V dôsledku toho môžu byť u týchto pacientov počas užívania Actosu zvýšené riziko otehotnenia. Preto by sa mala u premenopauzálnych žien odporučiť primeraná antikoncepcia. Tento možný účinok sa v klinických štúdiách neskúmal, takže frekvencia tohto výskytu nie je známa.
Hematologické: Actos môže spôsobiť zníženie hemoglobínu a hematokritu. Vo všetkých klinických štúdiách sa priemerné hodnoty hemoglobínu u pacientov liečených Actosom znížili o 2% až 4%. Tieto zmeny sa vyskytli predovšetkým počas prvých 4 až 12 týždňov liečby a potom zostali relatívne konštantné. Tieto zmeny môžu súvisieť so zvýšeným objemom plazmy a zriedkavo sa spájajú s akýmikoľvek významnými hematologickými klinickými účinkami (pozri časť 5.2) NEŽIADUCE REAKCIE, Laboratórne abnormality).
Pečeňové účinky: V predsúhlasných klinických štúdiách na celom svete bolo Actosom liečených viac ako 4500 jedincov. V klinických štúdiách v USA dostalo Actos viac ako 4700 pacientov s diabetom 2. typu. V klinických štúdiách sa nepreukázala hepatotoxicita vyvolaná liekom alebo zvýšenie hladín ALT.
Počas predbežne schválených placebom kontrolovaných klinických štúdií v USA celkom 4 z 1 266 (0,26%) pacientov liečení Actosom a 2 zo 793 (0,25%) placebom liečených pacientov mali hodnoty ALT ‰ times trojnásobok hornej hranice normálu. Zvýšenie ALT u pacientov liečených Actosom bolo reverzibilné a jednoznačne nesúviselo s liečbou Actosom.
Po uvedení lieku Actos na trh boli hlásené prípady hepatitídy a zvýšenia hladiny pečeňových enzýmov až na trojnásobok alebo viacnásobok hornej hranice normy. Veľmi zriedkavo tieto správy zahŕňali zlyhanie pečene s fatálnym následkom a bez neho, hoci príčinná súvislosť nebola stanovená.
Do dostupnosti výsledkov ďalších veľkých, dlhodobých kontrolovaných klinických skúšok a ďalších po uvedení na trh údaje o bezpečnosti sa odporúča, aby sa pacienti liečení Actosom pravidelne kontrolovali pečeň enzýmy.
Hladiny ALT v sére (alanínaminotransferáza) sa majú vyhodnotiť pred začatím liečby Actos u všetkých pacientov a potom pravidelne na základe klinického posúdenia zdravotnej starostlivosti profesionál. Testy funkcie pečene by sa mali získať aj u pacientov, ak sa vyskytnú príznaky naznačujúce dysfunkciu pečene, napr. Nevoľnosť, vracanie, bolesť brucha, únava, anorexia alebo tmavý moč. Rozhodnutie, či má pacient pokračovať v liečbe liekom Actos, by sa malo riadiť klinickým úsudkom čakajúcim na laboratórne vyšetrenia. Ak je pozorovaná žltačka, lieková terapia by sa mala prerušiť.
Liečba liekom Actos by sa nemala začať, ak pacient vykazuje klinické príznaky aktívneho ochorenia pečene alebo ak hladiny ALT prekročia 2,5-násobok hornej hranice normy. Pacienti s mierne zvýšenými pečeňovými enzýmami (hladiny ALT 1 až 2,5-násobkom hornej hranice normy) pri na stanovenie príčiny pečeňového enzýmu sa má vyhodnotiť východisková hodnota alebo kedykoľvek počas liečby Actosom nadmorská výška. U pacientov s mierne zvýšenými pečeňovými enzýmami by sa malo začať alebo pokračovať v liečbe Actosom s opatrnosťou a zahŕňajú vhodné klinické sledovanie, ktoré môže zahŕňať častejší enzým pečene monitorovanie. Ak sa hladiny transaminázy v sére zvýšia (ALT> 2,5-násobok hornej hranice normy), pečeň funkčné testy by sa mali hodnotiť častejšie, až kým sa hladiny nevrátia k normálu alebo pred liečbou hodnôt. Ak hladiny ALT prekročia trojnásobok hornej hranice normy, test by sa mal opakovať čo najskôr. Ak hladina ALT zostane> 3-násobkom hornej hranice normy alebo ak je u pacienta žltačka, liečba Actosom sa musí prerušiť.
Makulárny edém: Makulárny edém bol hlásený po uvedení lieku na trh u diabetických pacientov, ktorí užívali pioglitazón alebo iný tiazolidíndión. Niektorí pacienti mali rozmazané videnie alebo zníženú zrakovú ostrosť, zdá sa však, že u niektorých pacientov bola diagnostikovaná rutinná oftalmologická prehliadka. Niektorí pacienti mali periférny edém v čase diagnostikovania makulárneho edému. U niektorých pacientov sa po vysadení tiazolidíndiónu zlepšil ich makulárny edém. Nie je známe, či existuje alebo nie je príčinná súvislosť medzi pioglitazónom a makulárnym edémom. Pacienti s diabetom by mali mať pravidelné očné vyšetrenie oftalmológom podľa štandardov starostlivosti americkej asociácie pre cukrovku. Okrem toho by mal byť každý diabetik, ktorý hlási akýkoľvek vizuálny príznak, okamžite odoslaný k očnému lekárovi bez ohľadu na základné lieky alebo iné fyzické nálezy pacienta (pozri NEŽIADUCE REAKCIE).
Zlomeniny: V randomizovanej štúdii (PROaktívne) u pacientov s diabetom 2. typu (priemerné trvanie liečby) cukrovka 9,5 roka), bol u žien užívajúcich ženy zaznamenaný zvýšený výskyt zlomenín kostí pioglitazón. Počas priemerného sledovania 34,5 mesiaca bol výskyt zlomenín kostí u žien 5,1% (44/870) u pioglitazónu oproti 2,5% (23/905) u placeba. Tento rozdiel bol zaznamenaný po prvom roku liečby a zostal v priebehu štúdie. Väčšina fraktúr pozorovaných u pacientiek boli nevertebrálne fraktúry vrátane dolnej končatiny a distálnej hornej končatiny. U mužov liečených pioglitazónom 1,7% (30/1735) oproti placebu 2,1% (37/1728) sa nepozorovalo žiadne zvýšenie počtu zlomenín. Pri liečbe pacientov, najmä pacientiek, ktoré sa liečia, by sa malo vziať do úvahy riziko zlomenín pioglitazónu a pozornosť by sa mala venovať hodnoteniu a udržiavaniu zdravotného stavu kostí podľa súčasných štandardov starostlivosti.
Makrovaskulárne výsledky: Neuskutočnili sa žiadne klinické štúdie, ktoré by preukázali presvedčivý dôkaz o znížení makrovaskulárneho rizika s Actosom alebo akýmkoľvek iným antidiabetickým liekom.
Laboratórne testy
FPG a HbA1c merania by sa mali vykonávať pravidelne, aby sa monitorovala kontrola glykémie a terapeutická odpoveď na Actos.
Monitorovanie pečeňových enzýmov sa odporúča pred začatím liečby Actosom u všetkých pacientov a potom pravidelne podľa klinického úsudku zdravotníckeho personálu (pozri časť 4.8). OPATRENIA, Všeobecné, hepatické účinky a NEŽIADUCE REAKCIEHladiny sérovej transaminázy).
Informácie pre pacientov
Je dôležité poučiť pacientov, aby dodržiavali diétne pokyny, a aby sa pravidelne kontrolovali hladiny glukózy v krvi a glykozylovaného hemoglobínu. Počas období stresu, ako je horúčka, trauma, infekcia alebo chirurgický zákrok, sa môžu požiadavky na lieky zmeniť a pacienti by mali byť upozornení, aby okamžite vyhľadali lekársku pomoc.
Pacienti, u ktorých sa objaví nezvyčajne rýchly nárast hmotnosti alebo opuchov alebo ktorí trpia dýchavičnosťou alebo iné príznaky srdcového zlyhania počas liečby Actosom by ich mali tieto príznaky okamžite nahlásiť lekár.
Pacienti majú byť informovaní, že krvné testy na funkciu pečene sa vykonajú pred začiatkom liečby a potom pravidelne podľa klinického úsudku lekára. Pacienti majú byť poučení, aby okamžite vyhľadali lekársku pomoc pre nevysvetlenú nevoľnosť, vracanie, bolesti brucha, únavu, anorexiu alebo tmavý moč.
Pacientov treba informovať, aby užívali Actos raz denne. Actos sa môže užívať s jedlom alebo bez jedla. Ak sa dávka vynechá jeden deň, dávka sa nemá nasledujúci deň zdvojnásobiť.
Pri použití kombinovanej terapie s inzulínom alebo perorálnymi hypoglykemickými látkami sú riziká hypoglykémie, jej príznaky a liečbe a stavom, ktoré predisponujú k jej vývoju, by sa mali vysvetliť pacientom a ich rodinám Členovia.
Liečba Actosom, rovnako ako iné tiazolidíndióny, môže u niektorých premenopauzálnych anovulačných žien viesť k ovulácii. V dôsledku toho môžu byť u týchto pacientov počas užívania Actosu zvýšené riziko otehotnenia. Preto by sa mala u premenopauzálnych žien odporučiť primeraná antikoncepcia. Tento možný účinok sa v klinických štúdiách neskúmal, takže frekvencia tohto výskytu nie je známa.
Liekové interakcie
Štúdie liekových interakcií in vivo naznačujú, že pioglitazón môže byť slabým induktorom substrátu izoformy 3A4 CYP 450 (pozri pozri časť 4.8). KLINICKÁ FARMAKOLÓGIA, Metabolizmus a Interakcie liečivo-liečivo).
Enzýmový inhibítor CYP2C8 (ako je gemfibrozil) môže významne zvýšiť AUC pioglitazón a enzýmový induktor CYP2C8 (ako je rifampín) môžu významne znížiť AUC pioglitazón. Preto, ak sa inhibítor alebo induktor CYP2C8 začne alebo zastaví počas liečby pioglitazónom, môžu byť potrebné zmeny v liečbe cukrovky na základe klinickej odpovede (pozri pozri časť 4.4). KLINICKÁ FARMAKOLÓGIA, Interakcie liečivo-liečivo).
Karcinogenéza, mutagenéza, poškodenie plodnosti
U samcov a samíc potkanov sa pri perorálnych dávkach do 63 mg / kg (približne 14-násobok maximálnej odporúčanej perorálnej dávky u ľudí 45 mg na základe mg / m2) vykonala dvojročná štúdia karcinogenity. Nádory vyvolané liečivom sa nepozorovali v žiadnom orgáne okrem močového mechúra. Benígne a / alebo malígne nádory prechodných buniek sa pozorovali u samcov potkanov pri dávke 4 mg / kg / deň a vyššej (približne rovnajúcej sa maximálnej odporúčanej orálnej dávke pre človeka na základe mg / m2). U samcov a samíc myší sa vykonala dvojročná štúdia karcinogenity v perorálnych dávkach do 100 mg / kg / deň (približne 11-násobok maximálnej odporúčanej perorálnej dávky u ľudí na základe mg / m2). V žiadnom orgáne neboli pozorované žiadne nádory vyvolané liečivom.
Počas prospektívneho hodnotenia cytologie moču zahŕňajúceho viac ako 1800 pacientov, ktorí dostávali Actos v klinických štúdiách v trvaní až jeden rok, sa nezistili žiadne nové prípady nádorov močového mechúra. V dvoch trojročných štúdiách, v ktorých bol pioglitazón porovnávaný s placebom alebo glyburidom, bolo 16/3656 (0,44%). správy o rakovine močového mechúra u pacientov užívajúcich pioglitazón v porovnaní s 5/3679 (0,14%) u pacientov, ktorí neužívajú pioglitazón. Po vylúčení pacientov, u ktorých bola v čase diagnózy rakoviny močového mechúra expozícia študovanému lieku kratšia ako jeden rok, sa vyskytlo šesť (0,16%) prípadov na pioglitazóne a dva (0,05%) na placebe.
Pioglitazón HCI nebol mutagénny v skupine štúdií genetickej toxikológie vrátane bakteriálneho testu Ames, génu pre vývoj cicavčích buniek mutačný test (CHO / HPRT a AS52 / XPRT), in vitro cytogenetický test využívajúci bunky CHL, neplánovaný test syntézy DNA a mikronukleus in vivo Test.
U samcov a samíc potkanov pri perorálnych dávkach do 40 mg / kg pioglitazónu HCl denne neboli pozorované žiadne nepriaznivé účinky na fertilitu. pred a počas párenia a gravidity (približne 9-násobok maximálnej odporúčanej perorálnej dávky pre človeka na základe mg / m2).
Toxikológia zvierat
Zväčšenie srdca bolo pozorované u myší (100 mg / kg), potkanov (4 mg / kg a viac) a psov (3 mg / kg) liečených perorálne pioglitazón HCI (približne 11, 1 a 2-násobok maximálnej odporúčanej perorálnej dávky u ľudí pre myši, potkany a psy), vztiahnuté na mg / m2). V jednoročnej štúdii na potkanoch sa vyskytla včasná smrť súvisiaca s liekom v dôsledku zjavnej srdcovej dysfunkcie perorálna dávka 160 mg / kg / deň (približne 35-násobok maximálnej odporúčanej perorálnej dávky pre človeka na základe mg / m2). Zväčšenie srdca sa pozorovalo v 13-týždňovej štúdii u opíc pri perorálnych dávkach 8,9 mg / kg a vyšších (približne 4-násobok maximálnej odporúčanej perorálnej dávky u ľudí na základe mg / m)2), ale nie v 52-týždňovej štúdii pri perorálnych dávkach do 32 mg / kg (približne 13-násobok maximálnej odporúčanej orálnej dávky pre človeka na základe mg / m)2).
tehotenstvo
Tehotenstvo kategória C. Pioglitazón nebol teratogénny u potkanov pri perorálnych dávkach do 80 mg / kg alebo u králikov podaných do 160 mg / kg počas organogenézy (približne 17 a 40-násobok maximálnej odporúčanej perorálnej dávky pre človeka) v mg / m2, resp.). Oneskorený pôrod a embryotoxicita (čo dokazujú zvýšené straty poimplantacii, oneskorený vývoj a znížená hmotnosť plodu) boli pozorované u potkanov pri perorálnych dávkach 40 mg / kg / deň a vyšších (približne 10-násobok maximálnej odporúčanej perorálnej dávky u ľudí na základe mg / m2). U potomkov potkanov sa nepozorovala žiadna funkčná alebo behaviorálna toxicita. U králikov sa embryotoxicita pozorovala pri perorálnej dávke 160 mg / kg (približne 40-násobok maximálnej odporúčanej perorálnej dávky u ľudí na základe mg / m)2). U potomstva potkanov pri perorálnych dávkach 10 mg / kg sa pozoroval oneskorený postnatálny vývoj, ktorý sa pripisuje zníženej telesnej hmotnosti. a vyššie počas neskorého tehotenstva a laktácie (približne 2-násobok maximálnej odporúčanej perorálnej dávky pre človeka na základe mg / m2).
Neexistujú dostatočné a dobre kontrolované štúdie u tehotných žien. Actos sa má používať počas gravidity iba vtedy, ak potenciálny prínos odôvodňuje potenciálne riziko pre plod.
Pretože súčasné informácie silne naznačujú, že abnormálne hladiny glukózy v krvi počas tehotenstva sú spojené s vyšším výskytom vrodených anomálií. ako zvýšená novorodenecká morbidita a mortalita, väčšina odborníkov odporúča, aby sa inzulín používal počas tehotenstva na udržanie hladín glukózy v krvi tak blízko normálnym, je to možné.
Dojčiace matky
Pioglitazón sa vylučuje do mlieka dojčiacich potkanov. Nie je známe, či sa Actos vylučuje do materského mlieka. Pretože veľa liekov sa vylučuje do materského mlieka, Actos sa nemá podávať dojčiacej žene.
Pediatrické použitie
Bezpečnosť a účinnosť Actosu u pediatrických pacientov nebola stanovená.
Použitie pre starších ľudí
Približne 500 pacientov v placebom kontrolovaných klinických štúdiách s Actosom bolo 65 a viac rokov. Medzi týmito pacientmi a mladšími pacientmi neboli pozorované žiadne významné rozdiely v účinnosti a bezpečnosti.
top
Nežiaduce reakcie
V randomizovaných, dvojito zaslepených, kontrolovaných klinických štúdiách bolo liečených Actosom viac ako 8500 pacientov s diabetom 2. typu. Zahŕňa to 2605 vysokorizikových pacientov s cukrovkou 2. typu, ktorí boli liečení Actosom z proaktívnej klinickej skúšky. Viac ako 6 000 pacientov bolo liečených 6 mesiacov alebo dlhšie a viac ako 4500 pacientov počas jedného roka alebo dlhšie. Viac ako 3 000 pacientov dostávalo Actos najmenej 2 roky.
Celkový výskyt a typy nežiaducich udalostí hlásené v placebom kontrolovaných klinických skúšaniach s monoterapiou Actosom v dávkach 7,5 mg, 15 mg, 30 mg alebo 45 mg jedenkrát denne sú uvedené v tabuľke 7.
Tabuľka 7 Placebo-kontrolované klinické štúdie s monoterapiou Actos: nežiaduce účinky hlásené s frekvenciou 5% pacientov liečených Actosom
| (% pacientov) | ||
| placebo N = 259 |
actos N = 606 |
|
| Infekcia horných dýchacích ciest | 8.5 | 13.2 |
| bolesť hlavy | 6.9 | 9.1 |
| zápal dutín | 4.6 | 6.3 |
| myalgia | 2.7 | 5.4 |
| Porucha zubov | 2.3 | 5.3 |
| Diabetes Mellitus sa zhoršil | 8.1 | 5.1 |
| zápal hltanu | 0.8 | 5.1 |
Pre väčšinu klinických nežiaducich udalostí bol výskyt podobný u skupín liečených monoterapiou Actosom au tých, ktoré boli liečené v kombinácii so sulfonylmočovinami, metformínom a inzulínom. U pacientov liečených Actosom a inzulínom došlo v porovnaní so samotným inzulínom k zvýšeniu výskytu opuchov.
V 16-týždňovej placebom kontrolovanej štúdii s Actosom a inzulínom (n = 379), 10 pacientov liečených Actosom plus pri inzulíne sa vyvinula dýchavičnosť a v určitom okamihu počas liečby sa vyvinula buď zmena hmotnosti alebo edém. Sedem z týchto 10 pacientov dostalo diuretiká na liečbu týchto príznakov. Toto nebolo hlásené v skupine s inzulínom plus placebom.
Výskyt stiahnutí z placebom kontrolovaných klinických štúdií z dôvodu nepriaznivej udalosti inej ako hyperglykémia bol podobný u pacientov liečených placebom (2,8%) alebo Actosom (3,3%).
V kontrolovaných kombinovaných terapeutických štúdiách so sulfonylmočovinou alebo inzulínom bola hlásená mierna až stredne ťažká hypoglykémia, ktorá sa zdá byť závislá od dávky (pozri pozri časť 4.8). OPATRENIA, General, Hypoglycemia and DÁVKOVANIE A PODÁVANIE, Kombinovaná terapia).
V dvojito zaslepených štúdiách v USA bola anémia hlásená u 2% pacientov liečených Actosom plus sulfonylmočovinou, metformínom alebo inzulínom (pozri pozri časť 4.8). OPATRENIA, General, Hematologic).
V štúdiách monoterapie bol edém hlásený u 4,8% (s dávkami od 7,5 mg do 45 mg) pacientov liečených Actosom oproti 1,2% pacientov liečených placebom. V kombinovaných terapeutických štúdiách bol opuch hlásený u 7,2% pacientov liečených Actosom a sulfonylmočovinami v porovnaní s 2,1% pacientov liečených samotným sulfonylmočovinou. V kombinovaných terapeutických štúdiách s metformínom bol edém hlásený u 6,0% pacientov pri kombinovanej liečbe v porovnaní s 2,5% pacientov užívajúcich metformín samotný. V kombinovaných liečebných štúdiách s inzulínom bol edém hlásený u 15,3% pacientov pri kombinovanej liečbe v porovnaní so 7,0% pacientov liečených samotným inzulínom. Väčšina z týchto udalostí bola považovaná za miernu alebo stredne závažnú (pozri OPATRENIA, General, Edema).
V jednej 16-týždňovej klinickej štúdii kombinovanej liečby inzulín plus Actos sa u viac pacientov vyvinula kongestívne zlyhanie srdca pri kombinovanej terapii (1,1%) v porovnaní so žiadnym samotným inzulínom (pozri pozri časť 4.8). UPOZORNENIE, Srdcové zlyhanie a ďalšie srdcové účinky).
Prospektívny klinický pokus s pioglitazónom pri makrovaskulárnych príhodách (aktívny)
U PROactive bolo 5238 pacientov s cukrovkou 2. typu a anamnézou makrovaskulárnej choroby liečené Actosom (n = 2605), titrované silou až do 45 mg denne alebo placebom (n = 2633) okrem štandardu starostlivosti. Takmer všetky subjekty (95%) dostávali kardiovaskulárne lieky (betablokátory, ACE inhibítory, ARB, blokátory vápnikových kanálov, dusičnany, diuretiká, aspirín, statíny, fibráty). Pacienti mali priemerný vek 61,8 rokov, priemerné trvanie cukrovky 9,5 roka a priemerný HbA1c 8,1%. Priemerná doba sledovania bola 34,5 mesiaca. Primárnym cieľom tohto procesu bolo preskúmať vplyv Actosu na úmrtnosť a makrovaskulárna morbidita u pacientov s diabetes mellitus 2. typu, u ktorých bolo vysoké riziko makrovaskulárne príhody. Primárnou premennou účinnosti bol čas do prvého výskytu akejkoľvek udalosti v kardiovaskulárnom koncovom bode (pozri tabuľku 8 ďalej). Hoci nebol zaznamenaný štatisticky významný rozdiel medzi Actosom a placebom pri 3-ročnom výskyte prvou udalosťou v tomto zložení sa nezvýšila úmrtnosť ani celkové makrovaskulárne príhody Actos.
Tabuľka 8 Počet prvých a celkových udalostí pre každú zložku v rámci kardiovaskulárneho kompozitného koncového bodu
| placebo N = 2633 |
actos N = 2605 |
|||
| Kardiovaskulárne príhody | Prvé udalosti (N) |
Celkový počet udalostí (N) |
Prvé udalosti (N) |
Celkový počet udalostí (N) |
| Akákoľvek udalosť | 572 | 900 | 514 | 803 |
| Úmrtnosť na všetky účely | 122 | 186 | 110 | 177 |
| Nefatálny IM | 118 | 157 | 105 | 131 |
| Mŕtvica | 96 | 119 | 76 | 92 |
| ACS | 63 | 78 | 42 | 65 |
| Srdcový zásah | 101 | 240 | 101 | 195 |
| Amputácia veľkej nohy | 15 | 28 | 9 | 28 |
| Revaskularizácia nôh | 57 | 92 | 71 | 115 |
Boli tiež doručené postmarketingové správy o novom nástupe alebo zhoršení diabetického makulárneho edému so zníženou zrakovou ostrosťou (pozri pozri časť 4.8). OPATRENIA, General, Macular Edema).
Laboratórne abnormality
Hematologické: Actos môže spôsobiť zníženie hemoglobínu a hematokritu. Zdá sa, že pokles hemoglobínu a hematokritu u Actosu súvisí s dávkou. Vo všetkých klinických štúdiách sa priemerné hodnoty hemoglobínu u pacientov liečených Actosom znížili o 2% až 4%. Tieto zmeny sa zvyčajne vyskytli počas prvých 4 až 12 týždňov liečby a potom zostali relatívne stabilné. Tieto zmeny môžu súvisieť so zvýšeným objemom plazmy spojeným s liečbou Actosom a zriedkavo sa spájajú s akýmikoľvek významnými hematologickými klinickými účinkami.
Hladiny sérovej transaminázy: Počas všetkých klinických štúdií v USA malo 14 zo 4780 (0,30%) pacientov liečených Actosom hodnoty ALT ¥ times 3-násobok hornej hranice normy počas liečby. Všetci pacienti s hodnotami sledovania mali reverzibilné zvýšenie ALT. V populácii pacientov liečených Actosom boli priemerné hodnoty bilirubínu, AST, ALT, alkalickej fosfatázy a GGT pri poslednej návšteve znížené v porovnaní s východiskovou hodnotou. Menej ako 0,9% pacientov liečených Actosom bolo vyradených z klinických štúdií v USA kvôli abnormálnym testom funkcie pečene.
V predbežných schvaľovacích klinických štúdiách sa nevyskytli žiadne prípady idiosynkratických reakcií na lieky, ktoré by viedli k zlyhaniu pečene (pozri časť 4.2) OPATRENIA, Všeobecné, hepatické účinky).
Úrovne CPK: Počas požadovaných laboratórnych testov v klinických skúškach sa pozorovali sporadické prechodné zvýšenia hladín kreatínfosfokinázy (CPK). Izolované zvýšenie na viac ako 10-násobok hornej hranice normy bolo zaznamenané u 9 pacientov (hodnoty 2150 až 11400 IU / l). Šesť z týchto pacientov naďalej dostávalo Actos, dvaja pacienti dokončili štúdiu medikácia v čase zvýšenej hodnoty a jeden pacient prerušil štúdiu medikácie kvôli nadmorská výška. Tieto zvýšenia ustúpili bez zjavných klinických následkov. Vzťah týchto udalostí k liečbe Actosom nie je známy.
top
predávkovať
Počas kontrolovaných klinických skúšaní bol hlásený jeden prípad predávkovania Actosom. Mužský pacient užíval 120 mg denne počas štyroch dní, potom 180 mg denne počas siedmich dní. Počas tohto obdobia pacientka poprela akékoľvek klinické príznaky.
V prípade predávkovania sa má začať vhodná podporná liečba podľa klinických príznakov a symptómov pacienta.
top
Dávkovanie a spôsob podávania
Actos sa má užívať jedenkrát denne bez ohľadu na jedlo.
Liečba antidiabetickej liečby by mala byť individualizovaná. V ideálnom prípade by sa reakcia na terapiu mala hodnotiť pomocou HbA1c čo je lepším ukazovateľom dlhodobej glykemickej kontroly ako samotný FPG. HbA1c odráža glykémiu za posledné dva až tri mesiace. Pri klinickom použití sa odporúča, aby boli pacienti liečení Actosom po dobu primeranú na vyhodnotenie zmeny HbA1c (tri mesiace), pokiaľ sa zhorší glykemická kontrola. Po začatí liečby Actosom alebo so zvýšením dávky sa majú pacienti starostlivo sledovať na výskyt nežiaducich udalostí súvisiacich s retenciou tekutín (pozri časť 4.2) VAROVANIE BOXED a UPOZORNENIE).
monoterapia
Monoterapia Actosom u pacientov, ktorí nie sú dostatočne kontrolovaní diétou a cvičením, sa môže začať dávkou 15 mg alebo 30 mg jedenkrát denne. U pacientov, ktorí neodpovedajú na počiatočnú dávku Actosu, sa dávka môže zvyšovať až na 45 mg raz denne. U pacientov, ktorí nereagujú primerane na monoterapiu, sa má zvážiť kombinovaná liečba.
Kombinovaná terapia
Sulfonylmočoviny: Actos v kombinácii so sulfonylmočovinou sa môže začať dávkou 15 mg alebo 30 mg jedenkrát denne. Súčasná dávka sulfonylmočoviny môže pokračovať na začiatku liečby Actosom. Ak pacienti hlásia hypoglykémiu, dávka sulfonylmočoviny sa má znížiť.
Metformín: Actos v kombinácii s metformínom sa môže začať dávkou 15 mg alebo 30 mg raz denne. Súčasná dávka metformínu môže pokračovať na začiatku liečby Actosom. Počas kombinovanej liečby s Actosom je nepravdepodobné, že by dávka metformínu vyžadovala úpravu kvôli hypoglykémii.
Inzulín: Actos v kombinácii s inzulínom sa môže začať dávkou 15 mg alebo 30 mg raz denne. Súčasná dávka inzulínu môže pokračovať na začiatku liečby Actosom. U pacientov, ktorí dostávajú Actos a inzulín, sa dávka inzulínu môže znížiť o 10% až 25%, ak pacient nahlási hypoglykémiu alebo ak koncentrácia glukózy v plazme klesne na menej ako 100 mg / dl. Ďalšie úpravy by sa mali individualizovať na základe odpovede na zníženie hladiny glukózy.
Maximálna odporúčaná dávka
Dávka Actosu by nemala prekročiť 45 mg raz denne v monoterapii alebo v kombinácii so sulfonylmočovinou, metformínom alebo inzulínom.
Úprava dávky u pacientov s renálnou insuficienciou sa neodporúča (pozri časť 4.2) KLINICKÁ FARMAKOLÓGIA, Farmakokinetika a metabolizmus liečiv).
Liečba liekom Actos by sa nemala začať, ak pacient vykazuje klinické príznaky aktívneho ochorenia pečene alebo zvýšené hladiny sérových transamináz (ALT väčšie ako 2,5-násobok hornej hranice normy) na začiatku liečby (pozri OPATRENIA, Všeobecné, hepatické účinky a KLINICKÁ FARMAKOLÓGIA, Osobitné skupiny obyvateľstva, Hepatálna nedostatočnosť). Monitorovanie pečeňových enzýmov sa odporúča všetkým pacientom pred začiatkom liečby Actosom a potom pravidelne (pozri časť 4.2) OPATRENIA, Všeobecné, hepatické účinky).
Nie sú údaje o použití Actosu u pacientov mladších ako 18 rokov; preto sa použitie Actosu u pediatrických pacientov neodporúča.
Nie sú dostupné údaje o použití Actosu v kombinácii s iným tiazolidíndiónom.
top
Ako dodávané
Actos je dostupný v 15 mg, 30 mg a 45 mg tabletách:
15 mg tableta: biela až sivobiela, okrúhla, konvexná, bez ryhy s označením „Actos“ na jednej strane a „15“ na druhej strane, dostupná v:
NDC 64764-151-04 Fľaše po 30
NDC 64764-151-05 Fľaše po 90
NDC 64764-151-06 Fľaše po 500
30 mg tableta: biela až takmer biela, okrúhla, plochá tableta bez ryhy s označením „Actos“ na jednej strane a „30“ na druhej strane, dostupných v:
NDC 64764-301-14 Fľaše po 30
NDC 64764-301-15 Fľaše 90
NDC 64764-301-16 Fľaše po 500
45 mg tableta: biela až takmer biela, okrúhla, plochá tableta bez ryhy s označením „Actos“ na jednej strane a „45“ na druhej strane, dostupných v:
NDC 64764-451-24 Fľaše po 30
NDC 64764-451-25 Fľaše 90
NDC 64764-451-26 Fľaše po 500
skladovanie
Uchovávajte pri teplote 25 ° C (77 ° F); odchýlky povolené na 15 - 30 ° C (pozri regulovanú izbovú teplotu USP). Uchovávajte nádobu tesne uzavretú a chráňte pred vlhkosťou a vlhkosťou.
top
Referencie
- Deng, LJ, a kol. Účinok gemfibrozilu na farmakokinetiku pioglitazónu. Eur J Clin Pharmacol 2005; 61: 831-836, tabuľka 1.
2. Jaakkola, T, a kol. Účinok rifampicínu na farmakokinetiku pioglitazónu. Clin Pharmacol Brit Jour 2006; 61:1 70-78.
Iba Rx
Výrobca:
Takeda Pharmaceutical Company Limited
Osaka, Japonsko
Predajca:
Takeda Pharmaceuticals America, Inc.
Jeden Takeda Parkway
Deerfield, IL 60015
actos® je registrovaná ochranná známka spoločnosti Takeda Pharmaceutical Company Limited a používa sa na základe licencie spoločnosti Takeda Pharmaceuticals America, Inc.
Všetky ostatné názvy ochranných známok sú majetkom príslušných vlastníkov.
Posledná aktualizácia: 08/09
Actos, pioglitazón hcl, informácie o pacientovi (v jednoduchej angličtine)
Podrobné informácie o príznakoch, príznakoch, príčinách, liečbe cukrovky
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
späť k: Prejdite si všetky lieky na diabetes


