Informácie o úplnom predpisovaní Iloperidonu (fanapt)
Názov značky: Fanapt
Generické meno: Iloperidon
Sprievodca predpisovaním Fanapt (Iloperidón) (PDF)
obsah:
Varovanie v rámčeku
Indikácie a použitie
Dávkovanie a spôsob podávania
kontraindikácie
Varovania a bezpečnostné opatrenia
Nežiaduce reakcie
Liekové interakcie
Použitie v špecifických populáciách
Zneužívanie drog a závislosť
predávkovať
popis
Klinická farmakológia
Neklinická toxikológia
Klinické štúdie
Ako dodávané
Sprievodca liekmi Brintellix
VAROVANIE: ZVÝŠENÁ ÚDELNOSŤ U ZÁKLADNÝCH PACIENTOV S PSYCHÓZOU SÚVISIACE S Dementiou
U starších pacientov s psychózou súvisiacou s demenciou liečených antipsychotikami je zvýšené riziko úmrtia. FANAPT nie je schválený na liečbu pacientov s psychózou súvisiacou s demenciou.
Indikácie a použitie
FANAPT® je indikovaný na liečbu schizofrénie u dospelých.
Pri rozhodovaní o alternatívnych spôsoboch liečby, ktoré sú k dispozícii pre tento stav, by mal predpisujúci lekár zvážiť zistenie, že FANAPT je spojený s predĺžením intervalu QTc. Predĺženie intervalu QTc je spojené s niektorými inými liekmi so schopnosťou spôsobiť torsade de arytmia typu pointes, potenciálne fatálna polymorfná komorová tachykardia, ktorá môže viesť k náhlej náhlej smrťou. V mnohých prípadoch by to viedlo k záveru, že iné lieky by sa mali vyskúšať ako prvé. Zatiaľ nie je známe, či FANAPT spôsobí torsade de pointes alebo zvýši mieru náhlej smrti.
Pacienti musia byť titrovaní na účinnú dávku FANAPT-u. Kontrola symptómov sa teda môže oneskoriť počas prvých 1 až 2 týždňov liečby v porovnaní s niektorými inými antipsychotikami, ktoré nevyžadujú podobnú titráciu. Predpisujúci lekári by mali mať na pamäti toto oneskorenie pri výbere antipsychotika na liečbu schizofrénie.
pokračujte v príbehu nižšie
Dávkovanie a spôsob podávania
Zvyčajná dávka
FANAPT sa musí titrovať pomaly z nízkej počiatočnej dávky, aby sa zabránilo ortostatickej hypotenzii v dôsledku jeho alfa-adrenergných blokovacích vlastností. Odporúčaná počiatočná dávka pre tablety FANAPT je 1 mg perorálne dvakrát denne. Dávky sa môžu zvýšiť na dosiahnutie cieľového rozsahu 6 - 12 mg dvakrát denne (12_24 mg / deň), pričom denná úprava dávky nesmie prekročiť 2 mg dvakrát denne (4 mg / deň). Maximálna odporúčaná dávka je 12 mg dvakrát denne (24 mg / deň). Dávky FANAPT nad 24 mg / deň sa v klinických skúšaniach systematicky nevyhodnocovali. Účinnosť sa preukázala pri lieku FANAPT v rozsahu dávok 6 až 12 mg dvakrát denne. Predpisujúci lekári by mali mať na pamäti skutočnosť, že pacienti musia byť titrovaní na účinnú dávku FANAPT-u. Kontrola symptómov sa teda môže oneskoriť počas prvých 1 až 2 týždňov liečby v porovnaní s niektorými inými antipsychotikami, ktoré nevyžadujú podobnú titráciu. Predpisujúci lekári by si mali tiež uvedomiť, že niektoré nežiaduce účinky spojené s užívaním FANAPTu závisia od dávky. FANAPT sa môže podávať bez ohľadu na jedlo.
Dávkovanie v osobitných skupinách obyvateľstva
Úprava dávkovania u pacientov, ktorí súčasne užívajú FANAPT s potenciálnymi inhibítormi CYP2D6: Dávka FANAPT by sa mala znížená o polovicu, keď sa podáva súbežne so silnými inhibítormi CYP2D6, ako je fluoxetín alebo paroxetín. Ak sa inhibítor CYP2D6 stiahne z kombinovanej liečby, dávka FANAPT sa má potom zvýšiť na pôvodnú úroveň.
Úprava dávky u pacientov, ktorí súčasne užívajú FANAPT s potenciálnymi inhibítormi CYP3A4: Dávka FANAPT by sa mala znížená o polovicu, keď sa podáva súbežne so silnými inhibítormi CYP3A4, ako je ketokonazol alebo klaritromycín. Ak sa inhibítor CYP3A4 stiahne z kombinovanej liečby, dávka FANAPT sa má zvýšiť na pôvodnú úroveň.
Úprava dávky u pacientov, ktorí užívajú FANAPT, ktorí sú slabými metabolizátormi CYP2D6: Pre slabých metabolizátorov CYP2D6 by sa dávka FANAPTu mala znížiť o polovicu.
Poškodenie funkcie pečene: U pacientov s miernym poškodením funkcie pečene nie je potrebná úprava dávky FANAPTu. U pacientov so stredne ťažkou poruchou funkcie pečene môže byť potrebné zníženie dávky, ak je to klinicky indikované. FANAPT sa neodporúča pacientom s ťažkým poškodením funkcie pečene.
Údržba
V dlhodobejšej štúdii bol FANAPT účinný v oneskorení času do relapsu u pacientov so schizofréniou, ktorí boli stabilizovaní na FANAPT až na 24 mg / deň. Pacientov treba pravidelne prehodnocovať, aby sa určilo, či je potrebné udržiavaciu liečbu.
Opätovné začatie liečby u pacientov predtým ukončených, aj keď neexistujú žiadne údaje, ktoré by špecificky riešili opätovné začatie liečby pri liečbe sa odporúča dodržať začiatočný titračný plán vždy, keď majú pacienti interval s FANAPTom väčší ako 3 dni.
top
Dávkové formy a sily
Tablety FANAPT sú dostupné v nasledujúcich silách: 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg a 12 mg. Tablety sú biele, okrúhle, ploché, so skosenými hranami a označené logom „“ na jednej strane a s označením sily „1“, „2“, „4“, „6“, „8“, „10“, alebo „12“ na druhej strane.
top
kontraindikácie
FANAPT je kontraindikovaný u osôb so známou precitlivenosťou na liek. Boli hlásené anafylaxia, angioedém a ďalšie reakcie z precitlivenosti.
top
UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA
Zvýšená úmrtnosť starších pacientov s psychózou súvisiacou s demenciou
Antipsychotické lieky zvyšujú celkové riziko úmrtia u starších pacientov s psychózou súvisiacou s demenciou. Analýzy 17 placebom kontrolovaných štúdií s psychózou súvisiacou s demenciou (modálne trvanie 10 týždňov a prevažne u pacientov užívajúcich atypické lieky) antipsychotické lieky) odhalilo riziko úmrtia u pacientov liečených liečivom v rozmedzí od 1,6 do 1,7 násobku rizika u pacientov liečených placebom. V priebehu typickej 10-týždňovej kontrolovanej štúdie bola miera úmrtnosti u pacientov liečených liekom približne 4,5% v porovnaní s mierou približne 2,6% u pacientov liečených placebom.
Aj keď príčiny smrti boli rôzne, zdá sa, že väčšina úmrtí bola buď kardiovaskulárna (napr. Srdcové zlyhanie, náhla smrť) alebo infekčná (napr. Pneumónia). FANAPT nie je schválený na liečbu pacientov s psychózou súvisiacou s demenciou.
Cerebrovaskulárne nežiaduce reakcie vrátane mozgovej mŕtvice u starších pacientov s psychózou súvisiacou s demenciou
V placebom kontrolovaných štúdiách u starších pacientov s demenciou boli pacienti randomizovaní do risperidónu, aripiprazol a olanzapín mali vyšší výskyt mozgovej príhody a prechodného ischemického záchvatu vrátane fatálnych mŕtvica. FANAPT nie je schválený na liečbu pacientov s psychózou súvisiacou s demenciou.
Predĺženie QT
V otvorenej štúdii QTc u pacientov so schizofréniou alebo schizoafektívnou poruchou (n = 160) bol FANAPT spojený s predĺžením QTc o 9 ms pri dávke iloperidónu 12 mg dvakrát denne. Účinok FANAPT-u na QT interval sa zvýšil prítomnosťou metabolickej inhibície CYP450 2D6 alebo 3A4 (paroxetín 20 mg jedenkrát denne a ketokonazol 200 mg dvakrát denne). V podmienkach metabolickej inhibície pre 2D6, ako aj pre 3A4 bol FANAPT 12 mg dvakrát denne spojený s priemerným zvýšením QTcF od základnej hodnoty asi 19 ms.
Počas klinického programu pred uvedením lieku na trh sa nepozorovali žiadne prípady torsade de pointes alebo iných závažných srdcových arytmií.
FANAPT by sa nemal používať v kombinácii s inými liekmi, o ktorých je známe, že predlžujú QTc vrátane triedy 1A (napr. Chinidín, prokaínamid). alebo antiarytmické lieky triedy III (napr. amiodarón, sotalol), antipsychotické lieky (napr. chlórpromazín, tioridazín), antibiotiká (napr. gatifloxacín, moxifloxacín) alebo akúkoľvek inú triedu liekov, o ktorých je známe, že predlžujú QTc interval (napr. pentamidín, levometadyl acetát, metadon). FANAPT sa treba vyhnúť aj u pacientov s vrodeným syndrómom QT a u pacientov s anamnézou srdcových arytmií.
Niektoré okolnosti môžu zvýšiť riziko torsade de pointes a / alebo náhlej smrti v spojení s užívaním liekov, ktoré predlžujú QTc interval, vrátane (1) bradykardie; (2) hypokaliémia alebo hypomagneziémia; (3) súčasné použitie iných liekov, ktoré predlžujú QTc interval; a (4) prítomnosť vrodeného predĺženia QT intervalu; 5. nedávny akútny infarkt myokardu; a / alebo (6) nekompenzované srdcové zlyhanie.
Opatrnosť je potrebná pri predpisovaní FANAPTu liekmi, ktoré inhibujú metabolizmus FANAPT, a u pacientov so zníženou aktivitou CYP2D6.
Odporúča sa, aby pacienti, ktorí sa zvažujú na liečbu FANAPTom, boli vystavení významnému riziku poruchy elektrolytu majú základné hladiny draslíka a horčíka v sére periodicky monitorovanie. Hypokaliémia (a / alebo hypomagneziémia) môže zvýšiť riziko predĺženia QT intervalu a arytmie. FANAPT by sa mal vyhnúť pacientom s anamnézou závažného kardiovaskulárneho ochorenia, napr. QT predĺženie, nedávny akútny infarkt myokardu, nekompenzované srdcové zlyhanie alebo srdcová arytmia. FANAPT sa má vysadiť u pacientov, u ktorých sa zistí pretrvávajúce meranie QTc> 500 ms.
Ak sa u pacientov užívajúcich FANAPT vyskytnú príznaky, ktoré by mohli naznačovať výskyt srdcových arytmií, napr. závrat, búšenie srdca alebo synkopa, predpisujúci by mal začať ďalšie vyšetrenie, vrátane srdca monitorovanie.
Neuroleptický malígny syndróm (NMS)
V súvislosti s podávaním antipsychotík vrátane FANAPTU bol hlásený potenciálne fatálny symptómový komplex, ktorý sa niekedy označuje ako neuroleptický malígny syndróm (NMS). Medzi klinické prejavy patrí hyperpyrexia, stuhnutosť svalov, zmenený duševný stav (vrátane katatonických príznakov) a dôkaz autonómnej nestability (nepravidelný pulz alebo krvný tlak, tachykardia, diaforéza a srdcový rytmus) arytmie). Medzi ďalšie príznaky patria zvýšená kreatínfosfokináza, myoglobinúria (rabdomyolýza) a akútne zlyhanie obličiek. Diagnostické hodnotenie pacientov s týmto syndrómom je komplikované. Pri určovaní diagnózy je dôležité identifikovať prípady, v ktorých klinická prezentácia zahŕňa závažné ochorenie a neliečené alebo nedostatočne liečené extrapyramídové príznaky a symptómy (EPS). Ďalšími dôležitými hľadiskami pri diferenciálnej diagnostike sú centrálna anticholinergická toxicita, úpal, horúčka liečiva a patológia primárneho centrálneho nervového systému (CNS).
Liečba tohto syndrómu by mala zahŕňať: (1) okamžité vysadenie antipsychotických liekov a iných liekov, ktoré nie sú nevyhnutné pre súbežnú liečbu, (2) intenzívna symptomatická liečba a lekárske monitorovanie a (3) liečba akýchkoľvek sprievodných závažných zdravotných problémov, pre ktoré sú k dispozícii špecifické liečby. Neexistuje všeobecná zhoda o špecifických režimoch farmakologickej liečby NMS.
Ak pacient vyžaduje liečbu antipsychotickými liekmi po zotavení sa z NMS, malo by sa starostlivo zvážiť možné opätovné zavedenie liekovej terapie. Pacienta treba starostlivo sledovať, pretože boli hlásené recidívy NMS.
Tardívna dyskinéza
Tardívna dyskinéza je syndróm pozostávajúci z potenciálne ireverzibilných, nedobrovoľných dyskinetických pohybov, ktoré sa môžu vyvinúť u pacientov liečených antipsychotikami. Aj keď sa zdá, že výskyt syndrómu je najvyšší u starších ľudí, najmä starších žien, nie je možné spoliehajú sa na odhady prevalencie, aby na začiatku antipsychotickej liečby predpovedali, u ktorých pacientov je pravdepodobné, že sa vyvinú syndróm. Nie je známe, či sa antipsychotické lieky líšia svojím potenciálom spôsobiť tardívnu dyskinézu.
Predpokladá sa riziko rozvoja oneskorenej dyskinézy a pravdepodobnosť, že sa stane nezvratnou na zvýšenie ako dĺžka liečby a celková kumulatívna dávka podaného antipsychotika zvyšuje. Syndróm sa však môže rozvíjať, aj keď oveľa menej často, po relatívne krátkom období liečby pri nízkych dávkach.
Neexistuje žiadna známa liečba pre preukázané prípady tardívnej dyskinézy, hoci syndróm sa môže prestať čiastočne alebo úplne zmierniť, ak sa antipsychotická liečba zruší. Samotná antipsychotická liečba však môže potlačiť (alebo čiastočne potlačiť) príznaky a symptómy syndrómu, a tým môže maskovať základný proces. Účinok symptomatickej supresie na dlhodobý priebeh syndrómu nie je známy.
Vzhľadom na tieto skutočnosti by sa FANAPT mal predpisovať spôsobom, ktorý s najväčšou pravdepodobnosťou minimalizuje výskyt tardívnej dyskinézy. Chronická antipsychotická liečba by sa mala vo všeobecnosti vyhradiť pre pacientov, ktorí trpia chronickým ochorením, o ktorom je známe, že (1) reaguje antipsychotické lieky a (2) pre ktoré nie sú k dispozícii alternatívne, rovnako účinné, ale potenciálne menej škodlivé liečby alebo privlastniť. U pacientov, ktorí vyžadujú chronickú liečbu, by sa mala hľadať najmenšia dávka a najkratšia doba liečby, ktorá vyvolá uspokojivú klinickú odpoveď. Potreba pokračovania liečby by sa mala pravidelne prehodnocovať.
Ak sa u pacientov užívajúcich FANAPT objavia znaky a príznaky tardívnej dyskinézy, má sa zvážiť prerušenie liečby. Niektorí pacienti však môžu vyžadovať liečbu FANAPTom napriek prítomnosti syndrómu.
Metabolické zmeny
Atypické antipsychotické lieky boli spojené s metabolickými zmenami, ktoré môžu zvýšiť kardiovaskulárne / cerebrovaskulárne riziko. Tieto metabolické zmeny zahŕňajú hyperglykémiu, dyslipidémiu a prírastok telesnej hmotnosti. Aj keď sa ukázalo, že všetky atypické antipsychotické lieky spôsobujú určité metabolické zmeny, každé liečivo v tejto triede má svoj špecifický rizikový profil.
Hyperglykémia a diabetes mellitus
U pacientov liečených atypickými antipsychotikami vrátane FANAPT bola hlásená hyperglykémia, v niektorých prípadoch extrémna a spojená s ketoacidózou alebo hyperosmolárnou kómou alebo smrťou. Posúdenie vzťahu medzi atypickým antipsychotickým použitím a abnormalitami glukózy je komplikované možnosťou zvýšenia riziko pozadia diabetes mellitus u pacientov so schizofréniou a zvyšujúci sa výskyt diabetes mellitus všeobecne populácia. Vzhľadom na tieto nejasnosti nie je úplne objasnený vzťah medzi atypickým antipsychotickým užívaním a nežiaducimi udalosťami súvisiacimi s hyperglykémiou. Epidemiologické štúdie však naznačujú zvýšené riziko nežiaducich udalostí súvisiacich s hyperglykémiou u pacientov liečených atypickými antipsychotikami zahrnutými v týchto štúdiách.
Pacienti so stanovenou diagnózou diabetes mellitus, ktorí začínajú s atypickými antipsychotikami, by sa mali pravidelne sledovať, aby sa zhoršila kontrola glukózy. Pacienti s rizikovými faktormi pre diabetes mellitus (napr. Obezita, cukrovka v rodinnej anamnéze), ktorí začínajú s liečbou atypické antipsychotiká by sa mali podrobiť testovaniu hladiny glukózy v krvi nalačno na začiatku liečby a pravidelne počas nej liečbu. U každého pacienta liečeného atypickými antipsychotikami je potrebné sledovať príznaky hyperglykémie vrátane polydipsie, polyúrie, polyfágie a slabosti. Pacienti, u ktorých sa počas liečby atypickými antipsychotikami objavia príznaky hyperglykémie, by sa mali podrobiť skúšaniu hladiny glukózy v krvi nalačno. V niektorých prípadoch hyperglykémia ustúpila po prerušení atypických antipsychotík; Niektorí pacienti však vyžadovali pokračovanie antidiabetickej liečby napriek prerušeniu podozrivého lieku.
Údaje zo 4-týždňovej štúdie s pevnými dávkami u dospelých jedincov so schizofréniou, v ktorých boli odoberané vzorky krvi nalačno, sú uvedené v tabuľke 1.
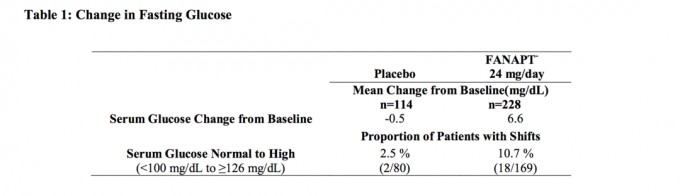
Súhrnné analýzy údajov o glukóze z klinických štúdií vrátane dlhodobých skúšok sú uvedené v tabuľke 2.
dyslipidémia
U pacientov liečených atypickými antipsychotikami boli pozorované nežiaduce zmeny lipidov.
Údaje z placebom kontrolovaného 4-týždňového štúdie s pevnou dávkou, v ktorom boli odoberané vzorky krvi na lačno, u dospelých jedincov so schizofréniou, sú uvedené v tabuľke 3.

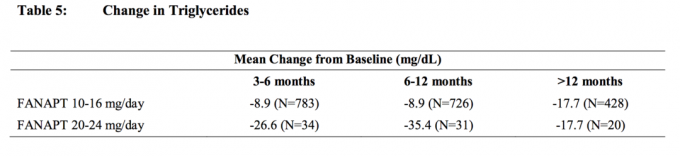
Súhrnné analýzy údajov o cholesterole a triglyceridoch z klinických štúdií vrátane dlhodobejších štúdií sú uvedené v tabuľke 4 a tabuľke 5.

Nabrať váhu
Pri atypickom antipsychotickom použití sa pozoroval prírastok na hmotnosti. Odporúča sa klinické sledovanie hmotnosti.
Vo všetkých krátkodobých a dlhodobých štúdiách bola celková priemerná zmena oproti východiskovým hodnotám v koncovom bode 2,1 kg.
Zmeny telesnej hmotnosti (kg) a podielu jedincov so zvýšením telesnej hmotnosti ≥ 4% od 4 placebom kontrolované, 4- alebo 6-týždňové štúdie s pevnými alebo flexibilnými dávkami u dospelých jedincov sú uvedené v Tabuľka 6.

záchvaty
V krátkodobých placebom kontrolovaných štúdiách (4 až 6 týždňov) sa záchvaty vyskytli u 0,1% (1/1344) pacientov liečených FANAPTom v porovnaní s 0,3% (2/587) placeba. Tak ako u iných antipsychotík, FANAPT sa má používať opatrne u pacientov so záchvatmi v anamnéze alebo so stavmi, ktoré potenciálne znižujú prah záchvatov. Podmienky, ktoré znižujú prah záchvatu, môžu byť častejšie v populácii 65 rokov a staršej.
Ortostatická hypotéza a synkopa
FANAPT môže vyvolať ortostatickú hypotenziu spojenú so závratmi, tachykardiou a synkopou. To odráža jeho alfa1-adrenergné antagonistické vlastnosti. V dvojito slepých placebom kontrolovaných krátkodobých štúdiách, kde sa dávka zvyšovala pomaly, ako sa odporúča vyššie, synkopa bola hlásená u 0,4% (5/1344) pacientov liečených FANAPTom v porovnaní s 0,2% (1/587) placebo. Ortostatická hypotenzia bola hlásená u 5% pacientov, ktorým sa podávalo 20-24 mg / deň, 3% pacientov, ktorým sa podávalo 10 až 16 mg / deň, a 1% pacientov, ktorým sa podávalo placebo. Očakáva sa, že rýchlejšia titrácia zvýši mieru ortostatickej hypotenzie a synkopy.
FANAPT sa má používať opatrne u pacientov so známym kardiovaskulárnym ochorením (napr. Srdcové zlyhanie, anamnéza infarktu myokardu, ischémia alebo vedenie). abnormality), cerebrovaskulárne ochorenie alebo stavy, ktoré predisponujú pacienta k hypotenzii (dehydratácia, hypovolémia a liečba antihypertenzívom). lieky). U pacientov, ktorí sú náchylní na hypotenziu, by sa malo zvážiť monitorovanie ortostatických životných funkcií.
Leukopénia, neutropénia a agranulocytóza
V klinických skúškach a postmarketingových skúsenostiach sa hlásili prípady leukopénie / neutropénie dočasne súvisiace s antipsychotikami. Bola hlásená aj agranulocytóza (vrátane smrteľných prípadov).
Medzi možné rizikové faktory leukopénie / neutropénie patrí preexistujúci nízky počet bielych krviniek (WBC) a leukopénia / neutropénia v anamnéze. U pacientov s už existujúcou nízkou hladinou krvných buniek alebo s leukopéniou / neutropéniou v anamnéze v anamnéze by sa mal sledovať celkový krvný obraz (CBC). často počas prvých mesiacov liečby a FANAPT by sa mal prerušiť pri prvých príznakoch poklesu WBC v neprítomnosti iných príčinných súvislostí faktory.
U pacientov s neutropéniou sa má starostlivo sledovať horúčka alebo iné príznaky alebo príznaky infekcie a ak sa takéto príznaky alebo príznaky vyskytnú, musia sa okamžite liečiť. Pacienti s ťažkou neutropéniou (absolútny počet neutrofilov <1 000 / mm3) majú prerušiť liečbu FANAPT a nechať ich sledovať WBC až do zotavenia.
hyperprolaktinémia
Podobne ako iné lieky, ktoré antagonizujú dopamínové D2 receptory, zvyšuje FANAPT hladiny prolaktínu.
Hyperprolaktinémia môže potlačiť hypotalamický GnRH, čo vedie k zníženej sekrécii gonadotropínu hypofýzy. Toto môže zase inhibovať reprodukčnú funkciu tým, že zhoršuje gonadalsteroidogenézu u žien aj mužov. Pri zlúčeninách zvyšujúcich prolaktín bola hlásená galaktorea, amenorea, gynekomastia a impotencia. Dlhodobá hyperprolaktinémia spojená s hypogonadizmom môže viesť k zníženiu kostnej denzity u žien aj mužov.
Experimenty s tkanivovými kultúrami naznačujú, že približne jedna tretina rakoviny prsníka u ľudí je závislá od prolaktínu in vitro, a faktorom potenciálneho významu, ak sa predpisuje predpisovanie týchto liekov u pacienta s predtým zisteným prsníkom rakovinu. U myší a potkanov liečených FANAPT boli pozorované proliferatívne zmeny a zvýšenie hladiny prolaktínu v sére. Ani doteraz klinické štúdie ani epidemiologické štúdie nepreukázali súvislosť medzi chronickým podávaním tejto skupiny liekov a tumorigenézou u ľudí; dostupné dôkazy sa v súčasnosti považujú za príliš obmedzené na to, aby boli presvedčivé.
V krátkodobej placebom kontrolovanej štúdii (4 týždne) bola priemerná zmena hladín prolaktínu v plazme od základnej hodnoty po konečnú hodnotu v skupine liečenej FANAPTom 24 mg / deň bolo zvýšenie o 2,6 ng / ml v porovnaní so znížením o 6,3 ng / ml v skupine liečenej FANAPTom. placebo-skupiny. V tejto štúdii boli zvýšené plazmatické hladiny prolaktínu pozorované u 26% dospelých liečených FANAPTom v porovnaní s 12% v skupine s placebom. V krátkodobých štúdiách bol FANAPT spájaný s miernymi hladinami zvýšenia prolaktínu v porovnaní s vyššími hladinami prolaktínu pozorovanými u niektorých iných antipsychotík. V súhrnnej analýze z klinických štúdií vrátane dlhodobých štúdií boli gynekomastie u 3210 dospelých liečených iloperidónom hlásené u 2 mužov (0,1%). v porovnaní s 0% u pacientov liečených placebom a galaktorea bola hlásená u 8 žien (0,2%) v porovnaní s 3 ženami (0,5%) u placebom liečených pacienti.
Regulácia telesnej teploty
Antipsychotické látky spôsobujú narušenie schopnosti tela znižovať teplotu tela. Pri predpisovaní FANAPTU pacientom, u ktorých sa vyskytnú stavy, ktoré môžu prispieť k zvýšeniu telesnej hmotnosti, sa odporúča primeraná starostlivosť. teplota, napr. namáhavé pôsobenie, vystavenie extrémnemu teplu, prijímanie sprievodných liekov s anticholinergickou aktivitou alebo vystavenie dehydratácia.
dysfágia
S užívaním antipsychotík je spojená dysmotilita a aspirácia pažeráka. Aspiračná pneumónia je častou príčinou morbidity a mortality u starších pacientov. FANAPT a ďalšie antipsychotické lieky sa majú používať opatrne u pacientov s rizikom aspiračnej pneumónie.
samovražda
Možnosť pokusu o samovraždu je spojená s psychotickým ochorením a protidrogová liečba by mala sprevádzať prísny dohľad nad vysokorizikovými pacientmi. Predpisy pre FANAPT sa majú písať pre najmenšie množstvo tabliet, ktoré je v súlade s dobrým zaobchádzaním s pacientmi, aby sa znížilo riziko predávkovania.
priapizmus
V predmarketingovom programe FANAPT boli hlásené tri prípady priapizmu. Uvádza sa, že lieky s alfa-adrenergnými blokujúcimi účinkami vyvolávajú priapizmus. FANAPT zdieľa túto farmakologickú aktivitu. Závažný priapizmus môže vyžadovať chirurgický zákrok.
Potenciál kognitívnych a motorických porúch
FANAPT, rovnako ako iné antipsychotiká, má potenciál narušiť úsudok, myslenie alebo motorické schopnosti. V krátkodobých placebom kontrolovaných štúdiách bola ospalosť (vrátane sedácie) hlásená u 11,9% (104/874) dospelí pacienti liečení FANAPTom v dávkach 10 mg / deň alebo vyšších v porovnaní s 5,3% (31/587) liečených placebo. Pacienti majú byť opatrní pri obsluhe nebezpečných strojov, vrátane automobilov, až kým si nie sú celkom istí, že liečba FANAPTom na ne nemá nepriaznivý vplyv.
top
Nežiaduce reakcie
Skúsenosti s klinickými štúdiami
Pretože klinické skúšky sa uskutočňujú za veľmi premenlivých podmienok, miera nežiaducich reakcií pozorovaná pri klinickom skúšaní liečiva nemôžu byť priamo porovnávané s mierami v klinických skúškach s iným liekom a nemusia odrážať hodnoty pozorované v klinických štúdiách cvičiť. Informácie uvedené nižšie sú odvodené z databázy klinických štúdií pre FANAPT, ktorá pozostáva z 3229 pacientov vystavených FANAPT v dávkach 10 mg / deň alebo vyšších na liečbu schizofrénie. Z toho 999 dostalo FANAPT najmenej 6 mesiacov, pričom 657 bolo vystavených FANAPT najmenej 12 mesiacov. Všetci títo pacienti, ktorí dostali FANAPT, sa zúčastňovali na viacdávkových klinických štúdiách. Podmienky a trvanie liečby FANAPTom sa značne líšili a zahŕňali (v prekrývajúcich sa kategóriách), otvorené a dvojito zaslepené fázy štúdií, hospitalizácie a ambulancie, štúdie s pevnou a flexibilnou dávkou a krátkodobé a dlhodobé expozície.
Informácie uvedené v týchto častiach boli odvodené zo súhrnných údajov od 4 placebom kontrolovaných, 4- alebo 6-týždňových, štúdie s pevnou alebo flexibilnou dávkou u pacientov, ktorí dostávali FANAPT v denných dávkach v rozmedzí 10 až 24 mg (N = 874).
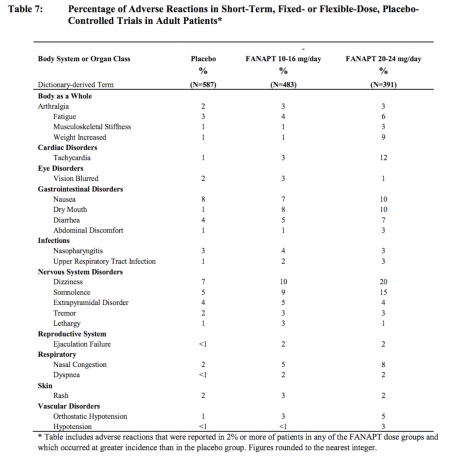
Nežiaduce reakcie, ktoré sa vyskytujú pri výskyte 2% alebo viac u pacientov liečených FANAPT a častejšie ako u placeba
Tabuľka 7 uvádza súhrnný výskyt nežiaducich reakcií, ktoré boli spontánne hlásené u štyroch placebom kontrolovaných, 4 alebo 6 týždňov, štúdie s pevnou alebo flexibilnou dávkou so zoznamom tých reakcií, ktoré sa vyskytli u 2% alebo viac pacientov liečených FANAPTom v ktorejkoľvek z dávok skupín, u ktorých bol výskyt u pacientov liečených FANAPTom v ktorejkoľvek dávkovej skupine vyšší ako výskyt u pacientov liečených placebo.
Nežiaduce reakcie súvisiace s dávkou v klinických pokusoch
Na základe súhrnných údajov zo 4 placebom kontrolovaných, 4- alebo 6-týždňových štúdií s pevnou alebo flexibilnou dávkou, boli nežiaduce reakcie, ktoré sa vyskytli pri viac ako 2% incidencia u pacientov liečených FANAPTom a u ktorých bola incidencia u pacientov liečených FANAPTom 20-24 mg / deň dvakrát vyššia ako incidencia pacienti liečení FANAPTom 10 - 16 mg / deň boli: brušné ťažkosti, závraty, hypotenzia, muskuloskeletálna stuhnutosť, tachykardia a hmotnosť zvýšila.
Časté nežiaduce reakcie súvisiace s liečivami v klinických pokusoch
Na základe súhrnných údajov zo 4 placebom kontrolovaných, 4- alebo 6-týždňových štúdií s pevnou alebo flexibilnou dávkou sa vyskytli nasledujúce nežiaduce reakcie pri ≥ 5% incidencii u liečených pacientov s FANAPTom a najmenej dvakrát potkanom placebom e po dobu najmenej 1 dávky: závraty, sucho v ústach, únava, upchatie nosa, somnolencia, tachykardia, ortostatická hypotenzia a hmotnosť zvýšila. Závrat, tachykardia a zvýšenie telesnej hmotnosti boli pri 20-24 mg / deň najmenej dvakrát častejšie ako pri 10-16 mg / deň.
Extrapyramidálne symptómy (EPS) v klinických skúškach
Súhrnné údaje zo 4 placebom kontrolovaných, 4- alebo 6-týždňových štúdií s pevnou alebo flexibilnou dávkou poskytli informácie týkajúce sa EPS. Údaje o nežiaducich udalostiach zozbierané z týchto pokusov ukázali nasledujúce miery nežiaducich udalostí súvisiacich s EPS, ako je uvedené v tabuľke 8.
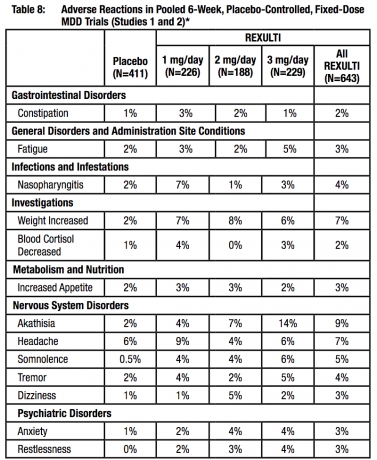
Nežiaduce reakcie spojené s prerušením liečby v klinických pokusoch
Na základe súhrnných údajov zo 4 placebom kontrolovaných, 4- alebo 6-týždňových, fixných alebo flexibilných štúdií o dávke neboli žiadne rozdiel vo výskyte prerušenia liečby v dôsledku nepriaznivých udalostí medzi liečenými FANAPTom (5%) a placebom (5%) pacienti. Typy nežiaducich udalostí, ktoré viedli k prerušeniu liečby, boli podobné u pacientov liečených FANAPTom a placebom.
Demografické rozdiely v nežiaducich reakciách v klinických skúškach
Vyšetrenie podskupín populácie v 4 placebom kontrolovaných, 4- alebo 6-týždňových, fixných alebo štúdie flexibilných dávok neodhalili žiadne dôkazy o rozdieloch v bezpečnosti na základe veku, pohlavie alebo rasa.
Abnormality laboratórnych testov v klinických pokusoch
Medzi FANAPTom a placebom neboli žiadne rozdiely vo výskyte prerušenia liečby v dôsledku zmien v hematológii, analýze moču alebo chémii séra.
V krátkodobých placebom kontrolovaných štúdiách (4 až 6 týždňov) bolo 1,0% (13/1342) pacientov liečených iloperidónom s hematokrit najmenej jedenkrát pod rozšíreným normálnym rozsahom počas post-randomizačnej liečby v porovnaní s 0,3% (2/585) pri placebo. Predĺžený normálny rozsah pre znížený hematokrit bol definovaný v každej z týchto pokusov ako hodnota 15% pod normálnym rozsahom pre centralizované laboratórium, ktoré bolo použité v skúške.
Iné reakcie počas hodnotenia FANAPT pred uvedením na trh
Nasleduje zoznam výrazov MedDRA, ktoré odrážajú nežiaduce reakcie u pacientov liečených FANAPTom pri viacnásobných dávkach ≥ 4 mg / deň počas ktorejkoľvek fázy pokusu s databázou 3210 liečených FANAPTom pacienti. Zahrnuté sú všetky hlásené reakcie s výnimkou tých, ktoré sú už uvedené v tabuľke 7 alebo iných častí nežiaducich reakcií (6), ktoré sú uvedené v Varovania a bezpečnostné opatrenia (5), tie reakčné výrazy, ktoré boli také všeobecné, že boli neinformatívne, reakcie hlásené u menej ako 3 pacientov a ktoré neboli závažné ani život ohrozujúce, reakcie, ktoré sú inak bežné ako vedľajšie reakcie, a reakcie považované za nepravdepodobné, že sú drogami príbuzný.
Reakcie sa ďalej kategorizujú podľa triedy orgánových systémov MedDRA a sú zoradené podľa klesajúcej frekvencie podľa nasledujúceho definície: časté nežiaduce účinky sú tie, ktoré sa vyskytujú najmenej u 1/100 pacientov (v tomto sa objavujú iba tie, ktoré nie sú uvedené v tabuľke 7) zoznam); zriedkavé nežiaduce reakcie sú tie, ktoré sa vyskytujú u 1/100 až 1/1 000 pacientov; zriedkavé udalosti sú tie, ktoré sa vyskytujú u menej ako 1/1 000 pacientov.
Poruchy krvi a lymfatického systému: Zriedkavo - anémia, anémia s nedostatkom železa; vzácnych leukopénia
Srdcové poruchy: časté - palpitácie; Zriedkavé - arytmia, atrioventrikulárny blok prvého stupňa, srdcové zlyhanie (vrátane kongestívneho a akútneho)
Poruchy ucha a labyrintu: Zriedkavé –vertigo, tinnitus
Poruchy endokrinného systému: Zriedkavé - hypotyreóza
Poruchy oka: Časté - zápal spojiviek (vrátane alergie); Zriedkavé - suché oko, blefaritída, opuch očných viečok, opuchy očí, opacity šošoviek, katarakta, hyperémia (vrátane spojovky).
Poruchy a ochorenia gastrointestinálneho traktu: Zriedkavé - gastritída, hypersekrécia v slinách, fekálna inkontinencia, ulcerácia v ústach; Zriedkavé - aftózna stomatitída, dvanástnikový vred, hiátová hernia, hyperchlórhydria, ulcerácia pier, refluxná ezofagitída, stomatitída
Všeobecné poruchy a podmienky správneho miesta: Zriedkavé - opuchy (všeobecne, pitting, kvôli srdcovým chorobám), ťažkosti pri chôdzi, smäd; Zriedkavé - hypertermia
Poruchy pečene a žlčových ciest: Zriedkavé - cholelitiáza
Vyšetrenia: Časté: znížená hmotnosť; Zriedkavé - zníženie hemoglobínu, zvýšenie počtu neutrofilov, zníženie hematokritu
Poruchy metabolizmu a výživy: Zriedkavé - zvýšená chuť do jedla, dehydratácia, hypokaliémia, zadržiavanie tekutín
Poruchy kostrovej a svalovej sústavy a spojivového tkaniva: časté - myalgia, svalové kŕče; Zriedkavé - torticollis
Poruchy nervového systému: Zriedkavo – parestézia, psychomotorická hyperaktivita, nepokoj, amnézia, nystagmus; Syndróm zriedkavých nepokojných nôh
Psychické poruchy: Časté - nepokoj, agresia, klam; Zriedkavé - nepriateľstvo, znížené libido, paranoja, anorgazmia, stav zmätenosti, mánia, katatónia, zmeny nálady, panika záchvat, obsedantno-kompulzívna porucha, bulímia nervosa, delírium, psychogénna polydipsia, porucha kontroly impulzov, veľká depresie
Poruchy obličiek a močových ciest: Časté - močová inkontinencia; Zriedkavo - dysúria, pollakiúria, enuréza, nefrolitiáza; Zriedkavé - zadržiavanie moču, akútne zlyhanie obličiek
Poruchy reprodukčného systému a prsníka: Častá - erektilná dysfunkcia; Zriedkavé - bolesť semenníkov, amenorea, bolesť prsníkov; Zriedkavé - nepravidelná menštruácia, gynekomastia, menorágia, metrorágia, postmenopauzálna hemorágia, prostatitída.
Poruchy dýchacej sústavy, hrudníka a mediastína: Zriedkavé - epistaxa, astma, nádcha, kongescia dutín, suchosť nosa; Zriedkavé - sucho v krku, syndróm spánkovej apnoe, namáhanie dýchania
Postmarketingové skúsenosti
Počas používania FANAPTU po schválení boli identifikované nasledujúce nežiaduce reakcie: retrográdna ejakulácia a reakcie z precitlivenosti (vrátane anafylaxie; angioedém; tesnosť hrdla; orofaryngeálny opuch; opuch tváre, pier, úst a jazyka; žihľavka; vyrážka; a svrbenie). Pretože tieto reakcie boli hlásené dobrovoľne z populácie neistej veľkosti, nie je možné spoľahlivo odhadnúť ich frekvenciu alebo stanoviť príčinnú súvislosť s expozíciou lieku.
top
Liekové interakcie
Vzhľadom na primárne účinky FANAPT na CNS je potrebné postupovať opatrne, ak sa podáva v kombinácii s inými centrálne pôsobiacimi drogami a alkoholom. Vďaka antagonizmu alfa1-adrenergných receptorov má FANAPT potenciál zvýšiť účinok určitých antihypertenzív.
Potenciál iných liekov ovplyvniť FANAPT
Iloperidón nie je substrátom pre enzýmy CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C19 alebo CYP2E1. To naznačuje, že interakcia iloperidónu s inhibítormi alebo induktormi týchto enzýmov alebo inými faktormi, ako je fajčenie, je nepravdepodobná. CYP3A4 aj CYP2D6 sú zodpovedné za metabolizmus iloperidónu. Inhibítory CYP3A4 (napr. Ketokonazol) alebo CYP2D6 (napr. Fluoxetín, paroxetín) môžu inhibovať elimináciu iloperidónu a spôsobiť zvýšené hladiny v krvi.
Ketokonazol: Súbežné podávanie ketokonazolu (200 mg dvakrát denne počas 4 dní), účinného inhibítora CYP3A4, s jednorazovou dávkou iloperidónu 3 mg až 19 mg zdraví dobrovoľníci vo veku 18 - 45 rokov zväčšili plochu pod krivkou (AUC) iloperidónu a jeho metabolitov P88 a P95 o 57%, 55% a 35%, resp. Pri podávaní s ketokonazolom alebo inými silnými inhibítormi CYP3A4 (napr. Itrakonazolom) by sa mali dávky iloperidónu znížiť asi o polovicu. Slabšie inhibítory (napr. Erytromycín, grapefruitová šťava) sa neskúmali. Ak sa inhibítor CYP3A4 stiahne z kombinovanej liečby, dávka iloperidónu sa musí vrátiť na predchádzajúcu úroveň.
Fluoxetín: Súbežné podávanie fluoxetínu (20 mg dvakrát denne počas 21 dní), účinného inhibítora CYP2D6, s jednorazovou dávkou 3 mg iloperidónu 23 zdravým dobrovoľníkom vo veku 29 - 44 rokov, ktoré boli klasifikované ako extenzívne metabolizátory CYP2D6, zvýšili AUC iloperidónu a jeho metabolitu P88 asi 2- až 3-krát a znížili AUC jeho metabolitu P95 o jedna polovica. Pri podávaní fluoxetínu by sa dávky iloperidónu mali znížiť o polovicu. Ak sa fluoxetín vysadí z kombinovanej liečby, dávka iloperidónu by sa mala vrátiť na predchádzajúcu úroveň. Očakáva sa, že ďalšie silné inhibítory CYP2D6 budú mať podobné účinky a budú vyžadovať primerané zníženie dávky. Keď sa inhibítor CYP2D6 stiahne z kombinovanej liečby, dávka iloperidónu sa môže zvýšiť na predchádzajúcu úroveň.
Paroxetín: Súbežné podávanie paroxetínu (20 mg / deň počas 5-8 dní), silného inhibítora CYP2D6, s opakovanými dávkami iloperidónu (8 alebo 12 mg dvakrát denne) u pacientov so schizofréniou vo veku 18 - 65 rokov viedlo k zvýšeniu priemerných maximálnych rovnovážnych maximálnych koncentrácií iloperidón a jeho metabolit P88 asi 1,6-krát a znížili priemerné maximálne koncentrácie v rovnovážnom stave svojho metabolitu P95 o jedna polovica. Pri podávaní s paroxetínom by sa dávky iloperidónu mali znížiť o polovicu. Ak sa paroxetín vysadí z kombinovanej liečby, dávka iloperidónu sa musí vrátiť na predchádzajúcu úroveň. Očakáva sa, že ďalšie silné inhibítory CYP2D6 budú mať podobné účinky a budú vyžadovať primerané zníženie dávky. Ak sa inhibítor CYP2D6 stiahne z kombinovanej liečby, dávka iloperidónu sa potom môže zvýšiť na predchádzajúce hladiny.
Paroxetín a ketokonazol: Súbežné podávanie paroxetínu (20 mg jedenkrát denne počas 10 dní), inhibítora CYP2D6 a ketokonazolu (200 mg) dvakrát denne) pri opakovaných dávkach iloperidónu (8 alebo 12 mg dvakrát denne) pacientom so schizofréniou vo veku 18 - 65 rokov viedlo k 1,4 násobné zvýšenie koncentrácií iloperidónu a jeho metabolitu P88 v rovnovážnom stave a 1,4-násobné zníženie koncentrácie P95 v prítomnosti paroxetín. Podávanie iloperidónu s inhibítormi obidvoch jeho metabolických dráh teda neprinieslo účinok žiadneho inhibítora podaného samostatne. Dávky Iloperidónu by sa preto mali znížiť približne o polovicu, ak sa podávajú súčasne s inhibítormi CYP2D6 a CYP3A4.
Potenciál FANAPT ovplyvniť iné drogy
Štúdie in vitro na ľudských pečeňových mikrozómoch ukázali, že iloperidón podstatne neinhibuje metabolizmus lieky metabolizované nasledujúcimi izozýmami cytochrómu P450: CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9 alebo CYP2E1. Štúdie in vitro na ľudských pečeňových mikrozómoch okrem toho preukázali, že iloperidón nemá indukciu enzýmov vlastnosti, konkrétne pre nasledujúce izozýmy cytochrómu P450: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP3A4 a CYP3A5.
Dextrometorfan: Štúdia na zdravých dobrovoľníkoch ukázala, že zmeny vo farmakokinetike dextrometorfánu (dávka 80 mg), keď dávka 3 mg Súčasné podávanie iloperidónu viedlo k 17% zvýšeniu celkovej expozície a 26% zvýšeniu maximálnych plazmatických koncentrácií Cmax dextrometorfánu. Interakcia medzi iloperidónom a inými substrátmi CYP2D6 je preto nepravdepodobná.
Fluoxetín: Jedna 3 mg dávka iloperidónu nemala žiadny vplyv na farmakokinetiku fluoxetínu (20 mg dvakrát denne).
Midazolam (citlivý substrát CYP 3A4): Štúdia u pacientov so schizofréniou ukázala menej ako 50% zvýšenie celkového midazolamu expozícia v ustálenom stave iloperidónu (14 dní po perorálnom podaní až do 10 mg iloperidónu dvakrát denne) a žiadny účinok na midazolam C max. Interakcia medzi iloperidónom a inými substrátmi CYP3A4 je preto nepravdepodobná.
Lieky, ktoré predlžujú QT interval FANAPT by sa nemali používať s inými liekmi, ktoré predlžujú QT interval.
top
Použitie v špecifických populáciách
Register tehotenstva
Existuje register tehotenskej expozície, ktorý monitoruje tehotenské výsledky u žien vystavených FANAPT počas tehotenstva. Pre viac informácií kontaktujte Národný register tehotenstva pre atypické antipsychotiká na čísle 1-866-961-2388 alebo navštívte http://womensmentalhealth.org/clinical-and -Výskum-programy / pregnancyregistry /.
Zhrnutie rizika
Novorodenci, ktorých matky sú počas tretieho trimestra gravidity vystavení antipsychotikom vrátane FANAPTu, sú po pôrode vystavení riziku extrapyramidálnych a / alebo abstinenčných príznakov. Obmedzené dostupné údaje o FANAPTe u tehotných žien nie sú dostatočné na informovanie o riziku súvisiaceho s veľkými vrodenými chybami a potratom spojenými s drogami. Iloperidón nebol teratogénny pri perorálnom podaní gravidným potkanom počas organogenézy v dávkach až do 26-násobku maximálnej odporúčanej dávky pre ľudí 24 mg / deň na základe mg / m2. Predĺžilo sa však tehotenstvo a pôrod, zvýšila sa počet narodených mŕtveho plodu, predčasné vnútromaternicové úmrtia, zvýšil sa výskyt oneskorení vývinu a znížilo prežitie mláďat po pôrode. Iloperidón nebol teratogénny pri perorálnom podaní gravidným králikom počas organogenézy v dávkach do 20-násobku s MRHD na báze mg / m2. Zvýšila sa však skorá vnútromaternicová úmrtnosť a znížila sa životaschopnosť plodu pri termíne pri najvyššej dávke, ktorá bola tiež toxickou dávkou pre matku.
Riziko pozadia veľkých vrodených chýb a potratov pre uvedenú populáciu nie je známe. Vo všeobecnej populácii v USA je odhadované riziko pozadia veľkých vrodených chýb a potratov pri klinicky uznaných tehotenstvách 2 až 4% a 15 až 20%.
Klinické úvahy
Nežiaduce účinky plodu / novorodenca
Extrapyramidálne a / alebo abstinenčné príznaky vrátane agitácie, hypertónie, hypotónie, tras, somnolencie, respiračných ťažkostí a u novorodencov, ktorých matky boli vystavené antipsychotikom počas tretieho trimestra v roku 2006, boli hlásené poruchy stravovania tehotenstvo. Tieto príznaky sa líšia v závažnosti. Niektoré novorodence sa zotavili v priebehu hodín alebo dní bez špecifického ošetrenia; iní vyžadovali dlhodobú hospitalizáciu. Monitorujte novorodencov kvôli extrapyramidálnym a / alebo abstinenčným príznakom a primerane ich zvládajte.
údaje
Údaje o zvieratách
V štúdii embryo-fetálneho vývoja dostali gravidné potkany 4, 16 alebo 64 mg / kg / deň (1,6, 6,5 a 26-násobok maximálna odporúčaná dávka u ľudí (MRHD) 24 mg / deň (mg / m2) iloperidónu perorálne počas obdobia organogenézy. Najvyššia dávka spôsobila zvýšenie skorých intrauterinných úmrtí, zníženie hmotnosti a dĺžky plodu, - znížená osifikácia plodu a zvýšený výskyt menších anomálií plodu a varianty; táto dávka tiež spôsobila zníženú spotrebu matiek a prírastok na hmotnosti.
V štúdii embryo-fetálneho vývoja boli gravidným králikom počas obdobia organogenézy podávané 4, 10 alebo 25 mg / kg / deň (3, 8 a 20-násobok MRHD na báze mg / m2). Najvyššia dávka spôsobila zvýšené skoré vnútromaternicové úmrtia a zníženú životaschopnosť plodu v termíne; táto dávka tiež spôsobila materskú toxicitu.
V ďalších štúdiách, v ktorých boli potkanom podávané iloperidón v dávkach podobných vyššie uvedeným, počínajúc od počatia alebo od 17. deň tehotenstva a pokračovanie v odstavení, zvýšené nepriaznivé reprodukčné účinky zahŕňali predĺžené tehotenstvo a pôrod miera pôrodnosti, zvýšený výskyt viscerálnych variácií plodu, znížená hmotnosť plodu a mláďat a znížená pôrodnosť po pôrode prežitie. Nezistili sa žiadne účinky lieku na neurobehaviorálny alebo reprodukčný vývoj prežívajúcich mláďat. Dávky bez účinku sa pohybovali od 4 do 12 mg / kg, s výnimkou zvýšenia pôrodnosti, ktoré sa vyskytlo pri najnižšej testovanej dávke 4 mg / kg, čo je 1,6-násobok MRHD na báze mg / m2. V týchto štúdiách sa pri vyšších dávkach pozorovala materská toxicita.
Iloperidónový metabolit P95, ktorý je hlavným cirkulujúcim metabolitom iloperidónu u ľudí, ale nie je prítomný v signifikantné množstvá u potkanov, boli podávané gravidným potkanom v období organogenézy pri perorálnych dávkach 20, 80 alebo 200 mg. kg / deň. Neboli pozorované žiadne teratogénne účinky. Pri všetkých dávkach sa vyskytla oneskorená kostná osifikácia. Nevyskytla sa žiadna významná materská toxicita. Plazmatické hladiny P95 (AUC) pri najvyššej testovanej dávke boli 2-krát vyššie ako u ľudí, ktorí dostávali MRHD iloperidónu.
laktácie
Zhrnutie rizika
Neexistujú žiadne informácie týkajúce sa prítomnosti iloperidónu alebo jeho metabolitov v ľudskom mlieku, účinky iloperidónu na dojčené dieťa ani účinky iloperidónu na ľudské mlieko výroby. Iloperidón sa nachádza v mlieku potkana. Z dôvodu možného výskytu závažných nežiaducich účinkov u dojčených detí odporučte žene, aby počas liečby FANAPTom nedojčila.
Dáta Prenos rádioaktivity do mlieka laktujúcich potkanov sa skúmal po jednej dávke [14C] iloperidónu v dávke 5 mg / kg. Koncentrácia rádioaktivity v mlieku 4 hodiny po podaní dávky bola približne 10-krát vyššia ako koncentrácia v plazme v rovnakom čase. Do 24 hodín po podaní dávky však koncentrácie rádioaktivity v mlieku klesli na hodnoty mierne nižšie ako plazma. Metabolický profil v mlieku bol kvalitatívne podobný profilu v plazme.
Použitie u detí Bezpečnosť a účinnosť u detských a dospievajúcich pacientov nebola stanovená.
Geriatrické použitie
Klinické štúdie FANAPT pri liečbe schizofrénie neobsahovali dostatočný počet pacientov vo veku 65 rokov a viac, aby určili, či reagujú inak, ako mladší dospelí pacienti. Z 3210 pacientov liečených FANAPTom v predobchodných štúdiách bolo 25 (0,5%) starších ako 65 rokov a neboli žiadni pacienti vo veku ≥75 rokov.
Starší pacienti s psychózou súvisiacou s demenciou liečení FANAPTom majú v porovnaní s placebom zvýšené riziko úmrtia. FANAPT nie je schválený na liečbu pacientov s psychózou súvisiacou s demenciou.
Porucha funkcie obličiek
Pretože FANAPT je vysoko metabolizovaný a menej ako 1% liečiva sa vylučuje v nezmenenej podobe, je nepravdepodobné, že by poškodenie obličiek samotného malo významný vplyv na farmakokinetiku FANAPT. Poškodenie obličiek (klírens kreatinínu <30 ml / min) malo minimálny účinok na Cmax iloperidónu (podaného v jednej dávke 3 mg) a jeho metabolitov P88 a P95 v ktoromkoľvek z 3 meraných katalyzátorov. AUC0– ∞ bola zvýšená o 24%, znížená o 6% a zvýšená o 52% pre iloperidón, P88 a P95, v prípade pacientov s poruchou funkcie obličiek.
Hepatálne poškodenie
U pacientov s miernym poškodením funkcie pečene nie je potrebná úprava dávky FANAPTu. U pacientov so stredne ťažkou poruchou funkcie pečene môže byť potrebné zníženie dávky. FANAPT sa neodporúča pacientom s ťažkým poškodením funkcie pečene.
U dospelých jedincov s miernym poškodením funkcie pečene sa nepozoroval žiadny významný rozdiel vo farmakokinetike iloperidónu, P88 alebo P95 (celkový alebo neviazaný) v porovnaní so zdravými dospelými kontrolami. U jedincov so stredne ťažkou poruchou funkcie pečene bola vyššia (2-násobná) a variabilnejšia voľná expozícia aktívnym metabolitom P88 pozorované v porovnaní so zdravými kontrolami, zatiaľ čo expozícia iloperidónu a P95 bola vo všeobecnosti podobná (menej ako 50% zmena v porovnaní s kontrola). Keďže sa štúdia u pacientov s ťažkým poškodením funkcie pečene neuskutočnila, FANAPT sa neodporúča u pacientov s ťažkým poškodením funkcie pečene.
Fajčenie
Na základe štúdií in vitro využívajúcich ľudské pečeňové enzýmy, FANAPT nie je substrátom pre CYP1A2; fajčenie by preto nemalo mať vplyv na farmakokinetiku FANAPT-u.
tehotenstvo
top
Zneužívanie drog a závislosť
Kontrolovaná látka
FANAPT nie je kontrolovaná látka.
zneužívanie
FANAPT sa u zvierat alebo ľudí systematicky neskúmal z hľadiska jeho možného zneužitia, tolerancie alebo fyzickej závislosti. Aj keď klinické skúšky neodhalili žiadnu tendenciu k správaniu pri hľadaní liekov, tieto pozorovania neboli systematické a nie je možné na základe tejto skúsenosti predpovedať rozsah, v akom bude liek s účinnou látkou CNS, FANAPT, zneužitý, odklonený a / alebo zneužitý raz Na trhu. V dôsledku toho by mali byť pacienti starostlivo vyšetrení na anamnézu zneužívania drog a títo pacienti by mali byť pozorne sledujte známky zneužitia alebo zneužívania FANAPT (napr. vývoj tolerancie, zvýšenie dávky, hľadanie liekov) Správanie).
top
predávkovania
Ľudské skúsenosti
V pred-marketingových štúdiách zahŕňajúcich viac ako 3210 pacientov došlo k náhodnému alebo úmyselnému predávkovaniu FANAPTom dokumentovaný u 8 pacientov v rozmedzí od 48 mg do 576 mg užívaných naraz a 292 mg užívaných počas 3 dní obdobie. Z týchto prípadov neboli hlásené žiadne úmrtia. Najväčší potvrdený jednorazový príjem FANAPT bol 576 mg; u tohto pacienta neboli zaznamenané žiadne nepriaznivé fyzikálne účinky. Ďalšie najväčšie potvrdené prehltnutie FANAPT bolo 438 mg počas 4 dní; U tohto pacienta boli hlásené extrapyramídové symptómy a interval QTc 507 msec bez srdcových následkov. Tento pacient pokračoval v liečbe FANAPTom ďalších 11 mesiacov.
Vo všeobecnosti boli hlásené príznaky a symptómy, ktoré sú výsledkom preháňania známych farmakologických účinkov (napr. Ospalosť a sedácia, tachykardia a hypotenzia) FANAPTu.
Liečba predávkovania
Neexistuje žiadne špecifické antidotum pre FANAPT. Preto by sa mali zaviesť vhodné podporné opatrenia. V prípade akútneho predávkovania by mal lekár vytvoriť a udržiavať dýchacie cesty a zabezpečiť primeranú okysličenie a ventiláciu. Malo by sa zvážiť výplach žalúdka (po intubácii, ak je pacient v bezvedomí) a podávanie aktívneho uhlia spolu s preháňadlo. Možnosť tienenia, záchvatov alebo dystonických reakcií hlavy a krku po predávkovaní môže viesť k riziku aspirácie pri vyvolanom vracaní. Kardiovaskulárne monitorovanie by sa malo začať okamžite a malo by zahŕňať nepretržité monitorovanie EKG, aby sa zistili možné arytmie. Ak sa podáva antiarytmická terapia, disopyramid, prokaínamid a chinidín by sa nemali používať, pretože majú potenciál na predĺženie QT intervalu, ktorý by mohol byť aditívny k účinkom FANAPTu. Podobne je rozumné očakávať, že alfa-blokujúce vlastnosti bretylia môžu byť aditívne k vlastnostiam FANAPT, čo vedie k problematickej hypotenzii. Hypotenzia a obehový kolaps sa majú liečiť vhodnými opatreniami, ako sú intravenózne tekutiny alebo sympatomimetiká (adrenalín a dopamín sa nemajú používať, pretože beta stimulácia môže zhoršiť hypotenziu v nastavení alfa indukovaného FANAPTom blokáda). V prípade závažných extrapyramidálnych symptómov sa má podať anticholinergikum. Dôsledný lekársky dohľad by mal pokračovať až do zotavenia pacienta.
top
popis
FANAPT je atypické antipsychotikum patriace do chemickej triedy derivátov piperidinylbenzizoxazolu. Jeho chemický názov je 4 '- [3- [4- (6-fluór-1,2-benzizoxazol-3-yl) piperidino] propoxy] -3'-metoxyacetofenón. Jeho molekulový vzorec je C24H27FN204 a jeho molekulová hmotnosť je 426,48. Štrukturálny vzorec je:

Iloperidón je biely až takmer biely jemne kryštalický prášok. Je prakticky nerozpustný vo vode, veľmi slabo rozpustný v 0,1 N HCl a voľne rozpustný v chloroforme, etanole, metanole a acetonitrile.
Tablety FANAPT sú určené iba na perorálne podanie. Každé koleso, nepotiahnuté
tableta obsahuje 1 mg, 2 mg, 4 mg, 6 mg, 8 mg, 10 mg alebo 12 mg iloperidónu. Neaktívne zložky sú: monohydrát laktózy, mikrokryštalická celulóza, hydroxypropylmetylcelulóza, krospovidón, stearát horečnatý, koloidný kremík
oxid a čistená voda (odstránená počas spracovania). Tablety sú biele, okrúhle, ploché, so skosenými hranami a označené logom „“ na jednej strane a s označením sily „1“, „2“, „4“, „6“, „8“, „10“, alebo „12“ na druhej strane.
top
Klinická farmakológia
Mechanizmus akcie
Mechanizmus účinku iloperidónu pri schizofrénii nie je známy. Účinnosť iloperidónu by sa však mohla sprostredkovať kombináciou antagonizmu dopamínu typu 2 (D2) a serotonínu typu 2 (5-HT2).
Iloperidón tvorí aktívny metabolit, P88, ktorý má in vitro väzbový profil na receptor podobný rodičovskému liečivu.
farmakodynamika
Iloperidón pôsobí ako antagonista s vysokou (nM) afinitnou väzbou na serotonín 5-HT2A dopamín D2 a Receptory D3 a receptory norepinefrínu NEal (hodnoty Ki 5,6, 6,3, 7,1 a 0,36 nM, v tomto poradí). Iloperidón má strednú afinitu k dopamínovým D4 a serotonínovým 5-HT6 a 5-HT7 receptorom (hodnoty Ki 25, 43 a 22, nM a) nízka afinita k serotonínovým 5-HT1A, dopamínovým D1 a histamínovým H1 receptorom (hodnoty Ki 168, 216 a 437 nM, v tomto poradí). Iloperidón nemá výraznú afinitu (Ki> 1000 nM) pre cholinergné muskarínové receptory. Afinita iloperidónového metabolitu P88 je všeobecne rovnaká alebo nižšia ako afinita pôvodnej zlúčeniny, zatiaľ čo metabolit P95 je iba vykazuje afinitu k 5-HT2A (hodnota Ki 3,91) a receptorom NEal, NEalB, NEalD a NEa2C (hodnoty Ki 4,7, 2,7, 8,8 a 4,7 nM) v tomto poradí).
farmakokinetika
Pozorovaný priemerný eliminačný polčas iloperidónu, P88 a P95 v extenzívnych metabolizátoroch CYP2D6 (EM) sú 18, 26 a 23 hodín, v prípade slabých metabolizérov (PM) 33, 37 a 31 hodín. Koncentrácie v rovnovážnom stave sa dosahujú do 3 až 4 dní po podaní dávky. Hromadenie iloperidónu je predvídateľné z farmakokinetiky jednej dávky. Farmakokinetika iloperidónu je viac ako úmerná dávke. Eliminácia iloperidónu je hlavne prostredníctvom pečeňového metabolizmu zahŕňajúceho 2 P450 izozýmy, CYP2D6 a CYP3A4.
Absorpcia: Iloperidón sa po podaní tablety dobre absorbuje, pričom maximálne plazmatické koncentrácie sa vyskytujú do 2 až 4 hodín; zatiaľ čo relatívna biologická dostupnosť tabletovej formulácie v porovnaní s perorálnym roztokom je 96%. Podávanie iloperidónu so štandardným jedlom s vysokým obsahom tukov nemalo významný vplyv na Cmax ani AUC iloperidónu, P88 alebo P95, ale oneskorené Tmax o 1 hodinu pre iloperidón, 2 hodiny pre P88 a 6 hodín pre P95. FANAPT sa môže podávať bez ohľadu na jedlo.
Distribúcia: Iloperidón má zdanlivý klírens (klírens / biologická dostupnosť) 47 až 102 l / h, so zjavným distribučným objemom 1340 - 2800 L. Pri terapeutických koncentráciách je neviazaná frakcia iloperidónu v plazme ~ 3% a každého metabolitu (P88 a P95) je ~ 8%.
Metabolizmus a eliminácia: Iloperidón sa metabolizuje predovšetkým tromi biotransformačnými cestami: redukciou karbonylu, hydroxyláciou (sprostredkovanou CYP2D6) a O-demetyláciou (sprostredkovanou CYP3A4). Existujú 2 prevažujúce metabolity iloperidónu, P95 a P88. Metabolit iloperidónu P95 predstavuje 47,9% AUC iloperidónu a jeho metabolitov v plazme v rovnovážnom stave pre extenzívne metabolizátory (EM) a 25% pre slabé metabolizátory (PM). Aktívny metabolit P88 predstavuje 19,5% a 34,0% celkovej plazmatickej expozície v EM a PM.
Približne 7% - 10% belochov a 3% - 8% čiernych / afrických Američanov nemá schopnosť metabolizovať CYP2D6. substráty a sú klasifikované ako zlé metabolizátory (PM), zatiaľ čo zvyšok je stredný, rozsiahly alebo ultrarapidový metabolizátori. Súčasné podávanie FANAPT so známymi silnými inhibítormi CYP2D6, ako je fluoxetín, vedie k 2,3-násobnému zvýšeniu zvýšenie plazmatickej expozície iloperidónu, a preto by mala byť polovica dávky FANAPTu podávaný.
Podobne aj PM CYP2D6 majú vyššiu expozíciu iloperidónu v porovnaní s EM a PM by sa mali znížiť o polovicu. K dispozícii sú laboratórne testy na identifikáciu PM CYP2D6.
Prevažná časť rádioaktívnych materiálov sa izolovala v moči (priemer 58,2%, respektíve 45,1% v EM a PM), pričom výkaly tvorili 19,9% (EM) až 22,1% (PM) z dávkovanej rádioaktivity.
Transakčné interakcie: Iloperidón a P88 nie sú substrátmi P-gp a iloperidón je slabým inhibítorom P-gp.
top
Neklinická toxikológia
Karcinogenéza, mutagenéza, poškodenie plodnosti
Karcinogenéza: Štúdie celoživotnej karcinogenity sa uskutočnili na myšiach CD-1 a potkanoch Sprague Dawley. Iloperidón sa podával perorálne v dávkach 2,5, 5,0 a 10 mg / kg / deň myšiam CD-1 a 4, 8 a 16 mg / kg / deň do Potkany Sprague Dawley (0,5, 1,0 a 2,0 a 1,6, 3,2 a 6,5-krát, MRHD 24 mg / deň na mg / m2 základ). U samíc myší liečených iba najnižšou dávkou (2,5 mg / kg / deň) bol zvýšený výskyt zhubných nádorov prsnej žľazy. U potkanov nedošlo k žiadnemu zvýšeniu neoplazie.
Karcinogénny potenciál metabolitu iloperidónu P95, ktorý je hlavným cirkulujúcim metabolitom iloperidónu u ľudí, ale nie je prítomný vo významných množstvách u myší alebo potkanov, bola hodnotená v celoživotnej štúdii karcinogenity u potkanov Wistar pri perorálnych dávkach 25, 75 a 200 mg / kg / deň u samcov a 50, 150 a 250 (znížených zo 400) mg / kg / deň u samice. K neoplastickým zmenám súvisiacim s liekom došlo u mužov, hypofýzy (pars distalis adenoma) vo všetkých dávkach a pankreasu (adenóm ostrovčekových buniek) pri vysokej dávke. Plazmatické hladiny P95 (AUC) u mužov pri testovaných dávkach (25, 75 a 200 mg / kg / deň) boli približne 0,4, 3, respektíve 23-krát, expozícia človeka P95 pri MRHD iloperidónu.
Mutagenéza: Iloperidón bol negatívny v Amesovom teste a in vivo v mikronukleových testoch na kostnej dreni myší a potkanov. Iloperidón indukoval chromozomálne aberácie v bunkách vaječníkov čínskeho škrečka (CHO) in vitro v koncentráciách, ktoré tiež spôsobovali určitú cytotoxicitu.
Metabolit iloperidónu P95 bol negatívny v Amesovom teste, teste chromozómových aberácií V79 a in vivo mikronukleárnom teste kostnej drene myší.
Zhoršenie plodnosti: Iloperidón znížil fertilitu pri 12 a 36 mg / kg v štúdii, v ktorej sa liečili samce aj samice potkanov. Dávka bez účinku bola 4 mg / kg, čo je 1,6-násobok MRHD 24 mg / deň na základe mg / m2.
top
Klinické štúdie
Účinnosť FANAPT pri liečbe schizofrénie bola podporená dvoma placebmi a aktívne kontrolované krátkodobé (4- a 6-týždňové) štúdie a jedna dlhodobá randomizovaná placebom kontrolovaná štúdia výberové konanie. Všetky štúdie zahŕňali pacientov, ktorí splnili kritériá DSM-III / IV pre schizofréniu.
V týchto štúdiách sa na hodnotenie psychiatrických príznakov a symptómov použili tri nástroje. Stupnica pozitívneho a negatívneho syndrómu (PANSS) a Krátka stupnica psychiatrického hodnotenia (BPRS) sú inventármi viacerých položiek.
všeobecnej psychopatológie obvykle používanej na hodnotenie účinkov liekovej liečby pri schizofrénii. Hodnotenie klinického globálneho dojmu (CGI) odráža dojem skúseného pozorovateľa, ktorý je plne oboznámený s prejavmi schizofrénie, o celkovom klinickom stave pacienta.
6-týždňová, placebom kontrolovaná štúdia (n = 706) zahŕňala 2 flexibilné rozsahy dávok FANAPT (12-16 mg / deň alebo 20-24 mg / deň) v porovnaní s placebom a aktívnou kontrolou (risperidón). V skupine 12-16 mg / deň bol titračný plán FANAPT 1 mg dvakrát denne v dňoch 1 a 2, 2 mg dvakrát denne v dňoch 3 a 4, 4 mg dvakrát denne v dňoch 5 a 6 a 6 mg dvakrát denne v deň 7. V skupine 20 - 24 mg / deň bol titračný rozvrh FANAPT 1 mg dvakrát denne v deň 1, 2 mg dvakrát denne v deň 2, 4 mg dvakrát denne v deň 3, 6 mg dvakrát denne v dňoch 4 a 5, 8 mg dvakrát denne v deň 6 a 10 mg dvakrát denne v deň 7. Primárnym koncovým ukazovateľom bola zmena oproti východiskovej hodnote celkového skóre BPRS na konci liečby (deň 42). Rozsahy dávok 12-16 mg / deň aj 20-24 mg / deň FANAPT boli lepšie ako placebo v celkovom skóre BPRS. Aktívne kontrolné antipsychotické liečivo sa v tejto štúdii počas prvých 2 javilo lepšie ako FANAPT týždne, zistenie, ktoré môže byť čiastočne vysvetlené rýchlejšou titráciou, ktorá bola za to možná liek. U pacientov v tejto štúdii, ktorí zostali na liečbe najmenej 2 týždne, sa zdá, že iloperidón má porovnateľnú účinnosť ako aktívna kontrola.
4-týždňová, placebom kontrolovaná štúdia (n = 604) zahŕňala jednu pevnú dávku FANAPT (24 mg / deň) v porovnaní s placebom a aktívnu kontrolu (ziprasidón). Harmonogram titrácie pre túto štúdiu bol podobný ako pre 6-týždňovú štúdiu. Táto štúdia zahŕňala titráciu FANAPT od 1 mg dvakrát denne v deň 1 a zvyšovanie na 2, 4, 6, 8, 10 a 12 mg dvakrát denne v dňoch 2, 3, 4, 5, 6 a 7. Primárnym koncovým ukazovateľom bola zmena oproti východiskovej hodnote celkového skóre PANSS na konci liečby (deň 28). Dávka FANAPT 24 mg / deň bola lepšia ako placebo v celkovom skóre PANSS. Zdá sa, že FANAPT má podobnú účinnosť ako aktívna kontrolná látka, ktorá tiež vyžaduje pomalú titráciu ako cieľová dávka.
V dlhodobejšej skúške klinicky stabilné dospelé ambulancie (n = 303) spĺňajúce kritériá DSM-IV pre schizofréniu, ktoré zostali stabilné aj po 12 týždňoch otvorená liečba flexibilnými dávkami FANAPT (8 mg / deň - 24 mg / deň podávanými ako dávky dvakrát denne) bola randomizovaná na placebo alebo pokračovala v liečbe ich súčasná dávka FANAPT (8 mg / deň - 24 mg / deň podávaná ako dávky dvakrát denne) na sledovanie možného relapsu počas dvojito zaslepeného relapsu fáza prevencie. Stabilizácia počas otvorenej fázy bola definovaná ako zistená dávka FANAPT-u, ktorá sa nezmenila v dôsledku účinnosti počas 4 týždňov pred randomizáciou, ktoré majú skóre CGI-závažnosti ≤ 4 a celkové skóre PANSS ≤ 70, skóre ≤ 4 pre každú z nasledujúcich jednotlivých položiek PANSS (bludy, P2-konceptuálna dezorganizácia, P3-halucinatívne správanie, podozrenie na perzekúciu / perzekúciu, nepriateľstvo P7 alebo nespolupráce G8) a žiadna hospitalizácia alebo zvýšenie úrovne starostlivosti pri liečbe exacerbácie. Relaps alebo blížiaci sa relaps počas fázy prevencie proti dvojitému slepému pokusu bol definovaný ako ktorýkoľvek z uvedených prípadov nasledujúci: hospitalizácia z dôvodu zhoršenia schizofrénie, zvýšenie (zhoršenie) celkového skóre PANSS ≥ 30%, CGI-
Skóre zlepšenia ≥6, pacient mal samovražedné, vražedné alebo agresívne správanie alebo potrebuje akékoľvek iné antipsychotické lieky.

Na základe predbežnej analýzy nezávislý výbor pre monitorovanie údajov rozhodol, že štúdia by sa mala čo najskôr ukončiť z dôvodu dôkazu o účinnosti. Na základe výsledkov priebežnej analýzy, ktoré boli potvrdené súborom konečných analýz, boli pacienti liečení FANAPT zaznamenal štatisticky významný dlhší čas na relapsu alebo na blížiaci sa relaps ako pacienti, ktorí dostali placebo. Obrázok 1 zobrazuje odhadovaný kumulatívny podiel pacientov s relapsom alebo blížiacim sa relapsom na základe konečného súboru údajov.
top
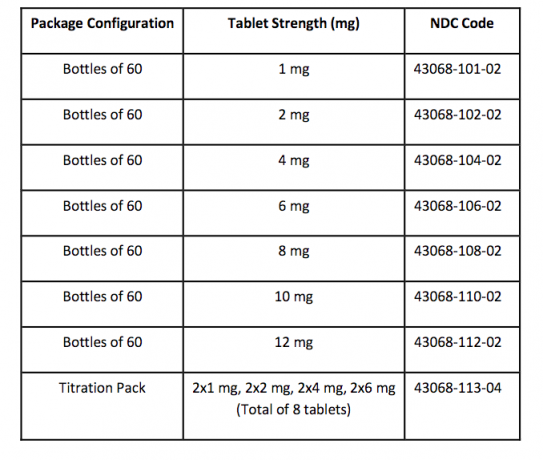
Ako dodávané / skladovacie a manipulačné
Tablety FANAPT sú biele, okrúhle a s vyrazeným logom vyrazeným na jednej strane a silou tablety „1“, „2“, „4“, „6“, „8“, „10“ alebo „12“ na druhej strane. side. Tablety sa dodávajú v nasledujúcich silných a pevných konfiguráciách:
skladovanie
Tablety FANAPT skladujte pri izbovej teplote 25 ° C (77 ° F); odchýlky povolené na 15 ° až 30 ° C (pozri teplotu regulovanú USP). Tablety FANAPT chráňte pred svetlom a vlhkosťou.
INFORMÁCIE O PORADENÍ PACIENTA
Lekárom sa odporúča, aby s pacientmi, pre ktorých predpisujú FANAPT, prediskutovali tieto problémy:
Predĺženie intervalu QT
Pacienti by mali byť poučení, aby sa okamžite poradili so svojím lekárom, ak sa cítia mdloby, stratia vedomia alebo majú búšenie srdca. Pacientov treba poučiť, aby neužívali FANAPT s inými liekmi, ktoré spôsobujú predĺženie QT intervalu. Pacientov treba informovať, aby lekárov informovali o tom, že užívajú FANAPT skôr, ako začnú užívať akýkoľvek nový liek.
Neuroleptický malígny syndróm
Pacienti a opatrovatelia by mali byť poučení, že niekedy môže byť uvedený potenciálne fatálny symptómový komplex ako NMS bola hlásená v súvislosti s podávaním antipsychotík vrátane FANAPT. Medzi príznaky a príznaky NMS patrí hyperpyrexia, stuhnutosť svalov, zmenený duševný stav a dôkaz autonómie
nestabilita (nepravidelný pulz alebo krvný tlak, tachykardia, diaforéza a srdcová arytmia).
Metabolické zmeny
Pacienti by si mali byť vedomí príznakov hyperglykémie (vysoká hladina cukru v krvi) a diabetes mellitus. Pacienti s diagnózou diabetu, pacienti s rizikovými faktormi diabetu alebo tí, ktorí ich vyvinú Príznaky počas liečby by mali byť monitorované na začiatku a pravidelne počas nich liečbu. Pacientov treba upozorniť, že počas liečby FANAPTom došlo k nárastu hmotnosti. Odporúča sa klinické sledovanie hmotnosti.
Ortostatická hypotéza
Pacienti majú byť poučení o riziku ortostatickej hypotenzie, najmä v čase začatia liečby, opätovného začatia liečby alebo zvýšenia dávky.
Rušenie kognitívnych a motorických výkonov
Pretože FANAPT môže mať potenciál narušiť úsudok, myslenie alebo motorické zručnosti, pacienti by mali byť opatrní obsluha nebezpečných strojov vrátane automobilov, pokiaľ si nie sú celkom istí, že terapia FANAPT ich neovplyvňuje nepriaznivo.
tehotenstvo
Upozornite pacientov, že použitie Fanaptu v treťom trimestri môže u novorodenca spôsobiť extrapyramidálne a / alebo abstinenčné príznaky. Odporúčajte pacientom, aby informovali svojho poskytovateľa zdravotnej starostlivosti o známom alebo podozrivom tehotenstve.
Register tehotenstva
Upozornite pacientov, že existuje register tehotenstva, ktorý monitoruje tehotenské výsledky u žien vystavených FANAPT počas tehotenstva
laktácie
Počas liečby FANAPTOM odporučte ženám, aby nedojčili.
Sprievodné lieky
Pacientom by sa malo odporučiť, aby informovali svojich lekárov, ak užívajú alebo plánujú užívať akékoľvek lieky na predpis alebo nadmerné množstvá, pretože existuje potenciál pre interakcie.
alkohol
Pacientov treba upozorniť, aby sa počas užívania FANAPTu vyhýbali alkoholu.
Vystavenie teplu a dehydratácia
Pacientov treba poučiť o náležitej starostlivosti, aby sa predišlo prehriatiu a dehydratácii.
Distribuovaný:
Vanda Pharmaceuticals Inc.
Washington, D.C. 20037 USA
Vanda a Fanapt® sú registrované ochranné známky spoločnosti Vanda Pharmaceuticals Inc. v USA a ďalších krajinách.
späť na začiatok
Sprievodca predpisovaním Fanapt (Iloperidón) (PDF)
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
Posledná aktualizácia 07/13
späť k: Farmakológia psychiatrických liekov Domovská stránka


