Glukofág na liečbu cukrovky
Názov značky: Glucophage
Všeobecný názov: metformin hydrochloride
Dávková forma: tablety s predĺženým uvoľňovaním
obsah:
popis
Klinická farmakológia
Indikácie a použitie
kontraindikácie
varovanie
Opatrenia
Liekové interakcie
Nežiaduce reakcie
predávkovať
dávkovanie
dodané
Glucohage, metformin hydrochloride, informácie o pacientovi (v jednoduchej angličtine)
popis
Tablety Glucophage® (metformin hydrochloride) a Glucophage® XR (metformin hydrochloride) Tablety s predĺženým uvoľňovaním sú perorálne antihyperglykemické lieky používané pri liečbe cukrovky 2. typu. Hydrochlorid metformínu (hydrochlorid N, N-dimetylimidodikarbonimidového diamidu) nie je chemicky ani farmakologicky príbuzný so žiadnou inou triedou perorálnych antihyperglykemických látok. Štrukturálny vzorec je uvedený:
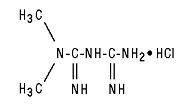
Hydrochlorid metformínu je biela až takmer biela kryštalická zlúčenina s molekulovým vzorcom C4H11N5-HCI a molekulovou hmotnosťou 165,63. Hydrochlorid metformínu je voľne rozpustný vo vode a je prakticky nerozpustný v acetóne, éteri a chloroforme. PKa metformínu je 12,4. PH 1% vodného roztoku metformíniumchloridu je 6,68.
Glukofágové tablety obsahujú 500 mg, 850 mg alebo 1 000 mg metformíniumchloridu. Každá tableta obsahuje neaktívne zložky povidón a stearát horečnatý. Okrem toho povlak pre 500 mg a 850 mg tablety obsahuje hypromelózu a povlak pre 1000 mg tabletu obsahuje hypromelózu a polyetylénglykol.
Glucophage XR obsahuje 500 mg alebo 750 mg hydrochloridu metformínu ako aktívnu zložku.
Glucophage XR 500 mg tablety obsahujú neaktívne zložky sodnej soli karboxymetylcelulózy, hypromelózy, mikrokryštalickej celulózy a stearátu horečnatého.
Tablety Glucophage XR 750 mg obsahujú neaktívne zložky sodnej soli karboxymetylcelulózy, hypromelózy a stearátu horečnatého.
Súčasti systému a Performance-Glucophage XR obsahuje duálny hydrofilný polymérny matricový systém. Hydrochlorid metformínu sa kombinuje s polymérom riadiacim uvoľňovanie liečiva za vzniku „vnútornej“ fázy, ktorá sa potom zabuduje ako diskrétne častice do „vonkajšej“ fázy druhého polyméru. Po podaní tekutina z gastrointestinálneho traktu (GI) vstupuje do tablety, čo spôsobuje, že polyméry hydratujú a napučiavajú. Liečivo sa uvoľňuje pomaly z liekovej formy difúziou cez gélovú matricu, ktorá je v podstate nezávislá od pH. Hydratovaný polymérny systém nie je rigidný a očakáva sa, že sa rozpadne normálnou peristaltikou v gastrointestinálnom trakte. Biologicky inertné zložky tablety môžu občas zostať počas tranzitu GI neporušené a budú vylúčené vo výkaloch ako mäkká hydratovaná hmota.
top
Klinická farmakológia
Mechanizmus akcie
Metformín je antihyperglykemické činidlo, ktoré zlepšuje glukózovú toleranciu u pacientov s diabetom 2. typu a znižuje tak bazálnu, ako aj postprandiálnu plazmatickú glukózu. Jeho farmakologické mechanizmy pôsobenia sa líšia od iných tried orálnych antihyperglykemických látok. Metformín znižuje produkciu glukózy v pečeni, znižuje absorpciu glukózy v čreve a zvyšuje citlivosť na inzulín zvýšením absorpcie a využitia periférnej glukózy. Na rozdiel od sulfonylmočovín metformín nevyvoláva hypoglykémiu ani u pacientov s cukrovkou 2. typu, ani u normálnych jedincov (s výnimkou osobitných okolností, pozri OPATRENIA) a nespôsobuje hyperinzulinémiu. Pri liečbe metformínom zostáva sekrécia inzulínu nezmenená, zatiaľ čo hladiny inzulínu nalačno nalačno a denná plazmová inzulínová odpoveď sa môžu skutočne znížiť.
farmakokinetika
Absorpcia a biologická dostupnosť
Absolútna biologická dostupnosť 500 mg tablety Glucophage podanej nalačno je približne 50% až 60%. Štúdie s použitím jednotlivých perorálnych dávok Glucophage 500 až 1500 mg a 850 až 2550 mg naznačujú, že je nedostatok proporcionalita dávky so zvyšujúcimi sa dávkami, ktorá je spôsobená skôr zníženou absorpciou ako zmenou v eliminácie. Jedlo znižuje rozsah a mierne oneskoruje absorpciu metformínu, ako ukazuje približne o 40% nižšia priemerná maximálna plazma koncentrácia (Cmax), o 25% nižšia plocha pod krivkou závislosti plazmatickej koncentrácie od času (AUC) a predĺženie času na vrchol o 35 minút plazmatická koncentrácia (Tmax) po podaní jednej 850 mg tablety metformínu s jedlom v porovnaní s rovnakou silou tablety podávaný pôst. Klinický význam týchto poklesov nie je známy.
Po jednorazovej perorálnej dávke Glucophage XR sa Cmax dosiahne so strednou hodnotou 7 hodín a rozsahom 4 až 8 hodín. Maximálne plazmatické hladiny sú približne o 20% nižšie v porovnaní s rovnakou dávkou Glucophage, rozsah absorpcie (meraný pomocou AUC) je však podobný ako u Glucophage.
V rovnovážnom stave sú AUC a Cmax pre Glucophage XR v rozsahu 500 až 2000 mg podávané jedenkrát denne menej ako úmerné dávke. Maximálne plazmatické hladiny sú približne 0,6, 1,1, 1,4 a 1,8 µg / ml pre dávky 500, 1000, 1500 a 2000 mg raz denne. Rozsah absorpcie metformínu (merané pomocou AUC) z Glucophage XR v dávke 2000 mg jedenkrát denne je podobný tej istej celkovej dennej dávke podanej ako tablety Glucophage 1000 mg dvakrát denne. Po opakovanom podaní Glucophage XR sa metformín v plazme nehromadil.
Variabilita Cmax a AUC metformínu z Glucophage XR v rámci jedinca je porovnateľná s variabilitou u Glucophage.
Aj keď miera absorpcie metformínu (meraná pomocou AUC) z tablety Glucophage XR zvýšená približne o 50%, keď sa podáva s jedlom, nemal žiadny vplyv na Cmax a Tmax metformín. Jedlá s vysokým aj nízkym obsahom tuku mali rovnaký účinok na farmakokinetiku Glucophage XR.
distribúcia
Zdanlivý distribučný objem (V / F) metformínu po jednorazovej perorálnej dávke 850 mg glukofágu bol v priemere 654 ± 358 l. Metformín sa zanedbateľne viaže na plazmatické proteíny, na rozdiel od sulfonylmočovín, ktoré sa viažu na viac ako 90% proteínov. Metformín sa delí na erytrocyty, pravdepodobne ako funkcia času. Pri obvyklých klinických dávkach a dávkovacích schémach glukofágu sa plazmatická koncentrácia metformínu v rovnovážnom stave dosiahne v priebehu 24 až 48 hodín a zvyčajne sa
Metabolizmus a eliminácia
Intravenózne štúdie s jednou dávkou u normálnych jedincov ukazujú, že metformín sa vylučuje v nezmenenej forme moč a nepodlieha metabolizmu v pečeni (u ľudí sa nezistili žiadne metabolity) ani biliárne vylučovanie. Renálny klírens (pozri stôl 1) je približne 3,5krát vyššia ako klírens kreatinínu, čo naznačuje, že tubulárna sekrécia je hlavnou cestou eliminácie metformínu. Po perorálnom podaní je približne 90% absorbovaného liečiva eliminovaných obličkovou cestou počas prvých 24 hodín, s plazmatickým eliminačným polčasom približne 6,2 hodín. V krvi je eliminačný polčas približne 17,6 hodín, čo naznačuje, že masa erytrocytov môže byť distribučným priestorom.
Osobitné skupiny obyvateľstva
Pacienti s cukrovkou 2. typu
V prítomnosti normálnej funkcie obličiek nie sú rozdiely medzi farmakokinetikou metformínu v jednej alebo viacerých dávkach medzi pacientmi s cukrovkou 2. typu a normálnymi jedincami (pozri časť stôl 1), ani v jednej skupine pri obvyklých klinických dávkach nedochádza k akumulácii metformínu.
Farmakokinetika Glucophage XR u pacientov s diabetom 2. typu je porovnateľná s farmakokinetikou zdravých normálnych dospelých.
Renálna nedostatočnosť
U pacientov so zníženou funkciou obličiek (na základe zmeraného klírensu kreatinínu) je plazmatický polčas a polčas krvi metformín je predĺžený a renálny klírens je znížený úmerne so znížením klírensu kreatinínu (pozri stôl 1; pozri tiež UPOZORNENIE).
Hepatálna nedostatočnosť
U pacientov s hepatálnou insuficienciou sa nevykonali žiadne farmakokinetické štúdie s metformínom.
geriatria
Obmedzené údaje z kontrolovaných farmakokinetických štúdií o glukofágu u zdravých starších jedincov naznačujú, že celková plazma klírens metformínu je znížený, polčas je predĺžený a Cmax je zvýšená v porovnaní so zdravými mladými predmety. Z týchto údajov vyplýva, že zmena farmakokinetiky metformínu so starnutím je primárne spôsobená zmenou funkcie obličiek (pozri pozri časť 4.4). stôl 1). Tablety Glucophage (metformin hydrochloride) a Glucophage XR (metformin hydrochloride) Liečba tabletami s predĺženým uvoľňovaním by sa nemala sa má začať u pacientov vo veku 80 rokov, pokiaľ meranie klírensu kreatinínu nepreukáže, že funkcia obličiek nie je znížená (pozri UPOZORNENIE a DÁVKOVANIE A PODÁVANIE).
Tabuľka 1: Vyberte priemerné (± S.D.) Farmakokinetické parametre metformínu po jednej alebo viacerých perorálnych dávkach glukofágu
| Skupiny pacientov: Dávka glukofágu (počet predmetov) |
Cmaxb (µg / ml) |
TmaxC (H) |
Renálna vôľa (Ml / min) |
|---|---|---|---|
| Všetky dávky podané nalačno, okrem prvých 18 dávok štúdií s opakovanými dávkami | |||
| b Maximálna plazmatická koncentrácia | |||
| C Čas na dosiahnutie maximálnej plazmatickej koncentrácie | |||
| d Kombinované výsledky (priemerný priemer) z piatich štúdií: priemerný vek 32 rokov (rozsah 23-59 rokov) | |||
| e Kinetická štúdia uskutočnená po podaní dávky 19 nalačno | |||
| F Staršie osoby, priemerný vek 71 rokov (rozmedzie 65 - 81 rokov) | |||
| g CLcr = klírens kreatinínu normalizovaný na povrch tela 1,73 m2 | |||
| Zdraví, nediabetickí dospelí: | |||
| 500 mg jednotlivá dávka (24) | 1.03 ( ±0.33) | 2.75 ( ±0.81) | 600 ( ±132) |
| 850 mg jednotlivá dávka (74)d | 1.60 ( ±0.38) | 2.64 ( ±0.82) | 552 ( ±139) |
| 850 mg trikrát denne pre 19 dávoke (9) | 2.01 ( ±0.42) | 1.79 ( ±0.94) | 642 ( ±173) |
| Dospelí s diabetom 2. typu: | |||
| 850 mg jednotlivá dávka (23) | 1.48 ( ±0.5) | 3.32 ( ±1.08) | 491 ( ±138) |
| 850 mg trikrát denne pre 19 dávoke (9) | 1.90 ( ±0.62) | 2.01 ( ±1.22) | 550 ( ±160) |
| staršief, zdraví nediabetickí dospelí: | |||
| 850 mg jednotlivá dávka (12) | 2.45 ( ±0.70) | 2.71 ( ±1.05) | 412 ( ±98) |
| Dospelí s poruchou funkcie obličiek: | |||
| 850 mg jednotlivá dávka | |||
| Mierne (CLcrg 61 - 90 ml / min) (5) | 1.86 ( ±0.52) | 3.20 ( ±0.45) | 384 ( ±122) |
| Mierne (CLcr 31 - 60 ml / min) (4) | 4.12 ( ±1.83) | 3.75 ( ±0.50) | 108 ( ±57) |
| Vážne (CLcr 10-30 ml / min) (6) | 3.93 ( ±0.92) | 4.01 ( ±1.10) | 130 ( ±90 |
pediatrie
Po podaní jednej perorálnej tablety Glucophage 500 mg s jedlom sa geometrická priemerná Cmax a AUC metformínu líšila o menej ako 5% medzi pediatrickí pacienti s diabetom 2. typu (vo veku 12-16 rokov) a zdraví dospelí a dospelí (20-45 rokov) zodpovedajúci pohlaviu a hmotnosti, všetci s normálnou obličkou funkcie
rod
Farmakokinetické parametre metformínu sa významne nelíšili medzi normálnymi jedincami a pacientmi s diabetom 2. typu, keď sa analyzovali podľa pohlavia (muži = 19, ženy = 16). Podobne v kontrolovaných klinických štúdiách u pacientov s cukrovkou 2. typu bol antihyperglykemický účinok glukofágu porovnateľný u mužov a žien.
závod
Neuskutočnili sa žiadne štúdie farmakokinetických parametrov metformínu podľa rasy. V kontrolovaných klinických štúdiách s glukofágom u pacientov s diabetom 2. typu bol antihyperglykemický účinok porovnateľný u bielych (n = 249), čiernych (n = 51) a hispáncov (n = 24).
Klinické štúdie
Glucophage
V dvojito zaslepenej, placebom kontrolovanej, multicentrickej klinickej štúdii v USA, na ktorej sa zúčastnili obézni pacienti s cukrovkou 2. typu, ktorých hyperglykémia nebola primerane zvládnutá samotná strava (základná hladina glukózy v plazme nalačno [FPG] približne 240 mg / dl), liečba glukofágom (do 2550 mg / deň) počas 29 týždňov viedla k významnému priemerné čisté zníženie glukózy v plazme nalačno a postprandiálnej plazmatickej glukózy (PPG) a hemoglobínu A1c (HbA1c) o 59 mg / dl, 83 mg / dl a 1,8% v porovnaní so skupinou s placebom (pozri pozri časť 4.8). Tabuľka 2).
Tabuľka 2: Súhrn priemerných zmien glukózy a placeba oproti východiskovým hodnotám * v plazmatickej glukóze nalačno, HbA1ca telesná hmotnosť pri záverečnej návšteve (29-týždňová štúdia)
| Glucophage (N = 141) |
placebo (N = 145) |
p-Hodnota | |
|---|---|---|---|
| * Všetci pacienti, ktorí majú na začiatku liečby diétu | ** Nie je štatisticky významný | ||
| FPG (mg / dl) Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
241.5 -53.0 |
237.7 6.3 |
NS ** 0.001 |
| Hemoglobín A1c (%) Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
8.4 -1.4 |
8.2 0.4 |
NS ** 0.001 |
| Telesná hmotnosť (libier) Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
201.0 -1.4 |
206.0 -2.4 |
NS ** NS ** |
U obéznych pacientov s typom 2 sa uskutočnila 29-týždňová, dvojito zaslepená, placebom kontrolovaná štúdia Glukofágu a glyburidu, samostatne a v kombinácii. cukrovka, u ktorej sa nedosiahla primeraná kontrola glykémie pri maximálnych dávkach glyburidu (východisková hodnota FPG približne 250 mg / dl) (pozri tabuľku) 3). Pacienti randomizovaní do kombinovaného ramena začali s liekom Glucophage 500 mg a glyburidom 20 mg. Na konci každého týždňa z prvých 4 týždňov štúdie sa týmto pacientom zvýšili dávky glukofágu o 500 mg, ak nedosiahli cieľovú hladinu glukózy v plazme nalačno. Po 4. týždni sa takéto úpravy dávkovania uskutočňovali mesačne, hoci u žiadneho pacienta nebolo povolené prekročiť Glucophage 2500 mg. Pacienti v skupine s liekom len s obsahom glukofágu (metformín plus placebo) postupovali podľa rovnakej titračnej schémy. Na konci štúdie približne 70% pacientov v kombinovanej skupine užívalo Glucophage 2000 mg / glyburid 20 mg alebo Glucophage 2500 mg / glyburid 20 mg. U pacientov randomizovaných na pokračovanie v glyburide došlo k zhoršeniu glykemickej kontroly s priemerným zvýšením FPG, PPG a HbA1c o 14 mg / dl, 3 mg / dl a 0,2%. Naproti tomu u pacientov randomizovaných na glukofág (do 2500 mg / deň) došlo k miernemu zlepšeniu s priemerným znížením FPG, PPG a HbA1c o 1 mg / dl, 6 mg / dl a 0,4%. Kombinácia glukofágu a glyburidu bola účinná pri znižovaní hladín FPG, PPG a HbA1c o 63 mg / dl, 65 mg / dl a 1,7%. V porovnaní s výsledkami liečby samotným glyburidom boli čisté rozdiely pri kombinovanej liečbe -77 mg / dl, -68 mg / dl a -1,9% (pozri tabuľku 3).
Tabuľka 3: Kombinovaná monoterapia glukofágom / glyburidom (hrebeň) verzus glyburidom (glyf) alebo glukofágom (GLU): Súhrn priemerných zmien oproti východiskovej hodnote * v plazmatickej glukóze nalačno, HbA1ca telesná hmotnosť pri záverečnej návšteve (29-týždňová štúdia)
| hodnoty p | ||||||
|---|---|---|---|---|---|---|
| hrebeň (N = 213) |
glyB (N = 209) |
GLU (N = 210) |
Glyb vs hrebeň |
GLU vs hrebeň |
GLU vs glyB |
|
| * Všetci pacienti užívajúci glyburid, 20 mg / deň, na začiatku liečby | ** Nie je štatisticky významný | |||||
| Plazmatická glukóza nalačno (mg / dl) | ||||||
| Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
250.5 -63.5 |
247.5 13.7 |
253.9 -0.9 |
NS ** 0.001 |
NS ** 0.001 |
NS ** 0.025 |
| Hemoglobín A1c (%) | ||||||
| Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
8.8 -1.7 |
8.5 0.2 |
8.9 -0.4 |
NS ** 0.001 |
NS ** 0.001 |
0.007 0.001 |
| Telesná hmotnosť (libier) | ||||||
| Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
202.2 0.9 |
203.0 -0.7 |
204.0 -8.4 |
NS ** 0.011 |
NS ** 0.001 |
NS ** 0.001 |
Stupeň poklesu koncentrácie glukózy v krvi nalačno po zavedení Terapia liekom Glucophage (metformin hydrochloride) bola úmerná hladine nalačno hyperglykémia. U pacientov s cukrovkou 2. typu s vyššími hladinami glukózy na lačno došlo k väčšiemu poklesu hladiny glukózy v plazme a glykozylovaného hemoglobínu.
V klinických štúdiách Glucophage, samotný alebo v kombinácii so sulfonylmočovinou, znižoval priemerné sérum nalačno hladiny triglyceridov, celkového cholesterolu a LDL cholesterolu a nemali žiadne nepriaznivé účinky na iné hladiny lipidov (pozri Tabuľka 4).
Tabuľka 4: Zhrnutie priemernej percentuálnej zmeny oproti východiskovým hodnotám hlavných sérových lipidových premenných pri konečnej návšteve (29-týždňové štúdie)
| Glukofág vs Placebo | Kombinovaný glukofág / glyburid vs Monoterapia |
||||
|---|---|---|---|---|---|
| Glucophage (N = 141) |
placebo (N = 145) |
Glucophage (N = 210) |
Glucophage / glyburidu (N = 213) |
glyburidu (N = 209) |
|
| Celkový cholesterol (mg / dl) | |||||
| Baseline Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE |
211.0 -5% |
212.3 1% |
213.1 -2% |
215.6 -4% |
219.6 1% |
| Celkové triglyceridy (mg / dl) | |||||
| Baseline Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE |
236.1 -16% |
203.5 1% |
242.5 -3% |
215.0 -8% |
266.1 4% |
| LDL-cholesterol (mg / dl) | |||||
| Baseline Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE |
135.4 -8% |
138.5 1% |
134.3 -4% |
136.0 -6% |
137.5 3% |
| HDL-cholesterol (mg / dl) | |||||
| Baseline Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE |
39.0 2% |
40.5 -1% |
37.2 5% |
39.0 3% |
37.0 1% |
Na rozdiel od sulfonylmočovín mala telesná hmotnosť jednotlivcov na glukofágu tendenciu zostať stabilná alebo dokonca mierne klesať (pozri Tabuľky 2 a 3).
Bola uskutočnená 24-týždňová, dvojito zaslepená, placebom kontrolovaná štúdia s Glucophage plus inzulín verzus inzulín plus placebo vykonávané u pacientov s cukrovkou 2. typu, u ktorých sa nedosiahla primeraná glykemická kontrola samotného inzulínu (pozri 4.2) Tabuľka 5). Pacienti randomizovaní na užívanie Glucophage plus inzulínu dosiahli zníženie HbA1c o 2,10% v porovnaní so znížením HbA1c o 1,56% dosiahnutým inzulínom plus placebom. Zlepšenie kontroly glykémie sa dosiahlo pri poslednej návšteve štúdie so 16% menším množstvom inzulínu, 93,0 U / deň oproti 110,6 U / deň, Glucophage plus inzulín verzus inzulín plus placebo, p = 0,04.
Tabuľka 5: Súhrn priemerných zmien glukózy a inzulínu v porovnaní s placebom a inzulínom oproti východiskovým hodnotám v HbA1c a denná dávka inzulínu
| Glucophage / inzulín (N = 26) |
placebo / inzulín (N = 28) |
liečba Rozdiel Priemer ± SE |
|
|---|---|---|---|
|
Štatisticky významné pomocou analýzy kovariancie s východiskovou hodnotou ako kovariát (p = 0,04) Pri analýze rozptylu nie sú významné (hodnoty sú uvedené v tabuľke) | |||
| b Štatisticky významný pre inzulín (p = 0,04) | |||
| Hemoglobín A1c (%) | |||
| Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
8.95 -2.10 |
9.32 -1.56 |
-0.54 ± 0.43 |
| Inzulínová dávka (U / deň) | |||
| Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
93.12 -0.15 |
94.64 15.93 |
-16.08 ± 7.77b |
Druhá dvojito zaslepená, placebom kontrolovaná štúdia (n = 51) so 16 týždňami randomizovanej liečby preukázala, že u pacientov s cukrovkou 2. typu kontrolovaných inzulínom počas 8 týždňov. s priemerným HbA1c 7,46 ± 0,97% si pridaním glukofágu zachovala podobnú kontrolu glykémie (HbA1c 7,15 ± 0,61 vs 6,97 ± 0,62 pre glukofág plus inzulín a placebo plus inzulín) s 19% menej inzulínu oproti východiskovej hodnote (zníženie o 23,68 ± 30,22 oproti zvýšeniu o 0,43 ± 25,20 jednotiek pre Glucophage plus inzulín a placebo plus inzulín, p <0,01). Táto štúdia okrem toho preukázala, že kombinácia Glucophage plus inzulínu viedla k zníženiu v telesnej hmotnosti 3,11 ± 4,30 libier v porovnaní so zvýšením o 1,30 ± 6,08 libier pre placebo plus inzulín, p = 0,01.
Glucophage XR
V týždni sa uskutočnila 24-týždňová, dvojito zaslepená, placebom kontrolovaná štúdia Glucophage XR, ktorá sa užívala raz denne spolu s večerným jedlom. pacienti s cukrovkou 2. typu, u ktorých sa nedosiahla glykemická kontrola diétou a cvičením (HbA1c 7,0% -10,0%, FPG 126-270 mg / dl). Pacienti vstupujúci do štúdie mali priemernú základnú hladinu HbA1c 8,0% a priemernú základnú hladinu FPG 176 mg / dl. Po 12 týždňoch liečby sa priemerný HbA1c zvýšil zo základnej línie o 0,1% a priemerný FPG sa znížil zo základnej línie o 2 mg / dl v skupine s placebom, v porovnaní so znížením priemernej HbA1c o 0,6% a znížením priemernej FPG o 23 mg / dl u pacientov liečených Glucophage XR 1 000 mg raz denne. Následne bola liečebná dávka zvýšená na 1 500 mg raz denne, ak bol HbA1c 7,0%, ale <8,0% (pacienti so štúdiou HbA1c 8,0% boli zo štúdie prerušení). Pri poslednej návšteve (24 týždňov) sa priemerný HbA1c zvýšil u pacientov s placebom o 0,2% oproti východiskovým hodnotám a pri Glucophage XR sa znížil o 0,6%.
16-týždňová, dvojito zaslepená, placebom kontrolovaná štúdia Glucophage XR s odpoveďou na dávku, ktorá sa užíva jedenkrát denne s večerným jedlom alebo dvakrát denne s jedlom, bol uskutočňovaný u pacientov s cukrovkou 2. typu, u ktorých sa nedosiahla kontrola glykémie diétou a cvičením (HbA1c 7,0% -11,0%, FPG 126-280 mg / dl). Zmeny v glykemickej kontrole a telesnej hmotnosti sú uvedené v tabuľke 6.
Tabuľka 6: Zhrnutie priemerných zmien oproti východiskovej hodnote * v HbA1cPlazmatická glukóza nalačno a telesná hmotnosť pri záverečnej návšteve (16-týždňová štúdia)
| Glucophage XR | placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg akonáhle denná |
1000 mg akonáhle denná |
1500 mg akonáhle denná |
2000 mg akonáhle denná |
1000 mg dvakrát denná |
||
| * Všetci pacienti, ktorí majú na začiatku liečby diétu | ||||||
| Všetky porovnania verzus Placebo | ||||||
| ** Nie je štatisticky významný | ||||||
| Hemoglobín A1c (%) | (N = 115) | (N = 115) | (N = 111) | (N = 125) | (N = 112) | (N = 111) |
| Baseline | 8.2 | 8.4 | 8.3 | 8.4 | 8.4 | 8.4 |
| Zmena na ZÁVEREČNEJ NÁVŠTEVE | -0.4 | -0.6 | -0.9 | -0.8 | -1.1 | 0.1 |
| p-hodnota | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| FPG (mg / dl) | (N = 126) | (N = 118) | (N = 120) | (N = 132) | (N = 122) | (N = 113) |
| Baseline | 182.7 | 183.7 | 178.9 | 181.0 | 181.6 | 179.6 |
| Zmena na ZÁVEREČNEJ NÁVŠTEVE | -15.2 | -19.3 | -28.5 | -29.9 | -33.6 | 7.6 |
| p-hodnota | <0.001 | <0.001 | <0.001 | <0.001 | <0.001 | - |
| Telesná hmotnosť (libier) | (N = 125) | (N = 119) | (N = 117) | (N = 131) | (N = 119) | (N = 113) |
| Baseline | 192.9 | 191.8 | 188.3 | 195.4 | 192.5 | 194.3 |
| Zmena na ZÁVEREČNEJ NÁVŠTEVE | -1.3 | -1.3 | -0.7 | -1.5 | -2.2 | -1.8 |
| p-hodnota | NS ** | NS ** | NS ** | NS ** | NS ** | - |
V porovnaní s placebom bolo zlepšenie glykemickej kontroly pozorované pri všetkých hladinách dávky Glucophage XR (metformín) hydrochlorid) Tablety s predĺženým uvoľňovaním a liečba nebola spojená so žiadnou významnou zmenou hmotnosti (pozri DÁVKOVANIE A PODÁVANIE na odporúčanie dávkovania pre Glucophage a Glucophage XR).
24-týždňová, dvojito zaslepená, randomizovaná štúdia Glucophage XR užívaná jedenkrát denne s večerným jedlom a Glucophage (metformíniumchlorid) tablety užívaná dvakrát denne (s raňajky a večerné jedlo), sa uskutočňovalo u pacientov s cukrovkou 2. typu, ktorí boli liečení Glucophage 500 mg dvakrát denne najmenej 8 týždňov pred vstupom do štúdie. Dávka glukofágu nebola nevyhnutne titrovaná, aby sa dosiahla špecifická úroveň glykemickej kontroly pred vstupom do štúdie. Pacienti sa kvalifikovali na štúdiu, ak HbA1c bol 8,5% a FPG bola 200 mg / dl. Zmeny v glykemickej kontrole a telesnej hmotnosti sú uvedené v tabuľke 7.
Tabuľka 7: Zhrnutie priemerných zmien oproti východiskovej hodnote * v HbA1c, Plazmatická glukóza nalačno a telesná hmotnosť v 12. týždni a pri záverečnej návšteve (24-týždňová štúdia)
| Glucophage 500 mg Dva krát denne |
Glucophage XR | ||
|---|---|---|---|
| 1000 mg Raz denne |
1500 mg Raz denne |
||
| * Všetci pacienti užívajúci Glucophage 500 mg dvakrát denne na začiatku liečby | |||
| n = 68 | |||
| Hemoglobín A1c (%) | (N = 67) | (N = 72) | (N = 66) |
| Baseline | 7.06 | 6.99 | 7.02 |
| Zmena o 12 týždňov | 0.14 | 0.23 | 0.04 |
| (95% CI) | (-0.03, 0.31) | (0.10, 0.36) | (-0.08, 0.15) |
| Zmena na ZÁVEREČNEJ NÁVŠTEVE | 0.14 | 0.27 | 0.13 |
| (95% CI) | (-0.04, 0.31) | (0.11, 0.43) | (-0.02, 0.28) |
| FPG (mg / dl) | (N = 69) | (N = 72) | (N = 70) |
| Baseline | 127.2 | 131.0 | 131.4 |
| Zmena o 12 týždňov | 12.9 | 9.5 | 3.7 |
| (95% CI) | (6.5, 19.4) | (4.4, 14.6) | (-0.4, 7.8) |
| Zmena na ZÁVEREČNEJ NÁVŠTEVE | 14.0 | 11.5 | 7.6 |
| (95% CI) | (7.0, 21.0) | (4.4, 18.6) | (1.0, 14.2) |
| Telesná hmotnosť (libier) | (N = 71) | (N = 74) | (N = 71) |
| Baseline | 210.3 | 202.8 | 192.7 |
| Zmena o 12 týždňov | 0.4 | 0.9 | 0.7 |
| (95% CI) | (-0.4, 1.5) | (0.0, 2.0) | (-0.4, 1.8) |
| Zmena na ZÁVEREČNEJ NÁVŠTEVE | 0.9 | 1.1 | 0.9 |
| (95% CI) | (-0.4, 2.2) | (-0.2, 2.4) | (-0.4, 2.0) |
Po 12 týždňoch liečby došlo k zvýšeniu priemernej HbA1c vo všetkých skupinách; v skupine s 1 000 mg Glucophage XR bol štatisticky významný nárast oproti východiskovým hodnotám o 0,23% (pozri časť 5.2) DÁVKOVANIE A PODÁVANIE).
Zmeny lipidových parametrov v predtým opísanej štúdii Glucophage XR kontrolovanej dávkou a odozvou na dávku sú uvedené v tabuľke 8.
Tabuľka 8: Zhrnutie priemerných percentuálnych zmien oproti východiskovým hodnotám * v hlavných premenných lipidov pri konečnej návšteve (16-týždňová štúdia)
| Glucophage XR | placebo | |||||
|---|---|---|---|---|---|---|
| 500 mg akonáhle denná |
1000 mg akonáhle denná |
1500 mg akonáhle denná |
2000 mg akonáhle denná |
1000 mg dvakrát denná |
||
| * Všetci pacienti, ktorí majú na začiatku liečby diétu | ||||||
| Celkový cholesterol (mg / dl) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Baseline | 210.3 | 218.1 | 214.6 | 204.4 | 208.2 | 208.6 |
| Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE | 1.0% | 1.7% | 0.7% | -1.6% | -2.6% | 2.6% |
| Celkové triglyceridy (mg / dl) | (N = 120) | (N = 113) | (N = 110) | (N = 126) | (N = 117) | (N = 110) |
| Baseline | 220.2 | 211.9 | 198.0 | 194.2 | 179.0 | 211.7 |
| Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE | 14.5% | 9.4% | 15.1% | 14.9% | 9.4% | 10.9% |
| LDL-cholesterol (mg / dl) | (N = 119) | (N = 113) | (N = 109) | (N = 126) | (N = 117) | (N = 107) |
| Baseline | 131.0 | 134.9 | 135.8 | 125.8 | 131.4 | 131.9 |
| Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE | -1.4% | -1.6% | -3.5% | -3.3% | -5.5% | 3.2% |
| HDL-cholesterol (mg / dl) | (N = 120) | (N = 108) | (N = 108) | (N = 125) | (N = 117) | (N = 108) |
| Baseline | 40.8 | 41.6 | 40.6 | 40.2 | 42.4 | 39.4 |
| Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE | 6.2% | 8.6% | 5.5% | 6.1% | 7.1% | 5.8% |
Zmeny lipidových parametrov v predtým opísanej štúdii Glucophage a Glucophage XR sú uvedené v tabuľke 9.
Tabuľka 9: Súhrn priemerných percentuálnych zmien oproti východiskovým hodnotám * v hlavných premenných lipidov pri konečnej návšteve (24-týždňová štúdia)
| Glucophage | Glucophage XR | ||
|---|---|---|---|
| 500 mg Dva krát denne |
1000 mg Raz denne |
1500 mg Raz denne |
|
| * Všetci pacienti užívajúci Glucophage 500 mg dvakrát denne na začiatku liečby | |||
| Celkový cholesterol (mg / dl) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 199.0 | 201.9 | 201.6 |
| Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE | 0.1% | 1.3% | 0.1% |
| Celkové triglyceridy (mg / dl) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 178.0 | 169.2 | 206.8 |
| Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE | 6.3% | 25.3% | 33.4% |
| LDL-cholesterol (mg / dl) | (N = 68) | (N = 70) | (N = 66) |
| Baseline | 122.1 | 126.2 | 115.7 |
| Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE | −1.3% | −3.3% | −3.7% |
| HDL-cholesterol (mg / dl) | (N = 68) | (N = 70) | (N = 65) |
| Baseline | 41.9 | 41.7 | 44.6 |
| Priemerná% zmena na ZÁVEREČNEJ NÁVŠTEVE | 4.8% | 1.0% | -2.1% |
Pediatrické klinické štúdie
V dvojito zaslepenej, placebom kontrolovanej štúdii u pediatrických pacientov vo veku 10 až 16 rokov s diabetom 2. typu (priemerná FPG 182,2 mg / dl), liečba glukofágom (do 2 000) mg / deň) po dobu až 16 týždňov (priemerné trvanie liečby 11 týždňov) malo za následok významné priemerné čisté zníženie FPG o 64,3 mg / dl v porovnaní s placebom (pozri tabuľku 10).
Tabuľka 10: Glukofág vs. Placebo (pediatria) Zhrnutie priemerných zmien oproti východiskovej hodnote * v plazmatickej glukóze a telesnej hmotnosti pri konečnej návšteve
| Glucophage | placebo | p-Hodnota | |
|---|---|---|---|
| Pediatrickí pacienti priemerný vek 13,8 rokov (v rozmedzí 10 - 16 rokov) | |||
| * Všetci pacienti, ktorí majú na začiatku liečby diétu | |||
| ** Nie je štatisticky významný | |||
| FPG (mg / dl) | (N = 37) | (N = 36) | |
| Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
162.4 -42.9 |
192.3 21.4 |
<0.001 |
| Telesná hmotnosť (libier) | (N = 39) | (N = 38) | |
| Baseline Zmena na ZÁVEREČNEJ NÁVŠTEVE |
205.3 -3.3 |
189.0 -2.0 |
NS ** |
top
Indikácie a použitie
Glukofág (metformíniumchlorid) Tablety sú indikované ako doplnok k diéte a cvičeniu na zlepšenie kontroly glykémie u dospelých a detí s diabetes mellitus 2. typu.
Tablety Glucophage XR (metformin hydrochloride) s predĺženým uvoľňovaním sú indikované ako doplnok k diéte a cvičeniu, aby sa zlepšila kontrola glykémie u dospelých s diabetes mellitus 2. typu.
top
kontraindikácie
Glucophage a Glucophage XR sú kontraindikované u pacientov s:
Ochorenie obličiek alebo renálna dysfunkcia (napr. Ako to naznačujú hladiny kreatinínu v sére 1,5 mg / dl [muži], 1,4 mg / dl [ženy] alebo abnormálne hodnoty klírens kreatinínu), ktorý môže byť tiež dôsledkom stavov, ako je kardiovaskulárny kolaps (šok), akútny infarkt myokardu a septikémia (pozri UPOZORNENIE a OPATRENIA).
Známa precitlivenosť na metformíniumchlorid.
Akútna alebo chronická metabolická acidóza vrátane diabetickej ketoacidózy, s kómou alebo bez kómy. Diabetická ketoacidóza sa má liečiť inzulínom.
U pacientov, ktorí sa podrobujú rádiologickým štúdiám zahŕňajúcim Glucophage a Glucophage XR sa má dočasne vysadiť intravaskulárne podávanie jódovaných kontrastných materiálov, pretože použitie takýchto produktov môže viesť k akútnej zmene renálna funkcia. (Pozri tiež OPATRENIA.)
top
varovanie
Laktátová acidóza:
Laktátová acidóza je zriedkavá, ale závažná metabolická komplikácia, ktorá sa môže vyskytnúť v dôsledku akumulácie metformínu počas liečby Glucophage alebo Glucophage XR; keď sa vyskytne, je smrteľný v približne 50% prípadov. Laktátová acidóza sa môže vyskytnúť aj v súvislosti s celým radom patofyziologických stavov, vrátane diabetes mellitus, a vždy, keď existuje významná tkanivová hypoperfúzia a hypoxémia. Laktátová acidóza sa vyznačuje zvýšenými hladinami laktátu v krvi (> 5 mmol / l), zníženým pH krvi, poruchami elektrolytov so zvýšenou aniónovou medzerou a zvýšeným pomerom laktát / pyruvát. Ak je metformín implikovaný ako príčina laktátovej acidózy, všeobecne sa zistia plazmatické hladiny metformínu> 5 µg / ml.
Hlásený výskyt laktátovej acidózy u pacientov dostávajúcich metformíniumchlorid je veľmi nízky (približne 0,03 prípadov / 1 000 pacientorokov, s približne 0,015 fatálnymi prípadmi / 1 000 pacient-rokov). Vo viac ako 20 000 pacientorokových expozíciách metformínu v klinických skúšaniach neboli hlásené žiadne prípady laktátovej acidózy. Hlásené prípady sa vyskytli predovšetkým u diabetických pacientov so signifikantnou renálnou insuficienciou, vrátane intrinzickej renálnej insuficiencie choroba a obličková hypoperfúzia, často pri vzniku viacerých sprievodných lekárskych / chirurgických problémov a viacpočetných sprievodných ochorení lieky. Pacienti s kongestívnym zlyhaním srdca, ktorí potrebujú farmakologický manažment, najmä tí, ktorí sú nestabilní alebo akútne kongestívne zlyhanie srdca, ktoré je vystavené riziku hypoperfúzie a hypoxémie, má zvýšené riziko laktátu acidóza. Riziko laktátovej acidózy sa zvyšuje so stupňom renálnej dysfunkcie a s vekom pacienta. Riziko laktátovej acidózy sa preto môže významne znížiť pravidelným monitorovaním funkcie obličiek v roku 2006 pacienti užívajúci Glucophage alebo Glucophage XR a s použitím minimálnej účinnej dávky Glucophage alebo Glucophage XR. Liečba starších pacientov by mala byť sprevádzaná najmä starostlivým monitorovaním funkcie obličiek. Liečba glukofágom alebo liekom Glucophage XR sa nemá začať u pacientov vo veku 80 rokov, pokiaľ nie je stanovená hladina kreatinínu. klírens demonštruje, že funkcia obličiek nie je znížená, pretože títo pacienti sú náchylnejší na vývoj laktátu acidóza. Glucophage a Glucophage XR by sa mali navyše okamžite zadržať v prítomnosti akýchkoľvek stavov spojených s hypoxémiou, dehydratáciou alebo sepsou. Pretože zhoršená funkcia pečene môže významne obmedziť schopnosť čistiť laktát, Glukofág a U pacientov s klinickým alebo laboratórnym nálezom pečene by sa vo všeobecnosti nemalo užívať Glucophage XR choroby. Pri užívaní je potrebné pacientov upozorniť na nadmerný príjem alkoholu, akútneho alebo chronického Glucophage alebo Glucophage XR, pretože alkohol zosilňuje účinky hydrochloridu metformínu na laktát. metabolizmus. Okrem toho sa má Glucophage a Glucophage XR dočasne prerušiť pred akoukoľvek intravaskulárnou rádiokontrastnou štúdiou a pred akýmkoľvek chirurgickým zákrokom (pozri tiež OPATRENIA).
Nástup laktátovej acidózy je často jemný a sprevádzaný iba nešpecifickými príznakmi, ako sú malátnosť, myalgia, respiračná tieseň, zvýšená ospalosť a nešpecifická brušná úzkosť. Môžu byť spojené s podchladením, hypotenziou a rezistentnými bradyarytmiami s výraznejšou acidózou. Pacient a lekár pacienta si musia byť vedomí možnej dôležitosti takýchto príznakov a pacient by mal byť poučený, aby okamžite informoval lekára, ak sa vyskytnú (pozri tiež OPATRENIA). Glucophage a Glucophage XR by sa mali odobrať, až kým sa situácia neobjasní. Užitočné môžu byť elektrolyty v sére, ketóny, glukóza v krvi, a ak je to uvedené, pH krvi, hladiny laktátu a dokonca aj hladiny metformínu v krvi. Keď sa pacient stabilizuje na akejkoľvek dávke Glucophage alebo Glucophage XR, je nepravdepodobné, že by gastrointestinálne príznaky, ktoré sú bežné na začiatku liečby, súviseli s liekom. Neskorší výskyt gastrointestinálnych príznakov môže byť spôsobený laktátovou acidózou alebo iným závažným ochorením.
Hladiny laktátového plazmatického laktátu nalačno nad hornou hranicou normálu, ale nižšou ako 5 mmol / l u pacientov užívajúcich Glucophage alebo Glucophage XR nemusia nevyhnutne naznačovať hroziaca laktátová acidóza a môže byť vysvetlená inými mechanizmami, ako je zle kontrolovaná cukrovka alebo obezita, silná fyzická aktivita alebo technické problémy vo vzorke manipuláciu. (Pozri tiež OPATRENIA.)
U každého diabetického pacienta s podozrením na ketoacidózu (ketonúria a ketonémia) by sa malo vyskytnúť podozrenie na laktátovú acidózu.
Laktátová acidóza je lekárska pohotovosť, ktorá sa musí liečiť v nemocničnom prostredí. U pacientov s laktátovou acidózou, ktorí užívajú Glucophage alebo Glucophage XR, sa má liek okamžite vysadiť a okamžite sa musia zaviesť všeobecné podporné opatrenia. Pretože hydrochlorid metformínu je dialyzovateľný (s klírensom až 170 ml / min pri dobrej hemodynamike) podmienky), odporúča sa okamžitá hemodialýza na korekciu acidózy a odstránenie nahromadených metformín. Takéto riadenie často vedie k okamžitému zvráteniu príznakov a uzdraveniu. (Pozri tiež Kontraindikácie a OPATRENIA.)
top
Opatrenia
všeobecný
Makrovaskulárne výsledky - Neuskutočnili sa žiadne klinické štúdie, ktoré by preukázali presvedčivý dôkaz o znížení makrovaskulárneho rizika s Glucophage alebo Glucophage XR alebo akýmkoľvek iným antidiabetikom.
Monitorovanie funkcie obličiek - je známe, že metformín sa vylučuje obličkami a riziko hromadenia metformínu a laktátovej acidózy sa zvyšuje so stupňom poškodenia obličiek Funkcie. Pacienti s hladinami kreatinínu v sére nad hornou hranicou normy pre ich vek by preto nemali dostávať Glucophage alebo Glucophage XR. U pacientov s pokročilým vekom by sa mali glucofágy a Glukofágy XR starostlivo titrovať, aby sa stanovili minimálna dávka na dosiahnutie adekvátneho glykemického účinku, pretože starnutie je spojené so zníženou funkciou obličiek Funkcie. U starších pacientov, najmä u pacientov vo veku ≥ 80 rokov, by sa mali pravidelne sledovať funkcie obličiek a všeobecne by sa Glucophage a Glucophage XR nemali titrovať na maximálnu dávku (pozri časť UPOZORNENIE a DÁVKOVANIE A PODÁVANIE).
Pred začatím liečby Glucophage alebo Glucophage XR a potom najmenej raz ročne by sa mala obličková funkcia vyhodnotiť a overiť ako normálna. U pacientov, u ktorých sa predpokladá vývoj renálnej dysfunkcie, sa má vyhodnotiť funkcia obličiek častejšie a podávanie Glucophage alebo Glucophage XR sa prerušilo, ak je dôkaz poškodenia obličiek prítomná.
Používanie súbežných liekov, ktoré môžu ovplyvniť funkciu obličiek alebo dispozíciu metformínu - Sprievodné lieky, ktoré môžu ovplyvniť funkciu obličiek alebo viesť k významná hemodynamická zmena alebo môže narušiť dispozíciu metformínu, ako sú katiónové lieky, ktoré sa vylučujú renálnou tubulárnou sekréciou (pozri pozri časť 4.4). OPATRENIA: Liekové interakcie), by sa mali používať opatrne.
Rádiologické štúdie zahŕňajúce použitie intravaskulárnych jódovaných kontrastných látok (napríklad intravenózny urogram, intravenózne) cholangiografia, angiografia a počítačová tomografia (CT), skenovanie pomocou intravaskulárnych kontrastných materiálov) - štúdie intravaskulárneho kontrastu s Jódové materiály môžu viesť k akútnym zmenám funkcie obličiek a sú spojené s laktátovou acidózou u pacientov, ktorí dostávajú metformín (pozri Kontraindikácie). Preto u pacientov, u ktorých je takáto štúdia plánovaná, sa má Glucophage alebo Glucophage XR dočasne vysadiť v čase alebo pred začiatkom liečby. po 48 hodinách od zákroku a obnovená až po opätovnom vyhodnotení funkcie obličiek a zistení, že normálu.
Hypoxické stavy - Kardiovaskulárny kolaps (šok) z akejkoľvek príčiny, akútne kongestívne zlyhanie srdca, akútny myokard infarkt a ďalšie stavy charakterizované hypoxémiou boli spojené s laktátovou acidózou a môžu tiež spôsobiť prerenálna azotémia. Ak sa takéto udalosti vyskytnú u pacientov liečených glukofágom alebo Glucophage XR, liek sa musí okamžite prerušiť.
Chirurgické zákroky - Liečba glukofágom alebo Glukofágom XR by sa mala dočasne prerušiť pre akýkoľvek chirurgický zákrok (okrem menších zákrokov, ktoré nie sú spojené) s obmedzeným príjmom potravy a tekutín) a nemalo by sa obnoviť, kým sa neobnoví perorálny príjem pacienta a kým sa nevyhodnotia obličkové funkcie ako normálu.
Príjem alkoholu - je známe, že alkohol zosilňuje účinok metformínu na metabolizmus laktátu. Pacienti by preto mali byť počas liečby Glucophage alebo Glucophage XR upozornení na nadmerný príjem alkoholu, akútny alebo chronický.
Poškodená funkcia pečene - keďže zhoršená funkcia pečene bola spojená s niektorými prípadmi laktátovej acidózy, U pacientov s klinickými alebo laboratórnymi dôkazmi pečene by sa vo všeobecnosti nemalo používať glukofág a Glucophage XR choroby.
Hladiny vitamínu B12 - V kontrolovaných klinických skúškach s glukofágom trvajúcim 29 týždňov, pokles na subnormálne hladiny predtým približne normálne hladiny vitamínu B12 v sére, bez klinických prejavov, sa pozorovali približne u 7% pacienti. Takéto zníženie, pravdepodobne v dôsledku interferencie s absorpciou B12 z komplexu B12 s vnútorným faktorom, je však veľmi vysoké zriedkavo sa spája s anémiou a zdá sa, že je rýchlo reverzibilný po prerušení podávania glukofágu alebo vitamínu B12 suplementácia. U pacientov užívajúcich Glucophage alebo Glucophage XR sa odporúča každoročné meranie hematologických parametrov a všetky zjavné abnormality by sa mali náležite vyšetriť a liečiť (pozri pozri časť 4.8). OPATRENIA: Laboratórne testy).
Zdá sa, že niektorí jedinci (ľudia s nedostatočným príjmom alebo absorpciou vitamínu B12 alebo s obsahom vápnika) majú predispozíciu na vývoj subnormálnych hladín vitamínu B12. U týchto pacientov môže byť užitočné rutinné meranie sérového vitamínu B12 v 2- až 3-ročných intervaloch.
Zmena klinického stavu pacientov s predtým kontrolovanou cukrovkou 2. typu - Pacient s cukrovkou 2. typu predtým dobre kontrolovanej Glucophage alebo Glucophage XR, ktorí vyvíja laboratórne abnormality alebo klinické choroby (najmä nejasné a zle definované ochorenie) by sa mali okamžite vyhodnotiť na dôkaz ketoacidózy alebo laktátu. acidóza. Vyhodnotenie by malo zahŕňať sérové elektrolyty a ketóny, glukózu v krvi a, ak je to uvedené, pH krvi, hladiny laktátu, pyruvátu a metformínu. Ak dôjde k acidóze ktorejkoľvek formy, Glucophage alebo Glucophage XR sa musia okamžite zastaviť a musia sa začať ďalšie vhodné nápravné opatrenia (pozri tiež UPOZORNENIE).
Hypoglykémia - Hypoglykémia sa nevyskytuje u pacientov, ktorí dostávajú Glucophage alebo Glucophage XR samotný za obvyklých okolností použitia, ale môže sa vyskytnúť, keď je kalorický príjem nedostatok, ak namáhavé cvičenie nie je kompenzované kalorickým doplnením alebo počas súčasného používania s inými látkami znižujúcimi hladinu glukózy (ako sú sulfonylmočoviny a inzulín) alebo etanol.
Starší pacienti, oslabení alebo podvýživení a pacienti s adrenálnou alebo hypofýzou alebo intoxikáciou alkoholom sú obzvlášť náchylní na hypoglykemické účinky. Hypoglykémia môže byť ťažké rozpoznať u starších ľudí au ľudí, ktorí užívajú lieky blokujúce beta-adrenergiu.
Strata kontroly nad hladinou glukózy v krvi - Keď je pacient stabilizovaný ktorýmkoľvek diabetickým režimom vystavený stresu, ako je horúčka, trauma, infekcia alebo chirurgický zákrok, môže dôjsť k dočasnej strate glykemickej kontroly. V takomto prípade môže byť potrebné zadržať Glucophage alebo Glucophage XR a dočasne podať inzulín. Glukofág alebo Glucophage XR sa môže obnoviť po odstránení akútnej epizódy.
Účinnosť perorálnych antidiabetík pri znižovaní hladiny glukózy v krvi na cieľovú hladinu sa u mnohých pacientov v priebehu času znižuje. Tento jav, ktorý môže byť spôsobený progresiou základného ochorenia alebo zníženou reakciou na liek, je známe ako sekundárne zlyhanie, aby sa odlíšilo od primárneho zlyhania, pri ktorom je liečivo počas počiatočnej terapie neúčinné. Ak dôjde k sekundárnemu zlyhaniu buď s Glucophage alebo Glucophage XR alebo s monoterapiou sulfonylmočovinou, kombinovaná liečba s Glucophage alebo Glucophage XR a sulfonylmočovinou môže viesť k odpovedi. Ak sa vyskytne sekundárne zlyhanie pri kombinovanej liečbe glukofágom / sulfonylmočovinou alebo glukofágom Pri liečbe XR / sulfonylmočovinou môže byť potrebné zvážiť terapeutické alternatívy vrátane začatia liečby inzulínová terapia.
Informácie pre pacientov
Pacienti majú byť informovaní o potenciálnych rizikách a výhodách Glucophage alebo Glucophage XR ao alternatívnych spôsoboch liečby. Mali by byť informovaní aj o dôležitosti dodržiavania diétnych pokynov pri pravidelnom cvičení program a pravidelné testovanie hladiny glukózy v krvi, glykozylovaného hemoglobínu, renálnych funkcií a hematológov Parametre.
Riziká laktátovej acidózy, jej príznaky a stavy, ktoré predurčujú jej vývoj, ako je uvedené v UPOZORNENIE a OPATRENIA pacientom. Pacienti majú byť poučení, aby okamžite prerušili užívanie Glucophage alebo Glucophage XR a aby okamžite informovali svoje zdravie. praktický lekár, ak nevysvetľuje hyperventiláciu, myalgiu, nevoľnosť, nezvyčajnú ospalosť alebo iné nešpecifické príznaky nastať. Keď sa pacient stabilizuje na akejkoľvek dávke Glucophage alebo Glucophage XR, je nepravdepodobné, že by gastrointestinálne príznaky, ktoré sú bežné pri začatí liečby metformínom, súviseli s liekom. Neskorší výskyt gastrointestinálnych príznakov môže byť spôsobený laktátovou acidózou alebo iným závažným ochorením.
Počas liečby Glucophage alebo Glucophage XR je potrebné pacientov informovať o nadmernom príjme alkoholu, či už akútnom alebo chronickom.
Glukofág alebo samotný Glucophage XR zvyčajne nespôsobujú hypoglykémiu, hoci sa môže vyskytnúť, keď sa Glucophage alebo Glucophage XR použije v spojení s perorálnymi sulfonylmočovinami a inzulínom. Pri začatí kombinovanej liečby riziká hypoglykémie, jej príznaky a liečba a pacientom a zodpovednej rodine by sa mali vysvetliť podmienky, ktoré sú náchylné na jeho vývoj Členovia.
Pacienti musia byť informovaní o tom, že Glucophage XR sa musí prehltnúť celé a nesmie sa rozdrviť ani žuť, a že Neaktívne zložky sa môžu v stolici vylúčiť ako mäkká hmota, ktorá sa môže podobať originálu tabliet.
Laboratórne testy
Odpoveď na všetky diabetické terapie sa má monitorovať pravidelnými meraniami krvi nalačno hladiny glukózy a glykozylovaného hemoglobínu, s cieľom znížiť tieto hladiny smerom k normálu Rozsah. Počas počiatočnej titrácie dávky sa na stanovenie terapeutickej odpovede môže použiť glukóza nalačno. Potom by sa mala monitorovať glukóza aj glykozylovaný hemoglobín. Merania glykozylovaného hemoglobínu môžu byť obzvlášť užitočné na vyhodnotenie dlhodobej kontroly (pozri tiež DÁVKOVANIE A PODÁVANIE).
Počiatočné a periodické monitorovanie hematologických parametrov (napr. Hemoglobínu / hematokritu a červenej krvi indexy buniek) a funkcia obličiek (sérový kreatinín) by sa mali vykonávať aspoň raz ročne. Aj keď sa pri liečbe glukofágmi zriedka vyskytla megaloblasticanémia, v prípade podozrenia by sa mal vylúčiť nedostatok vitamínu B12.
Liekové interakcie (klinické hodnotenie liekových interakcií s glukofágom)
Glyburid - v interakčnej štúdii s jednou dávkou u pacientov s cukrovkou 2. typu, spoločné podávanie metformín a glyburid neviedli k žiadnym zmenám farmakokinetiky metformínu ani farmakodynamika. Boli pozorované poklesy AUC a Cmax glyburidu, ale boli vysoko variabilné. Jednorazová povaha tejto štúdie a neexistencia korelácie medzi hladinami glyburidu v krvi a farmakodynamickými účinkami spôsobuje klinický význam tejto interakcie neistý (pozri pozri časť 4.8). DÁVKOVANIE A PODÁVANIE: Súbežná liečba glukofágom alebo glukofágom XR a perorálna terapia sulfonylmočovinou u dospelých pacientov).
Furosemid - Štúdia liekovej interakcie s metformín-furosemidom s jednou dávkou u zdravých jedincov preukázala, že súbežné podávanie ovplyvnilo farmakokinetické parametre oboch zlúčenín. Furosemid zvýšil plazmatickú hladinu a Cmax metformínu o 22% a AUC v krvi o 15%, bez akejkoľvek významnej zmeny renálneho klírensu metformínu. Pri podávaní s metformínom boli Cmax a AUC furosemidu o 31% a AUC furosemidu o 12% nižšie, ako keď podávaný samostatne a terminálny polčas sa znížil o 32%, bez akejkoľvek významnej zmeny furosemidovej obličky klírens. Nie sú dostupné informácie o interakcii metformínu a furosemidu, keď sa podávajú chronicky.
Nifedipín - Štúdia liekových interakcií s jedinou dávkou metformínu a nifedipínu u zdravých dobrovoľníkov preukázala, že súčasné podávanie nifedipínu zvýšilo plazmatickú Cmax metformínu o 20% a AUC o 9% a zvýšilo množstvo vylučuje sa močom. Tmax a polčas neboli ovplyvnené. Zdá sa, že nifedipín zvyšuje absorpciu metformínu. Metformín mal na nifedipín minimálne účinky.
Katiónové lieky - Katiónové lieky (napr. Amilorid, digoxín, morfín, prokaínamid, chinidín, chinín, ranitidín, triamterén, trimetoprim alebo vankomycín), ktoré sú eliminované renálnou tubulárnou sekréciou teoreticky majú potenciál pre interakciu s metformínom súťažením o spoločný renálny tubulárny transport systémy. Takáto interakcia medzi metformínom a perorálnym cimetidínom bola pozorovaná u zdravých zdravých dobrovoľníkov u jednorazovej aj viacdávkovej metformín-cimetidínu. štúdie liekových interakcií so 60% zvýšením maximálnych koncentrácií metformínu v plazme a plnej krvi a 40% zvýšením plazmy a metformínu v plnej krvi AUC. V štúdii s jednorazovou dávkou sa polčas eliminácie nezmenil. Metformín nemal žiadny vplyv na farmakokinetiku cimetidínu. Aj keď takéto interakcie zostávajú teoretické (s výnimkou cimetidínu), starostlivé monitorovanie pacienta a úprava dávky Glucophage alebo Glucophage XR a / alebo interferujúce liečivo sa odporúča u pacientov, ktorí užívajú katiónové lieky, ktoré sa vylučujú prostredníctvom proximálneho tubulárneho tubulárneho sekrétu. Systém.
Iné - Niektoré lieky majú tendenciu vyvolávať hyperglykémiu a môžu viesť k strate kontroly glykémie. Medzi tieto lieky patria tiazidy a iné diuretiká, kortikosteroidy, fenotiazíny, produkty štítnej žľazy, estrogény, perorálne kontraceptíva, fenytoín, kyselina nikotínová, sympatomimetiká, lieky blokujúce vápnikové kanály a izoniazid. Ak sa takéto lieky podávajú pacientovi, ktorý dostáva Glucophage alebo Glucophage XR, pacient by sa mal dôsledne sledovať kvôli strate kontroly hladiny glukózy v krvi. Ak sa takéto lieky odoberajú pacientovi, ktorý dostáva Glucophage alebo Glucophage XR, pacienta treba starostlivo sledovať kvôli hypoglykémii.
U zdravých dobrovoľníkov nebola farmakokinetika metformínu a propranololu a metformínu a ibuprofénu pri súbežnom podávaní v interakčných štúdiách s jednou dávkou ovplyvnená.
Metformín sa zanedbateľne viaže na plazmatické bielkoviny, a preto je menej pravdepodobné, že interaguje s liečivami s vysokou väzbou na proteíny, ako sú napr salicyláty, sulfonamidy, chloramfenikol a probenecid v porovnaní so sulfonylmočovinami, ktoré sa vo veľkej miere viažu na sérum proteíny.
Karcinogenéza, mutagenéza, zhoršenie plodnosti
U potkanov (trvanie dávky 104 týždňov) a myší sa uskutočnili dlhodobé štúdie karcinogenity (trvanie dávky 91 týždňov) v dávkach až do 900 mg / kg / deň vrátane a 1500 mg / kg / deň, resp. Tieto dávky sú približne štvornásobkom maximálnej odporúčanej dennej dávky u ľudí 2000 mg na základe porovnania plochy povrchu tela. U samcov alebo samíc myší sa nezistil žiadny dôkaz karcinogenity s metformínom. Podobne sa u samcov potkanov nepozoroval žiadny tumorigénny potenciál s metformínom. U samíc potkanov liečených 900 mg / kg / deň sa však vyskytol zvýšený výskyt benígnych stromálnych maternicových polypov.
Pri nasledujúcich in vitro testoch sa nepreukázal mutagénny potenciál metformínu: Amesov test (S. S. typhimurium), génové mutačné testy (bunky myšacieho lymfómu) alebo chromozomálne aberácie (ľudské lymfocyty). Výsledky in vivo testu na mikrojadrách myší boli tiež negatívne.
Plodnosť samcov alebo samíc potkanov nebola ovplyvnená metformínom pri podávaní v dávkach až 600 mg / kg / deň, čo je približne trojnásobok maximálnej odporúčanej dennej dávky pre človeka na základe plochy povrchu tela Porovnanie.
tehotenstvo
Teratogénne účinky: Tehotenstvo Kategória B
Posledné informácie silne naznačujú, že abnormálne hladiny glukózy v krvi počas tehotenstva sú spojené s vyšším výskytom vrodených abnormalít. Väčšina odborníkov odporúča, aby sa inzulín používal počas tehotenstva na udržanie hladiny glukózy v krvi čo najbližšie k normálu. Keďže reprodukčné štúdie na zvieratách nie vždy predpovedajú ľudskú odpoveď, Glucophage a Glucophage XR by sa nemali používať počas gravidity, pokiaľ to nie je jednoznačne potrebné.
Neexistujú dostatočné a dobre kontrolované štúdie u gravidných žien s Glucophage alebo Glucophage XR. Metformín nebol teratogénny u potkanov a králikov pri dávkach do 600 mg / kg / deň. To predstavuje expozíciu asi 2-krát a 6-násobok maximálnej odporúčanej dennej dávky u ľudí 2000 mg na základe porovnania plochy povrchu tela pre potkany a králiky. Stanovenie koncentrácií plodu preukázalo parciálnu placentárnu bariéru metformínu.
Dojčiace matky
Štúdie na laktujúcich potkanoch ukazujú, že metformín sa vylučuje do mlieka a dosahuje úrovne porovnateľné s hladinami v plazme. Podobné štúdie sa neuskutočnili u dojčiacich matiek. Pretože u dojčiat môže existovať možnosť hypoglykémie, malo by sa rozhodnúť, či prerušiť dojčenie alebo prerušiť užívanie lieku, berúc do úvahy dôležitosť lieku pre matkou. Ak sa preruší podávanie Glucophage alebo Glucophage XR a ak samotná strava nestačí na kontrolu hladiny glukózy v krvi, mala by sa zvážiť liečba inzulínom.
Pediatrické použitie
Bezpečnosť a účinnosť Glukofágu pri liečbe cukrovky typu 2 bola stanovená v roku 2006 pediatrickí pacienti vo veku 10 až 16 rokov (štúdie sa neuskutočnili u pediatrických pacientov mladších ako 10 rokov) rokov). Použitie Glucophage v tejto vekovej skupine je podporené dôkazmi z primeraných a dobre kontrolovaných štúdií Glucophage u dospelých s ďalšími údajmi z kontrolovaná klinická štúdia s pediatrickými pacientmi vo veku 10 až 16 rokov s diabetom 2. typu, ktorá preukázala podobnú odpoveď pri glykemickej kontrole ako pri dospelí. (Pozri KLINICKÁ FARMAKOLÓGIA: Pediatrické klinické štúdie.) V tejto štúdii boli nežiaduce účinky podobné účinkom opísaným u dospelých. (Pozri NEŽIADUCE REAKCIE: Pediatrickí pacienti.) Odporúča sa maximálna denná dávka 2 000 mg. (Pozri DÁVKOVANIE A PODÁVANIE: Odporúčaný dávkovací rozvrh: Pediatrickí lekári.)
Bezpečnosť a účinnosť Glucophage XR u detských pacientov nebola stanovená.
Geriatrické použitie
Kontrolované klinické štúdie Glucophage a Glucophage XR nezahŕňali dostatočný počet starších pacientov, aby bolo možné určiť, či reagujú. na rozdiel od mladších pacientov, hoci iné hlásené klinické skúsenosti nezistili rozdiely v odpovediach medzi staršími a mladšími pacienti. Je známe, že metformín je vylučovaný obličkami, a pretože riziko závažných nežiaducich reakcií na liečivo je väčšie u pacientov s poškodenou funkciou obličiek by sa Glucophage a Glucophage XR mali používať iba u pacientov s normálnou funkciou obličiek (pozri časť Kontraindikácie, UPOZORNENIEa KLINICKÁ FARMAKOLÓGIA: Farmakokinetika). Pretože starnutie je spojené so zníženou funkciou obličiek, Glucophage alebo Glucophage XR by sa mali používať so zvyšujúcim sa vekom opatrne. Pri výbere dávky je potrebné postupovať opatrne a musí sa zakladať na starostlivom a pravidelnom monitorovaní funkcie obličiek. Vo všeobecnosti by starší pacienti nemali byť titrovaní na maximálnu dávku Glucophage alebo Glucophage XR (pozri tiež UPOZORNENIE a DÁVKOVANIE A PODÁVANIE).
top
Nežiaduce reakcie
V dvojito zaslepenej klinickej štúdii s Glucophage v USA u pacientov s cukrovkou 2. typu dostávalo terapiu glukofágom celkom 141 pacientov (do 2550 mg denne) a 145 pacientov dostávalo placebo. Nežiaduce reakcie hlásené u viac ako 5% pacientov s glukofágom, ktoré boli častejšie u pacientov liečených glukofágom ako pacienti liečení placebom, sú uvedené v tabuľke 11.
Tabuľka 11: Najčastejšie nežiaduce reakcie (> 5,0%) v placebom kontrolovanej klinickej štúdii monoterapie glukofágmi *
| Nepriaznivá reakcia | Glucophage monoterapia (N = 141) |
placebo (N = 145) |
|---|---|---|
| % pacientov | ||
| * Reakcie, ktoré boli častejšie u pacientov liečených glukofágom ako u pacientov liečených placebom. | ||
| Hnačka | 53.2 | 11.7 |
| Nevoľnosť / zvracanie | 25.5 | 8.3 |
| nadúvanie | 12.1 | 5.5 |
| asténia | 9.2 | 5.5 |
| zažívacie ťažkosti | 7.1 | 4.1 |
| Abdominálne ťažkosti | 6.4 | 4.8 |
| bolesť hlavy | 5.7 | 4.8 |
Hnačka viedla k prerušeniu liečby zo štúdie u 6% pacientov liečených glukofágom. Ďalej boli hlásené nasledujúce nežiaduce reakcie u 1,0% až 5,0% pacientov s glukofágom a častejšie boli hlásené u pacientov s glukofágom ako u placeba: neobvyklá stolica, hypoglykémia, myalgia, bezhlavý, dýchavičnosť, porucha nechtov, vyrážka, zvýšené potenie, porucha chuti, nepohodlie na hrudi, zimnica, chrípkový syndróm, návaly horúčavy, búšenie srdca.
V celosvetových klinických štúdiách bolo v štúdiách kontrolovaných placebom a aktívnym liekom liečených Glucophage XR viac ako 900 pacientov s cukrovkou 2. typu. V placebom kontrolovaných štúdiách bolo 781 pacientom podávané Glucophage XR a 195 pacientov dostalo placebo. Nežiaduce reakcie hlásené u viac ako 5% pacientov s Glucophage XR a ktoré boli častejšie u pacientov s Glucophage XR ako u pacientov liečených placebom, sú uvedené v tabuľke 12.
Tabuľka 12: Najčastejšie nežiaduce reakcie (> 5,0%) v placebom kontrolovaných štúdiách Glucophage XR *
| Nepriaznivá reakcia | Glucophage XR (N = 781) |
placebo (N = 195) |
|---|---|---|
| % pacientov | ||
| * Reakcie, ktoré boli častejšie u pacientov liečených Glucophage XR ako u pacientov liečených placebom. | ||
| Hnačka | 9.6 | 2.6 |
| Nevoľnosť / zvracanie | 6.5 | 1.5 |
Hnačka viedla k prerušeniu liečby zo štúdie u 0,6% pacientov liečených Glucophage XR. Ďalej boli hlásené nasledujúce nežiaduce reakcie u 1,0% až 5,0% pacientov s Glucophage XR a častejšie boli hlásení pri Glucophage XR. ako placebo: bolesť brucha, zápcha, distenzívne brucho, dyspepsia / pálenie záhy, plynatosť, závraty, bolesti hlavy, infekcie horných dýchacích ciest, chuť rušenie.
Pediatrickí pacienti
V klinických štúdiách s Glucophage u pediatrických pacientov s diabetom 2. typu bol profil nežiaducich reakcií podobný profilu pozorovanému u dospelých.
top
predávkovať
Vyskytlo sa predávkovanie hydrochlorid metformínu, vrátane požitia množstiev vyšších ako 50 gramov. Hypoglykémia bola hlásená približne v 10% prípadov, ale nebola preukázaná žiadna príčinná súvislosť s hydrochloridom metformínu. Laktátová acidóza bola hlásená u približne 32% prípadov predávkovania metformínom (pozri časť 4.2) UPOZORNENIE). Metformín je dialyzovateľný s klírensom až 170 ml / min za dobrých hemodynamických podmienok. Preto môže byť hemodialýza užitočná na odstránenie nahromadeného lieku od pacientov, u ktorých existuje podozrenie na predávkovanie metformínom.
top
Dávkovanie a spôsob podávania
Neexistuje žiadny pevný dávkovací režim na zvládnutie hyperglykémie u pacientov s diabetom 2. typu s Glucophage alebo Glucophage XR alebo s akýmikoľvek inými farmakologickými látkami. Dávka Glucophage alebo Glucophage XR musí byť individualizovaná na základe účinnosti a tolerancie, pričom nesmie prekročiť maximálnu odporúčanú dennú dávku. Maximálna odporúčaná denná dávka Glucophage je 2550 mg u dospelých a 2000 mg u pediatrických pacientov (vo veku 10 až 16 rokov); maximálna odporúčaná denná dávka Glucophage XR u dospelých je 2000 mg.
Glucophage by sa mal podávať v rozdelených dávkach spolu s jedlom, zatiaľ čo Glucophage XR by sa mal zvyčajne podávať raz denne spolu s večerným jedlom. Glucophage alebo Glucophage XR sa má začať s nízkou dávkou s postupným zvyšovaním dávky, aby sa znížila gastrointestinálne vedľajšie účinky a umožnenie identifikácie minimálnej dávky požadovanej na primeranú kontrolu glykémie pacienta.
Počas začatia liečby a titrácie dávky (pozri odporúčaný dávkovací rozvrh nižšie) by mala byť plazmatická glukóza nalačno používa sa na stanovenie terapeutickej odpovede na glukofág alebo glukofág XR a na identifikáciu minimálnej účinnej dávky pre pacient. Potom by sa mal glykozylovaný hemoglobín merať v intervaloch približne 3 mesiacov. Terapeutickým cieľom by malo byť zníženie hladín glukózy v plazme nalačno aj glykozylovaného hemoglobínu na normálnu alebo takmer normálnu hladinu s použitím najnižšej účinnej dávky Glucophage alebo Glucophage XR, a to buď pri monoterapii alebo v kombinácii so sulfonylmočovinou alebo inzulín.
Monitorovanie glukózy v krvi a glykozylovaného hemoglobínu tiež umožní detekciu primárneho zlyhania, t. J. Neprimerané zníženie hladiny glukózy v krvi na maximálna odporúčaná dávka lieku a sekundárne zlyhanie, t. j. strata adekvátnej odpovede na zníženie hladiny glukózy v krvi po počiatočnej perióde efektívnosť.
Krátkodobé podávanie Glucophage alebo Glucophage XR môže byť dostatočné v období prechodnej straty kontroly u pacientov zvyčajne dobre kontrolovaných diétou.
Tablety Glucophage XR sa musia prehltnúť celé a nesmú sa rozdrviť ani žuť. Neaktívne zložky Glucophage XR sa občas eliminujú v stolici ako mäkká hydratovaná hmota.
Odporúčaný rozvrh dávkovania
dospelí
Vo všeobecnosti nie sú klinicky významné reakcie pozorované pri dávkach nižších ako 1500 mg za deň. Odporúča sa však nižšia odporúčaná počiatočná dávka a postupne sa zvyšujúca dávka, aby sa minimalizovali gastrointestinálne príznaky.
Zvyčajná počiatočná dávka Glucophage (metformin hydrochloride) je 500 mg dvakrát denne alebo 850 mg raz denne, podávaná s jedlom. Zvýšenie dávky sa má zvyšovať o 500 mg týždenne alebo 850 mg každé 2 týždne až do celkovej dávky 2 000 mg za deň, rozdelených na niekoľko dávok. Pacienti môžu byť titrovaní tiež od 500 mg dvakrát denne do 850 mg dvakrát denne po 2 týždňoch. U pacientov, ktorí vyžadujú ďalšiu kontrolu glykémie, sa môže glukofág podať v maximálnej dennej dávke 2550 mg za deň. Dávky nad 2 000 mg sa môžu lepšie tolerovať, ak sa podávajú 3-krát denne s jedlom.
Zvyčajná počiatočná dávka Glucophage XR (metformíniumchlorid) tablety s predĺženým uvoľňovaním je 500 mg jedenkrát denne pri večernom jedle. Zvýšenie dávky sa má zvyšovať o 500 mg týždenne až do maximálnej výšky 2 000 mg jedenkrát denne pri večernom jedle. Ak sa nedosiahne glykemická kontrola na Glucophage XR 2000 mg jedenkrát denne, má sa zvážiť pokus o Glucophage XR 1 000 mg dvakrát denne. Ak sú potrebné vyššie dávky metformínu, mal by sa Glucophage používať v celkovej dennej dávke do 2550 mg podávanej v rozdelených denných dávkach, ako je opísané vyššie. (Pozri KLINICKÁ FARMAKOLÓGIA: Klinické štúdie.)
V randomizovanej štúdii boli pacienti v súčasnosti liečení Glucophage zmenení na Glucophage XR. Výsledky tejto štúdie naznačujú, že pacienti liečení liekom Glucophage môžu byť bezpečne prepnutí na liek Glucophage XR jedenkrát denne pri rovnakej celkovej dennej dávke až do 2 000 mg jedenkrát denne. Po prechode z Glucophage na Glucophage XR sa má dôkladne monitorovať kontrola glykémie a podľa toho sa musí upraviť dávka (pozri pozri časť 4.8). KLINICKÁ FARMAKOLÓGIA: Klinické štúdie).
pediatrie
Zvyčajná počiatočná dávka Glucophage je 500 mg dvakrát denne podávaná s jedlom. Zvýšenie dávky sa má zvyšovať o 500 mg týždenne až do maximálnej výšky 2 000 mg za deň, rozdelených na niekoľko dávok. Bezpečnosť a účinnosť Glucophage XR u detských pacientov nebola stanovená.
Prevod z inej antidiabetickej liečby
Pri prechode pacientov zo štandardných perorálnych hypoglykemických látok iných ako chlórpropamid na Glucophage alebo Glucophage XR nie je zvyčajne potrebné žiadne prechodné obdobie. Pri presúvaní pacientov z chlórpropamidu je potrebné počas prvých 2 týždňov postupovať opatrne z dôvodu predĺžené zadržiavanie chlórpropamidu v tele, čo vedie k prekrývajúcim sa účinkom liečiva a možnej hypoglykémii.
Sprievodná terapia glukofágom alebo glukofágom XR a perorálna sulfonylmočovina u dospelých pacientov
Ak pacienti neodpovedali na 4 týždne maximálnej dávky monoterapie Glucophage alebo Glucophage XR, malo by sa zvážiť postupné pridávanie perorálna sulfonylmočovina za súčasného pokračovania Glucophage alebo Glucophage XR v maximálnej dávke, aj keď predchádzajúce primárne alebo sekundárne zlyhanie sulfonylmočoviny má došlo. Údaje o klinických a farmakokinetických liekových interakciách sú v súčasnosti dostupné iba pre metformín plus glyburid (glibenklamid).
Pri súbežnej liečbe Glucophage alebo Glucophage XR a sulfonylmočovinou sa môže požadovaná kontrola hladiny glukózy v krvi získať úpravou dávky každého liečiva. V klinickom skúšaní s pacientmi s cukrovkou 2. typu a predchádzajúcim zlyhaním glyburidu boli pacienti, ktorí začali s glukofágom 500 mg a glyburid 20 mg, titrovali na 1 000/20 mg, 1500/20 mg, 2000/20 mg alebo 2500/20 mg Glukofágu a glyburidu, v danom poradí, na dosiahnutie cieľa glykemickej kontroly meranej pomocou FPG, HbA1c a plazmovej glukózovej odpovede (pozri KLINICKÁ FARMAKOLÓGIA: Klinické štúdie). Na dosiahnutie tohto cieľa by sa však mali urobiť pokusy o identifikáciu minimálnej účinnej dávky každého liečiva. Pri súbežnej liečbe Glucophage alebo Glucophage XR a sulfonylmočovinou riziko hypoglykémie spojené s liečbou sulfonylmočovinou pretrváva a môže byť zvýšené. Mali by sa prijať vhodné bezpečnostné opatrenia. (Pozri Príbalový leták príslušnej sulfonylmočoviny.)
Ak pacienti nereagovali uspokojivo na 1 až 3 mesiace súbežnej liečby maximálnou dávkou Glucophage alebo Glucophage XR a maximálna dávka perorálnej sulfonylmočoviny, zvážte terapeutické alternatívy vrátane prechodu na inzulín s alebo bez Glucophage alebo Glucophage XR.
Súbežná liečba glukofágom alebo glukofágom XR a inzulínová terapia u dospelých pacientov
Súčasná dávka inzulínu by mala pokračovať aj po začatí liečby Glucophage alebo Glucophage XR. Liečba glukofágom alebo Glucophage XR sa má u pacientov liečených inzulínom začať dávkou 500 mg jedenkrát denne. U pacientov, ktorí nereagujú primerane, sa má dávka Glucophage alebo Glucophage XR zvýšiť o 500 po približne 1 týždni a potom o 500 mg každý týždeň potom, kým nie je dosiahnutá primeraná glykemická kontrola dosiahnuté. Maximálna odporúčaná denná dávka je 2 500 mg pre Glucophage a 2 000 mg pre Glucophage XR. Pri hladovaní glukózy v plazme sa odporúča dávka inzulínu znížiť o 10% až 25% koncentrácie klesajú na menej ako 120 mg / dl u pacientov, ktorí dostávajú súčasne inzulín a glukofág alebo Glucophage XR. Ďalšia úprava by mala byť individualizovaná na základe odpovede na zníženie hladiny glukózy.
Špecifické populácie pacientov
Glucophage alebo Glucophage XR sa neodporúča používať počas tehotenstva. Glukofág sa neodporúča u pacientov mladších ako 10 rokov. Glucophage XR sa neodporúča u pediatrických pacientov (mladších ako 17 rokov).
Počiatočné a udržiavacie dávkovanie Glucophage alebo Glucophage XR by malo byť u pacientov s pokročilým vekom konzervatívne kvôli možnému zníženiu renálnych funkcií v tejto populácii. Akákoľvek úprava dávkovania by mala byť založená na starostlivom vyhodnotení funkcie obličiek. Vo všeobecnosti by starí, oslabení a podvyživení pacienti nemali byť titrovaní na maximálnu dávku Glucophage alebo Glucophage XR.
Monitorovanie funkcie obličiek je potrebné pri prevencii laktátovej acidózy, najmä u starších pacientov. (Pozri UPOZORNENIE.)
top
Ako dodávané
Tablety Glucophage® (metformin hydrochloride)
| 500 mg | Fľaše po 100 | NDC 0087-6060-05 |
| 500 mg | Fľaše po 500 | NDC 0087-6060-10 |
| 850 mg | Fľaše po 100 | NDC 0087-6070-05 |
| 1000 mg | Fľaše po 100 | NDC 0087-6071-11 |
Glucophage 500 mg tablety sú okrúhle, biele až sivobiele filmom obalené tablety s vyrazením „BMS“ 6060 "okolo obvodu tablety na jednej strane a" 500 "vyrazených cez druhú stranu side.
Tablety Glucophage 850 mg sú okrúhle, biele až takmer biele, filmom obalené tablety s vyrazením „BMS“ 6070 "okolo obvodu tablety na jednej strane a" 850 "vyrazených cez druhú stranu side.
Tablety Glucophage 1000 mg sú biele, oválne, bikonvexné, filmom obalené tablety s vyrazeným „BMS 6071“ na jednej strane a „1 000“ vyrazeným na opačnej strane a na oboch stranách so zvislou čiarou.
Tablety Glucophage® XR (metformin hydrochloride) s predĺženým uvoľňovaním
| 500 mg | Fľaše po 100 | NDC 0087-6063-13 |
| 750 mg | Fľaše po 100 | NDC 0087-6064-13 |
Glucophage XR 500 mg tablety sú biele až sivobiele, bikonvexné tablety v tvare kapsuly, s vyrazeným „BMS 6063“ na jednej strane a „500“ vyrazeným na druhej strane.
Tablety Glucophage XR 750 mg sú bikonvexné tablety v tvare kapsuly s vyrazeným „BMS 6064“ na jednej strane a „750“ na druhej strane. Tablety sú bledočervené a môžu mať škvrnitý vzhľad.
skladovanie
Uchovávajte pri 20 ° -25 ° C (68 ° -77 ° F); odchýlky povolené pri teplote 15 ° - 30 ° C (59 ° - 86 ° F). [Pozri regulovanú izbovú teplotu USP.]
Výdaj v nádobách odolných voči svetlu
Glucophage® je registrovaná ochranná známka spoločnosti Merck SantA S.A.S., spoločník spoločnosti Merck KGaA v Darmstadte v Nemecku. Licencia je poskytnutá spoločnosti Bristol-Myers Squibb.
Distribuovaný:
Spoločnosť Bristol-Myers Squibb
Princeton, NJ 08543 USA
Posledná aktualizácia: 01/2009
Glucohage, metformin hydrochloride, informácie o pacientovi (v jednoduchej angličtine)
Podrobné informácie o príznakoch, príznakoch, príčinách, liečbe cukrovky
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
späť k: Prejdite si všetky lieky na diabetes



