Starlix na liečbu cukrovky
Názov značky: Starlix
Všeobecné meno: nateglinidové tablety
obsah:
popis
Klinická farmakológia
Klinické štúdie
Indikácie a použitie
kontraindikácie
Opatrenia
Nežiaduce reakcie
predávkovania
Dávkovanie a spôsob podávania
Ako dodávané
Starlix, nateglinid, úplné informácie o pacientovi (v jednoduchej angličtine)
popis
Starlix® (nateglinid) je perorálne antidiabetikum používané pri liečbe diabetes mellitus 2. typu [známe tiež ako diabetes mellitus nezávislý od inzulínu (NIDDM) alebo diabetes začínajúci u dospelých]. Starlix, (-) - N - [(trans-4-izopropylcyklohexán) karbonyl] -D-fenylalanín, je štrukturálne nesúvisiaci s perorálnymi sekretagogmi sulfonylmočoviny na inzulín.
Štrukturálny vzorec je uvedený
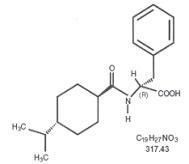
Nateglinid je biely prášok s molekulovou hmotnosťou 317,43. Je voľne rozpustný v metanole, etanole a chloroforme, rozpustný v éteri, ťažko rozpustný v acetonitrile a oktanole a prakticky nerozpustný vo vode. Starlix bikonvexné tablety obsahujú 60 mg alebo 120 mg nateglinidu na perorálne podanie.
Neaktívne zložky: koloidný oxid kremičitý, sodná soľ kroskarmelózy, hydroxypropylmetylcelulóza, oxidy železa (červené alebo žltá), monohydrát laktózy, stearát horečnatý, mikrokryštalická celulóza, polyetylénglykol, povidón, mastenec a titán uhličitý.
top
Klinická farmakológia
Mechanizmus akcie
Nateglinid je derivát aminokyseliny, ktorý znižuje hladinu glukózy v krvi stimuláciou sekrécie inzulínu z pankreasu. Tento účinok závisí od fungovania beta-buniek v pankreatických ostrovčekoch. Nateglinid interaguje s draslíkovým kanálom citlivým na ATP (K + ATP) na pankreatických beta-bunkách. Následná depolarizácia beta bunky otvára vápnikový kanál, čím spôsobuje prítok vápnika a vylučovanie inzulínu. Rozsah uvoľňovania inzulínu je závislý od glukózy a znižuje sa pri nízkych hladinách glukózy. Nateglinid je vysoko tkanivovo selektívny s nízkou afinitou pre srdcový a kostrový sval.
farmakokinetika
vstrebávanie
Po perorálnom podaní bezprostredne pred jedlom sa nateglinid rýchlo absorbuje, pričom priemerné maximálne plazmatické koncentrácie liečiva (Cmax) sa zvyčajne vyskytujú do 1 hodiny (Tmax) po podaní. Pri podávaní pacientom s diabetom 2. typu v dávkovacom rozmedzí 60 mg až 240 mg trikrát denne počas jedného nateglinid preukázal lineárnu farmakokinetiku AUC (plocha pod krivkou závislosti času / plazmy) aj za týždeň Cmax. Zistilo sa tiež, že Tmax je v tejto populácii pacientov nezávislá od dávky. Absolútna biologická dostupnosť sa odhaduje na približne 73%. Pri podávaní s jedlom alebo po jedle zostáva rozsah absorpcie nateglinidu (AUC) nedotknutý. Existuje však oneskorenie rýchlosti absorpcie charakterizované poklesom Cmax a oneskorením času do dosiahnutia maximálnej plazmatickej koncentrácie (Tmax). Plazmové profily sa vyznačujú niekoľkými vrcholmi plazmatickej koncentrácie, keď sa nateglinid podáva nalačno. Tento účinok sa zníži, keď sa nateglinid užije pred jedlom.
distribúcia
Na základe údajov po intravenóznom (IV) podaní nateglinidu sa distribučný objem nateglinidu v rovnovážnom stave odhaduje na približne 10 litrov u zdravých jedincov. Nateglinid sa vo veľkej miere (98%) viaže na sérové proteíny, predovšetkým na sérový albumín, av menšej miere na 1 ± 1 kyslý glykoproteín. Rozsah väzby na sérové proteíny je nezávislý od koncentrácie liečiva v testovacom rozmedzí 0,1 až 10 ug / ml.
metabolizmus
Nateglinid je pred elimináciou metabolizovaný oxidázovým systémom so zmiešanou funkciou. Hlavné cesty metabolizmu sú hydroxylácia nasledovaná konjugáciou glukuronidu. Hlavné metabolity sú menej účinné antidiabetické látky ako nateglinid. Izoprénový minoritný metabolit má účinnosť podobnú ako pôvodná zlúčenina nateglinid.
Údaje in vitro ukazujú, že nateglinid je prevažne metabolizovaný izoenzýmami cytochrómu P450 CYP2C9 (70%) a CYP3A4 (30%).
vylučovanie
Nateglinid a jeho metabolity sa po perorálnom podaní rýchlo a úplne eliminujú. Do 6 hodín po podaní sa približne 75% podaného 14C-nateglinidu vylúčilo močom. Osemdesiattri percent 14C-nateglinidu sa vylúčilo močom a ďalších 10% sa vylúčilo stolicou. Približne 16% 14C-nateglinidu sa vylúčilo močom ako materská zlúčenina. Vo všetkých štúdiách so zdravými dobrovoľníkmi a pacientmi s cukrovkou 2. typu plazmatické koncentrácie nateglinidu rýchlo klesali s priemerným eliminačným polčasom približne 1,5 hodiny. V súlade s týmto krátkym eliminačným polčasom nedošlo k zjavnej akumulácii nateglinidu pri viacnásobnom dávkovaní až do 240 mg trikrát denne počas 7 dní.
Liekové interakcie
Štúdie metabolizmu liekov in vitro naznačujú, že Starlix je prevažne metabolizovaný izoenzýmom CYP2C9 cytochrómu P450 (70%) av menšej miere CYP3A4 (30%). Starlix je potenciálnym inhibítorom izoenzýmu CYP2C9 in vivo, čo naznačuje jeho schopnosť inhibovať metabolizmus tolbutamidu in vitro. In vitro inhibícia metabolických reakcií CYP3A4 sa nezistila.
Glyburid: V randomizovanej krížovej štúdii s opakovanými dávkami boli pacienti s diabetom 2. typu podávané 120 mg Starlixu trikrát denne pred jedlom počas 1 dňa v kombinácii s glyburidom 10 mg denne. Vo farmakokinetike ani jednej z týchto látok nedošlo k žiadnym klinicky relevantným zmenám.
Metformín: Keď sa Starlix 120 mg trikrát denne pred jedlom podáva v kombinácii s 500 mg metformínu tri dvakrát denne u pacientov s diabetom 2. typu nedošlo ani k klinicky relevantným zmenám vo farmakokinetike agenta.
Digoxín: Keď bol Starlix 120 mg pred jedlom podaný v kombinácii s jednorazovou dávkou 1 mg digoxínu zdravým dobrovoľníkom, nedošlo ani k klinicky relevantným zmenám vo farmakokinetike agenta.
Warfarín: Keď boli zdravým jedincom podávané Starlix 120 mg trikrát denne pred jedlom počas štyroch dní v roku 2006 v kombinácii s jednou dávkou warfarínu 30 mg v 2. deň, nedošlo k žiadnym zmenám vo farmakokinetike agenta. Protrombínový čas nebol ovplyvnený.
Diklofenak: Podávanie ranných a obedných dávok Starlixu 120 mg v kombinácii s jedinou dávkou 75 mg dávka diklofenaku u zdravých dobrovoľníkov neviedla k žiadnym významným zmenám vo farmakokinetike agenta.
Osobitné skupiny obyvateľstva
Geriatrické: Vek neovplyvnil farmakokinetické vlastnosti nateglinidu. Preto nie je potrebná úprava dávkovania u starších pacientov.
Pohlavie: Nepozorovali sa žiadne klinicky významné rozdiely vo farmakokinetike nateglinidu medzi mužmi a ženami. Preto nie je potrebná žiadna úprava dávky na základe pohlavia.
Rasa: Výsledky populačnej farmakokinetickej analýzy zahŕňajúcej subjekty belošského, čierneho a iného etnického pôvodu naznačujú, že rasa má malý vplyv na farmakokinetiku nateglinidu.
Poškodenie obličiek: V porovnaní so zdravými pacientmi s diabetes mellitus 2. typu a stredne ťažká až ťažká renálna insuficiencia (CrCl 15-50 ml / min), ktorá nie je na dialýze, vykazovala podobné zjavné účinky klírens, AUC a Cmax. Pacienti s diabetom 2. typu a zlyhaním obličiek na dialýze vykazovali zníženú celkovú expozíciu lieku. U hemodialyzovaných pacientov však došlo aj k zníženiu väzby na plazmatické bielkoviny v porovnaní so zdravými dobrovoľníkmi.
Poškodenie funkcie pečene: Vrchol a celková expozícia nateglinidu u nediabetických jedincov s miernou hepatálnou insuficienciou sa v porovnaní so zdravými jedincami zvýšila o 30%. Starlix® (nateglinid) sa má používať s opatrnosťou u pacientov s chronickým ochorením pečene. (Pozri OPATRENIA, Porucha funkcie pečene.)
farmakodynamika
Starlix sa rýchlo vstrebáva a stimuluje sekréciu inzulínu pankreasu do 20 minút po perorálnom podaní. Ak sa Starlix podáva trikrát denne pred jedlom, dôjde k prudkému zvýšeniu hladiny inzulínu v plazme, s maximálnymi hladinami približne 1 hodinu po podaní a poklesom na základnú úroveň o 4 hodiny po podaní.
V dvojito zaslepenej, kontrolovanej klinickej štúdii, v ktorej bol Starlix podaný pred každým z troch po jedle bola hladina glukózy v plazme stanovená počas 12 hodín denne po 7 týždňoch liečbu. Starlix sa podával 10 minút pred jedlom. Jedlá boli založené na štandardných ponukách udržiavania telesnej hmotnosti s celkovým obsahom kalórií na základe výšky každého jedinca. Starlix spôsobil štatisticky významné zníženie glykémie nalačno a postprandiálnej glykémie v porovnaní s placebom.
top
Klinické štúdie
Celkom 3 566 pacientov bolo randomizovaných do deviatich dvojito zaslepených, placebom alebo kontrolovaných štúdií trvajúcich 8 až 24 týždňov s cieľom vyhodnotiť bezpečnosť a účinnosť Starlixu (nateglinid). 3 513 pacientov malo hodnoty účinnosti nad východiskovou hodnotou. V týchto štúdiách bol Starlix podávaný až 30 minút pred každým z troch hlavných jedál denne.
Monoterapia Starlix® v porovnaní s placebom
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej, 24-týždňovej štúdii, pacienti s diabetom 2. typu s HbA1C 6,8% pri diéte samotnej boli randomizované, aby dostávali buď Starlix (60 mg alebo 120 mg trikrát denne pred jedlom) alebo placebo. Východisková hodnota HbA1C sa pohybovala od 7,9% do 8,1% a 77,8% pacientov predtým nebolo liečených perorálnou antidiabetickou liečbou. Od pacientov, ktorí boli predtým liečení antidiabetikami, sa vyžadovalo, aby prerušili túto liečbu najmenej 2 mesiace pred randomizáciou. Pridanie Starlixu pred jedlom viedlo k štatisticky významnému zníženiu priemernej HbA1C a priemernej plazmatickej glukózy nalačno (FPG) v porovnaní s placebom (pozri tabuľku 1). Zníženie HbA1C a FPG bolo podobné u pacientov, ktorí predtým neužívali antidiabetické lieky, a u tých, ktorým boli predtým vystavené.
V tejto štúdii bola u pacienta liečeného Starlixom 120 mg trikrát denne pred jedlom hlásená jedna epizóda závažnej hypoglykémie (plazmatická glukóza <36 mg / dl). U žiadneho pacienta nedošlo k hypoglykémii, ktorá si vyžadovala pomoc tretej strany. Pacienti liečení Starlixom mali štatisticky významné priemerné zvýšenie hmotnosti v porovnaní s placebom (pozri tabuľku 1).
V ďalšej randomizovanej, dvojito zaslepenej, 24-týždňovej, aktívnej a placebom kontrolovanej štúdii boli pacienti s diabetom 2. typu randomizovaní na liečbu Starlixom (120 mg trikrát). denne pred jedlom), 500 mg metformínu (trikrát denne), kombinácie Starlixu 120 mg (trikrát denne pred jedlom) a 500 mg metformínu (trikrát denne) alebo placebo. Východisková hodnota HbA1C sa pohybovala od 8,3% do 8,4%. Päťdesiat sedem percent pacientov predtým nebolo liečených perorálnou antidiabetickou liečbou. Monoterapia Starlixom viedla k významnému zníženiu priemerného HbA1C a priemerného FPG v porovnaní s placebom, ktoré boli podobné výsledkom štúdie uvedenej vyššie (pozri tabuľku 2).
Tabuľka 1: Výsledky sledovaného parametra pre 24-týždňovú štúdiu s pevnou dávkou monoterapie Starlix®
|
placebo |
Starlix® 60 mg tri krát denná pred jedlom |
Starlix® 120 mg tri krát denná pred jedlom |
|
| HbA1C (%) | N = 168 | N = 167 | N = 168 |
| Základná hodnota (stredná hodnota) | 8.0 | 7.9 | 8.1 |
| Zmena oproti základnej hodnote (priemer) | +0.2 | -0.3 | -0.5 |
| Rozdiel oproti placebu (priemer) | -0.5 | -0.7 | |
| FPG (mg / dl) | N = 172 | N = 171 | N = 169 |
| Základná hodnota (stredná hodnota) | 167.9 | 161.0 | 166.5 |
| Zmena oproti základnej hodnote (priemer) | +9.1 | +0.4 | -4.5 |
| Rozdiel oproti placebu (priemer) | -8.7 | -13.6 | |
| Hmotnosť (kg) | N = 170 | N = 169 | N = 166 |
| Základná hodnota (stredná hodnota) | 85.8 | 83.7 | 86.3 |
| Zmena oproti základnej hodnote (priemer) | -0.7 | +0.3 | +0.9 |
| Rozdiel oproti placebu (priemer) | +1.0 | +1.6 |
p-hodnota 0,004
Monoterapia Starlix® v porovnaní s inými orálnymi antidiabetikami
glyburidu
V 24-týždňovej, dvojito zaslepenej, aktívne kontrolovanej štúdii, pacienti s diabetom 2. typu, ktorí boli na sulfonylmočovine po dobu 3 mesiacov a ktorí s východiskovou hodnotou HbA1C ¥ ‰ 6,5% bolo randomizovaných na príjem Starlixu (60 mg alebo 120 mg trikrát denne pred jedlom) alebo glyburidu 10 mg jedenkrát denne. Pacienti randomizovaní do skupiny Starlix mali v porovnaní s pacientmi randomizovanými na glyburid signifikantne zvýšené priemerné HbA1C a priemerné FPG v koncovom bode.
metformín
V ďalšej randomizovanej, dvojito zaslepenej, 24-týždňovej, aktívnej a placebom kontrolovanej štúdii boli pacienti s diabetom 2. typu randomizovaní na liečbu Starlixom (120 mg trikrát). denne pred jedlom), 500 mg metformínu (trikrát denne), kombinácie Starlixu 120 mg (trikrát denne pred jedlom) a 500 mg metformínu (trikrát denne) alebo placebo. Východisková hodnota HbA1C sa pohybovala od 8,3% do 8,4%. Päťdesiat sedem percent pacientov predtým nebolo liečených perorálnou antidiabetickou liečbou. Zníženie priemerného HbA1C a priemerného FPG v koncovom bode pri monoterapii metformínom bolo významne väčšie ako zníženie týchto premenných pri monoterapii Starlixom (pozri tabuľku 2). Vo vzťahu k placebu bola monoterapia Starlixom spojená s významným zvýšením priemernej hmotnosti, zatiaľ čo monoterapia metformínom bola spojená s významným znížením priemernej hmotnosti. Medzi podskupinou pacientov, ktorí predtým neužívali antidiabetickú liečbu, bolo zníženie priemernej HbA1C a priemernej FPG pre monoterapiu Starlixom podobné ako pri monoterapii metformínom (pozri tabuľku 2). Medzi podskupinou pacientov predtým liečených inými antidiabetikami, predovšetkým glyburidom, HbA1C v Starlixe monoterapia sa mierne zvýšila oproti východiskovým hodnotám, zatiaľ čo HbA1C sa znížil v monoterapii metformínmi (pozri tabuľku 1) 2).
Kombinovaná terapia Starlix®
metformín
V ďalšej randomizovanej, dvojito zaslepenej, 24-týždňovej, aktívnej a placebom kontrolovanej štúdii boli pacienti s diabetom 2. typu randomizovaní na liečbu Starlixom (120 mg trikrát). denne pred jedlom), 500 mg metformínu (trikrát denne), kombinácie Starlixu 120 mg (trikrát denne pred jedlom) a 500 mg metformínu (trikrát denne) alebo placebo. Východisková hodnota HbA1C sa pohybovala od 8,3% do 8,4%. Päťdesiat sedem percent pacientov predtým nebolo liečených perorálnou antidiabetickou liečbou. Od pacientov, ktorí boli predtým liečení antidiabetikami, sa vyžadovalo prerušenie liečby najmenej 2 mesiace pred randomizáciou. Kombinácia Starlixu a metformínu viedla k štatisticky významne väčšiemu zníženiu HbA1C a FPG v porovnaní s monoterapiou Starlixom alebo metformínom (pozri tabuľku 2). Starlix, samotný alebo v kombinácii s metformínom, významne znížil prandiálne zvýšenie glukózy z pred jedlom na 2 hodiny po jedle v porovnaní s placebom a samotným metformínom.
V tejto štúdii bola u pacienta, ktorý dostával liečbu, hlásená jedna epizóda závažnej hypoglykémie (plazmatická glukóza - 36 mg / dl). Kombinácia Starlixu a metformínu a štyroch epizód závažnej hypoglykémie boli hlásené u jedného pacienta v metformíne liečebné rameno. Žiadny pacient nezažil epizódu hypoglykémie, ktorá si vyžadovala pomoc tretej strany. V porovnaní s placebom bola monoterapia Starlixom spojená so štatisticky významným nárastom hmotnosti, zatiaľ čo pri kombinovanej liečbe Starlixom a metformínom sa nepozorovala žiadna významná zmena hmotnosti (pozri tabuľku 2).
V ďalšej 24-týždňovej, dvojito zaslepenej, placebom kontrolovanej štúdii boli pacienti s diabetes mellitus 2. typu s HbA1C ‰ 8 6,8% po liečbe metformínom (¥ ¥ 1500 mg denne počas â ¥ 1 mesiaca) prvýkrát do štvortýždňového zábehu monoterapie metformínom (2 000 mg denne) a potom sa randomizovalo, aby sa okrem metformínu dostávalo Starlix (60 mg alebo 120 mg trikrát denne pred jedlom) alebo placebo. Kombinovaná liečba Starlixom a metformínom bola spojená so štatisticky významne väčším znížením HbA1C v porovnaní s monoterapiou metformínom (-0,4% a -0,6% pre Starlix 60 mg a Starlix 120 mg plus metformín, v tomto poradí).
Tabuľka 2: Výsledky sledovaného parametra pre 24-týždňovú štúdiu Starlixu®monoterapie a kombinácie s metformínom
|
placebo |
Starlix® 120 mg tri krát denne predtým jedlá |
metformín 500 mg tri krát denná |
Starlix® 120 mg pred jedlo plus metformín * |
|
| HbA1C (%) | ||||
| všetko | N = 160 | N = 171 | N = 172 | N = 162 |
| Základná hodnota (stredná hodnota) | 8.3 | 8.3 | 8.4 | 8.4 |
| Zmena oproti základnej hodnote (priemer) | +0.4 | -0.4 bc | -0.8 C | -1.5 |
| Rozdiel oproti placebu | -0.8 | -1.2 | -1.9 | |
| Nan-päť | N = 98 | N = 99 | N = 98 | N = 81 |
| Základná hodnota (stredná hodnota) | 8.2 | 8.1 | 8.3 | 8.2 |
| Zmena oproti základnej hodnote (priemer) | +0.3 | -0.7 C | -0.8 C | -1.6 |
| Rozdiel oproti placebu | -1.0 | -1.1 | -1.9 | |
| Non-Nan-päť | N = 62 | N = 72 | N = 74 | N = 81 |
| Základná hodnota (stredná hodnota) | 8.3 | 8.5 | 8.7 | 8.7 |
| Zmena oproti základnej hodnote (priemer) | +0.6 | +0.004 bc | -0.8 C | -1.4 |
| Rozdiel oproti placebu | -0.6 | -1.4 | -2.0 | |
| FPG (mg / dl) | ||||
| všetko | N = 166 | N = 173 | N = 174 | N = 167 |
| Základná hodnota (stredná hodnota) | 194.0 | 196.5 | 196.0 | 197.7 |
| Zmena oproti základnej hodnote (priemer) | +8.0 | -13.1 bc | -30.0 C | -44.9 |
| Rozdiel oproti placebu | -21.1 | -38.0 | -52.9 | |
| Hmotnosť (kg) | ||||
| všetko | N = 160 | N = 169 | N = 169 | N = 160 |
| Základná hodnota (stredná hodnota) | 85.0 | 85.0 | 86.0 | 87.4 |
| Zmena oproti základnej hodnote (priemer) | -0.4 | +0.9 bc | -0.1 | +0.2 |
| Rozdiel oproti placebu | +1.3 | +0.3 | +0.6 |
p-hodnota ¤ 0,05 vs. vs. placebo
b p-hodnota 0,03 vs metformín
c p-hodnota ¤ 0,05 vs. vs. kombinácie
* Metformín sa podával trikrát denne
rosiglitazón
U pacientov s typom 2 sa uskutočnila 24-týždňová dvojito zaslepená multicentrická, placebom kontrolovaná štúdia po terapeutickej odpovedi na monoterapiu rosiglitazónom 8 mg nie je diabetes dostatočne kontrolovaný denne. Pridanie Starlixu (120 mg trikrát denne s jedlom) bolo spojené so štatisticky významne väčším znížením HbA1C v porovnaní s monoterapiou rosiglitazónom. Rozdiel bol -0,77% po 24 týždňoch. Priemerná zmena hmotnosti oproti východiskovým hodnotám bola asi +3 kg u pacientov liečených Starlixom plus rosiglitazónom oproti asi +1 kg u pacientov liečených placebom plus rosiglitazónom.
glyburidu
V 12-týždňovej štúdii u pacientov s cukrovkou 2. typu nedostatočne kontrolovaných glyburidom 10 mg jedenkrát denne, pridanie Starlixu (60 mg alebo 120 mg trikrát denne pred jedlom) neprinieslo žiadne ďalšie výhoda.
top
Indikácie a použitie
Starlix® (nateglinid) je indikovaný ako doplnok výživy a cvičenia na zlepšenie kontroly glykémie u dospelých s diabetes mellitus 2. typu.
top
kontraindikácie
Starlix® (nateglinid) je kontraindikovaný u pacientov s:
1. Známa precitlivenosť na liečivo alebo jeho neaktívne zložky.
2. Diabetes 1. typu.
3. Diabetická ketoacidóza. Tento stav sa má liečiť inzulínom.
top
Opatrenia
Makrovaskulárne výsledky: Neuskutočnili sa žiadne klinické štúdie, ktoré by preukázali presvedčivý dôkaz o znížení makrovaskulárneho rizika pri použití Starlixu alebo iného antidiabetika.
Hypoglykémia: Všetky lieky na perorálne zníženie hladiny glukózy v krvi, ktoré sa absorbujú systémovo, sú schopné vyvolať hypoglykémiu. Frekvencia hypoglykémie súvisí so závažnosťou cukrovky, úrovňou glykemickej kontroly a ďalšími charakteristikami pacienta. Geriatrickí pacienti, podvyživení pacienti a pacienti s insuficienciou nadobličiek alebo hypofýzy alebo so závažnou poruchou funkcie obličiek sú viac náchylní na účinok glukózy na znižovanie glukózy pri tejto liečbe. Riziko hypoglykémie sa môže zvýšiť namáhavým fyzickým cvičením, požitím alkoholu, nedostatočný kalorický príjem na akútnom alebo chronickom základe alebo kombinácia s inými perorálnymi antidiabetikami činidlá. U pacientov s autonómnou neuropatiou a / alebo u tých, ktorí používajú beta-blokátory, môže byť ťažké rozpoznať hypoglykémiu. Starlix® (nateglinid) sa má podávať pred jedlom, aby sa znížilo riziko hypoglykémie. Pacienti, ktorí vynechávajú jedlo, by tiež mali preskočiť plánovanú dávku Starlixu, aby sa znížilo riziko hypoglykémie.
Poškodenie funkcie pečene: Starlix sa má používať opatrne u pacientov so stredne ťažkým až ťažkým ochorením pečene, pretože títo pacienti sa neskúmali.
Strata glykemickej kontroly
Pri horúčke, infekcii, traume alebo chirurgickom zákroku sa môže vyskytnúť prechodná strata glykemickej kontroly. V takýchto časoch môže byť namiesto liečby Starlixom potrebná inzulínová terapia. Môže dôjsť k sekundárnemu zlyhaniu alebo zníženej účinnosti Starlixu po určitú dobu.
Informácie pre pacientov
Pacienti majú byť informovaní o potenciálnych rizikách a prínosoch Starlixu ao alternatívnych spôsoboch liečby. Je potrebné vysvetliť riziká a riadenie hypoglykémie. Pacienti majú byť poučení, aby užili Starlix 1 až 30 minút pred požitím jedla, ale ak vynechali jedlo, mali by vynechať svoju plánovanú dávku, aby sa znížilo riziko hypoglykémie. Liekové interakcie by sa mali prediskutovať s pacientmi. Pacienti majú byť informovaní o možných liekových interakciách so Starlixom.
Laboratórne testy
Reakcia na liečbu by sa mala pravidelne hodnotiť pomocou hodnôt glukózy a hladín HbA1C.
Liekové interakcie
Nateglinid sa vysoko viaže na plazmatické bielkoviny (98%), najmä na albumín. Štúdie vytesňovania in vitro s liečivami s vysokou väzbou na bielkoviny, ako sú furosemid, propranolol, kaptopril, nikardipín, pravastatín, glyburid, warfarín, fenytoín, kyselina acetylsalicylová, tolbutamid a metformín nevykazovali žiaden vplyv na rozsah nateglinidového proteínu záväzné. Podobne nateglinid nemal in vitro žiadny vplyv na väzbu propranololu, glyburidu, nikardipínu, warfarínu, fenytoínu, kyseliny acetylsalicylovej a tolbutamidu na sérovú bielkovinu. V klinickom prostredí je však potrebné obozretné vyhodnotenie jednotlivých prípadov.
Niektoré lieky vrátane nesteroidných protizápalových liekov (NSAID), salicylátov, inhibítorov monoaminooxidázy a neselektívne beta-adrenergné blokátory môžu zosilňovať hypoglykemické pôsobenie Starlixu a iných perorálnych antidiabetík drogy.
Niektoré lieky vrátane tiazidov, kortikosteroidov, štítnej žľazy a sympatomimetík môžu znížiť hypoglykemický účinok Starlixu a iných perorálnych antidiabetík.
Ak sa tieto lieky podávajú pacientom, ktorí dostávajú Starlix, alebo ich z nich vysadia, pacient by sa mal pozorne sledovať kvôli zmenám v glykemickej kontrole.
Liekové a potravinové interakcie
Farmakokinetika nateglinidu nebola ovplyvnená zložením jedla (s vysokým obsahom bielkovín, tukov alebo uhľohydrátov). Maximálne plazmatické hladiny sa však významne znížili, keď sa Starlix podával 10 minút pred tekutým jedlom. Starlix nemal žiadny vplyv na vyprázdňovanie žalúdka u zdravých jedincov, ako bolo stanovené testom na acetaminofény.
Karcinogenéza / mutagenéza / zhoršenie plodnosti
Karcinogenita: Dvojročná štúdia karcinogenity na potkanoch Sprague-Dawley bola vykonaná s perorálnymi dávkami nateglinidu až do 900 mg / kg / deň, čo spôsobilo expozíciu AUC. u samcov a samíc potkanov približne 30-krát a 40-násobne väčšia ako terapeutická expozícia u ľudí s odporúčanou dávkou Starlixu 120 mg, trikrát denne pred jedlá. U myší B6C3F1 sa uskutočnila dvojročná štúdia karcinogenity s perorálnymi dávkami nateglinidu až do 400 mg / kg / deň, čo spôsobilo expozíciu AUC u mužov. a samice myší približne 10 a 30-krát viac ako terapeutická expozícia u ľudí s odporúčanou dávkou Starlix 120 mg, trikrát denne pred jedlom. U potkanov ani myší sa nezistil žiadny dôkaz tumorigénnej odpovede.
Mutagenéza: Nateglinid nebol genotoxický v in vitro Amesovom teste, teste na myšacom lymfóme, chromozómovej aberácii v pľúcnych bunkách čínskeho škrečka alebo v in vivo teste na myších mikronukleoch.
Poškodenie plodnosti: Plodnosť nebola ovplyvnená podávaním nateglinidu potkanom v dávkach do 600 mg / kg. (približne 16-násobok terapeutickej expozície u ľudí s odporúčanou dávkou Starlixu 120 mg trikrát denne predtým) jedlá).
tehotenstvo
Tehotenstvo Kategória C
Nateglinid nebol teratogénny u potkanov v dávkach do 1 000 mg / kg (približne 60-násobok terapeutickej expozície u ľudí pri odporúčanej dávke Starlix 120 mg, trikrát denne pred jedlom). U králikov bol embryonálny vývoj nepriaznivo ovplyvnený a výskyt agenózy žlčníka alebo malého žlčníka sa zvýšil pri dávka 500 mg / kg (približne 40-násobok terapeutickej expozície u ľudí pri odporúčanej dávke Starlix 120 mg, trikrát denne pred jedlá). Neexistujú dostatočné a dobre kontrolované štúdie u tehotných žien. Starlix sa nemá používať počas tehotenstva.
Práca a dodávka
Účinok Starlixu na pôrod a pôrod u ľudí nie je známy.
Dojčiace matky
Štúdie na laktujúcich potkanoch ukázali, že nateglinid sa vylučuje do mlieka; pomer AUC0-48h v mlieku k plazme bol približne 1: 4. Počas peri- a postnatálneho obdobia boli telesné hmotnosti nižšie u potomkov potkanov, ktorým bol podaný nateglinid v dávke 1 000 mg / kg. (približne 60-násobok terapeutickej expozície u človeka s odporúčanou dávkou Starlixu 120 mg, trikrát denne predtým) jedlá). Nie je známe, či sa Starlix vylučuje do materského mlieka. Pretože veľa liekov sa vylučuje do materského mlieka, Starlix sa nemá podávať dojčiacej žene.
Pediatrické použitie
Bezpečnosť a účinnosť Starlixu u pediatrických pacientov nebola stanovená.
Geriatrické použitie
Medzi pacientmi vo veku 65 rokov a viac a pacientmi mladšími ako 65 rokov neboli pozorované žiadne rozdiely v bezpečnosti alebo účinnosti Starlixu. Nie je však možné vylúčiť vyššiu citlivosť niektorých starších jedincov na liečbu Starlixom.
top
Nežiaduce reakcie
V klinických štúdiách bolo Starlixom (nateglinid) liečených približne 2 600 pacientov s diabetom 2. typu. Z toho približne 1 335 pacientov bolo liečených 6 mesiacov alebo dlhšie a približne 190 pacientov počas jedného roka alebo dlhšie.
Hypoglykémia bola relatívne neobvyklá vo všetkých liečebných ramenách klinických skúšaní. Iba 0,3% pacientov Starlixu ukončilo liečbu kvôli hypoglykémii. Gastrointestinálne príznaky, najmä hnačka a nauzea, neboli častejšie u pacientov používajúcich kombináciu Starlixu a metformínu ako u pacientov, ktorí dostávali metformín samotný. Podobne periférny edém nebol častejší u pacientov používajúcich kombináciu Starlixu a rosiglitazónu ako u pacientov, ktorí dostávali samotný rosiglitazón. V nasledujúcej tabuľke sú uvedené udalosti, ktoré sa vyskytli častejšie u pacientov s Starlixom ako u pacientov s placebom v kontrolovaných klinických skúšaniach.
Časté nežiaduce účinky (â ‰ ¥ 2% u pacientov Starlix®) v štúdiách Monoterapie Starlix® (% pacientov)
| placebo | Starlix® | |
| N = 458 | N = 1441 | |
| Preferovaný termín | ||
| Infekcia horných dýchacích ciest | 8.1 | 10.5 |
| Bolesť chrbta | 3.7 | 4.0 |
| Príznaky chrípky | 2.6 | 3.6 |
| závrat | 2.2 | 3.6 |
| artropatie | 2.2 | 3.3 |
| Hnačka | 3.1 | 3.2 |
| Úrazová trauma | 1.7 | 2.9 |
| bronchitída | 2.6 | 2.7 |
| kašeľ | 2.2 | 2.4 |
| hypoglykémie | 0.4 | 2.4 |
Počas postmarketingových skúseností boli hlásené zriedkavé prípady hypersenzitívnych reakcií, ako sú vyrážky, svrbenie a žihľavka. Podobne boli hlásené prípady žltačky, cholestatickej hepatitídy a zvýšených pečeňových enzýmov.
Laboratórne abnormality
Kyselina močová: U pacientov liečených samotným Starlixom, Starlixom v kombinácii s metformínom, samotným metformínom a samotným glyburidom sa zvýšili priemerné hladiny kyseliny močovej. Príslušné rozdiely oproti placebu boli 0,29 mg / dl, 0,45 mg / dl, 0,28 mg / dl a 0,19 mg / dl. Klinický význam týchto nálezov nie je známy.
top
predávkovania
V klinickej štúdii u pacientov s cukrovkou 2. typu bol Starlix® (nateglinid) podaný v roku 2006 zvyšujúce sa dávky až na 720 mg denne po dobu 7 dní a nevyskytli sa žiadne klinicky významné nežiaduce účinky hlásené. V klinických štúdiách sa nevyskytli žiadne prípady predávkovania Starlixom. Predávkovanie však môže mať za následok prehnané zníženie hladiny glukózy s rozvojom hypoglykemických príznakov. Hypoglykemické príznaky bez straty vedomia alebo neurologických nálezov sa majú liečiť perorálnou glukózou a úpravou dávkovania a / alebo stravovacích návykov. Závažné hypoglykemické reakcie s kómou, záchvatmi alebo inými neurologickými príznakmi sa majú liečiť intravenóznou glukózou. Pretože nateglinid sa vysoko viaže na bielkoviny, dialýza nie je účinným prostriedkom na jeho odstránenie z krvi.
top
Dávkovanie a spôsob podávania
Starlix® (nateglinid) sa má užiť 1 až 30 minút pred jedlom.
Monoterapia a kombinácia s metformínom alebo tiazolidíndiónom
Odporúčaná počiatočná a udržiavacia dávka Starlixu, samotného alebo v kombinácii s metformínom alebo tiazolidíndiónom, je 120 mg trikrát denne pred jedlom.
60-mg dávka Starlixu, buď samotná alebo v kombinácii s metformínom alebo tiazolidíndiónom, sa môže použiť u pacientov, ktorí sú pri zahájení liečby blízko cieľa HbA1C.
Dávkovanie u geriatrických pacientov
Zvyčajne nie sú potrebné žiadne špeciálne úpravy dávky. Nie je však možné vylúčiť väčšiu citlivosť niektorých jedincov na liečbu Starlixom.
Dávkovanie pri poškodení obličiek a pečene
U pacientov s miernou až ťažkou renálnou insuficienciou alebo u pacientov s miernou hepatálnou insuficienciou nie je potrebná úprava dávkovania. Dávkovanie pacientov so stredne ťažkou až ťažkou hepatálnou dysfunkciou sa neskúmalo. Preto sa Starlix má používať opatrne u pacientov so stredne ťažkým až ťažkým ochorením pečene (pozri BEZPEČNOSTNÉ OPATRENIA, poškodenie pečene).
top
Ako dodávané
Starlix® (nateglinid) tablety
60 mg
Ružové, okrúhle, skosené okrajové tablety s vyrazeným označením „Starlix“ na jednej strane a „60“ na druhej strane.
Fľaše po 100... NDC 0078-0351-05
120 mg
Žltá oválna tableta s označením „Starlix“ na jednej strane a „120“ na druhej strane.
Fľaše po 100... NDC 0078-0352-05
skladovanie
Uchovávajte pri teplote 25 ° C (77 ° F); dovolené odchýlky pri teplote 15 ° C - 30 ° C (59 ° F - 86 ° F).
Dávkovanie v tesnom obale, USP.
T2008-01
REV: Júl 2008
Výrobca:
Novartis Pharma Stein AG
Stein, Švajčiarsko
Distribuovaný:
Novartis Pharmaceuticals Corporation
East Hanover, New Jersey 07936
© Novartis
Posledná aktualizácia 07/2008
Starlix, nateglinid, úplné informácie o pacientovi (v jednoduchej angličtine)
Podrobné informácie o príznakoch, príznakoch, príčinách, liečbe cukrovky
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
späť k: Prejdite si všetky lieky na diabetes



