Exubera na liečbu cukrovky
Názov značky: Exubera
Generický názov: ľudský inzulín
Dávkovacia forma: inhalačný prášok
obsah:
popis
Klinická farmakológia
Klinické štúdie
Indikácie a použitie
kontraindikácie
varovanie
Opatrenia
Liekové interakcie
Nežiaduce reakcie
predávkovania
Dávkovanie a spôsob podávania
Ako dodávané
Exubera, ľudský inzulín [pôvod rDNA] Informácie o pacientovi (v jednoduchej angličtine)
popis
Exubera® pozostáva z blistrov obsahujúcich inhalačný prášok ľudského inzulínu, ktoré sa podávajú pomocou Exubery® Inhalátor. Blistre Exubera obsahujú ľudský inzulín produkovaný technológiou rekombinantnej DNA využívajúci nepatogénny laboratórny kmeň Escherichia coli (K12). Chemicky má ľudský inzulín empirický vzorec C257H383N65O77S6 a molekulová hmotnosť 5808. Ľudský inzulín má nasledujúcu primárnu aminokyselinovú sekvenciu:
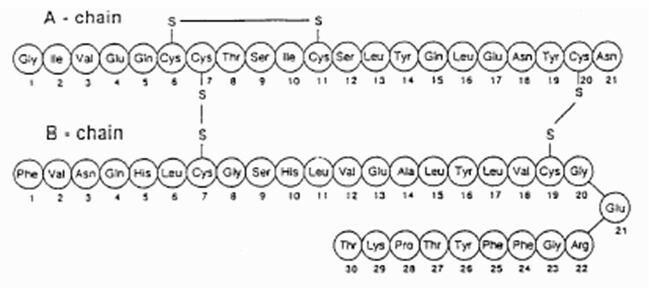
Exubera (ľudský inzulín [pôvod rDNA]) Inhalačný prášok je biely až takmer biely prášok v blistri s jednotkovou dávkou (náplň, pozri tabuľku 1). Každý blistr Exubery s jednotkovou dávkou obsahuje 1 mg alebo 3 mg dávky inzulínu (pozri tabuľku 1) v a homogénna prášková formulácia obsahujúca citrát sodný (dihydrát), manitol, glycín a sodík hydroxid. Po vložení blistra Exubera do inhalátora pacient načerpá rukoväť inhalátora a potom stlačí tlačidlo, čím dôjde k prepichnutiu blistra. Inhalačný prášok inzulínu sa potom disperguje do komory, čo pacientovi umožní inhalovať aerosolizovaný prášok.
Za štandardných testovacích podmienok in vitro dodáva Exubera špecifickú emitovanú dávku inzulínu z náustka inhalátora (pozri tabuľku 1). Frakcia celkovej hmotnosti častíc je emitovaná ako jemné častice schopné dosiahnuť hlboké pľúca. V blistri sa môže zachovať až 45% obsahu blistra 1 mg a až 25% obsahu blistra 3 mg.
Tabuľka 1: Nomenklatúra dávky a informácie
| Výplň (mg prášku) |
Nominálna dávka (mg inzulínu) |
Vypustená dávka*,†(mg inzulínu) |
Dávka jemných častícC,†(mg inzulínu) |
|---|---|---|---|
| |||
| 1.7 | 1.0 | 0.53 | 0.4 |
| 5.1 | 3.0 | 2.03 | 1.0 |
Skutočné množstvo inzulínu dodávaného do pľúc bude závisieť od individuálnych faktorov pacienta, ako je napríklad profil inspiračného toku. In vitro emitované aerosólové metriky nie sú ovplyvnené pri prietokoch nad 10 l / min.
top
Klinická farmakológia
Mechanizmus akcie
Primárnou aktivitou inzulínu je regulácia metabolizmu glukózy. Inzulín znižuje koncentráciu glukózy v krvi stimuláciou periférnej absorpcie glukózy kostrovými svalmi a tukmi a inhibíciou produkcie glukózy v pečeni. Inzulín inhibuje lipolýzu v adipocyte, inhibuje proteolýzu a zvyšuje syntézu proteínov.
farmakokinetika
vstrebávanie
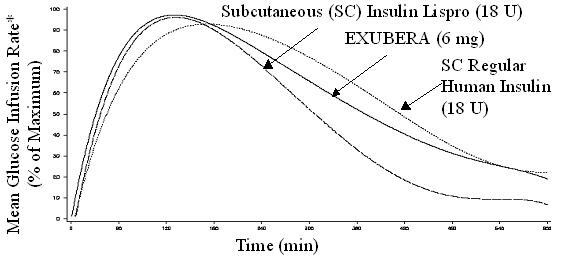
Exubera dodáva inzulín orálnou inhaláciou. Inzulín je absorbovaný tak rýchlo, ako subkutánne podávané rýchlo pôsobiace analógy inzulínu a rýchlejšie ako subkutánne podávaný pravidelný ľudský inzulín zdravým jedincom a pacientom s diabetom typu 1 alebo 2 (pozri Postava 1).
Postava 1: Nasledujú priemerné zmeny koncentrácií voľného inzulínu v sére (µU / ml) u pacientov s diabetom 2. typu Podávanie jednotlivých dávok inhalačného inzulínu z Exubery (6 mg) a pravidelného subkutánneho ľudského inzulínu (18U)

V klinických štúdiách u pacientov s cukrovkou 1. a 2. typu dosiahol sérový inzulín po inhalácii Exubery najvyššiu koncentráciu rýchlejšie ako po subkutánnej injekcii bežného ľudského inzulínu 49 minút (rozsah 30 až 90 minút) v porovnaní so 105 minútami (rozsah 60 až 240 minút), resp.
V klinických štúdiách sa absorpcia subkutánneho bežného ľudského inzulínu znížila so zvyšujúcim sa indexom telesnej hmotnosti pacienta (BMI). Avšak absorpcia inzulínu po inhalácii Exubery bola nezávislá od BMI.
V štúdii so zdravými jedincami bola systémová expozícia inzulínu (AUC a Cmax) po podaní Exubera sa zvýšila s dávkou v rozmedzí 1 až 6 mg, keď sa podávala v kombinácii 1 a 3 mg pľuzgiere.
V štúdii, kde sa lieková forma troch blistrov s obsahom 1 mg porovnávala s jedným blistrom s obsahom 3 mg, Cmax a AUC po podaní tri blistre s obsahom 1 mg boli približne o 30% a 40% väčšie, ako v prípade blistrov po podaní jedného blistra s obsahom 3 mg (pozri DÁVKOVANIE A PODÁVANIE).
Distribúcia a eliminácia
Pretože rekombinantný ľudský inzulín je identický s endogénnym inzulínom, očakáva sa, že systémová distribúcia a eliminácia budú rovnaké. Pre Exuberu sa to však nepotvrdilo.
farmakodynamika
Exubera, podobne ako subkutánne podávané rýchlo pôsobiace analógy inzulínu, má rýchlejší nástup aktivity znižovania glukózy ako subkutánne podávané bežné ľudské inzulíny. U zdravých dobrovoľníkov bolo trvanie aktivity znižujúcej hladinu glukózy v prípade Exubery porovnateľné s podkožným účinkom podávané normálny ľudský inzulín a dlhšie ako subkutánne podávané rýchlo pôsobiace analógy inzulínu (pozri Obrázok 2).
Obrázok 2. Priemerná miera infúzie glukózy (GIR) Normalizovaná na GIRmax za každý predmet liečby versus čas u zdravých dobrovoľníkov
* Určené ako množstvo infúzie glukózy na udržanie konštantných koncentrácií glukózy v plazme, normalizované na maximálne hodnoty (percento maximálnych hodnôt); indikuje aktivitu inzulínu.
Po vdýchnutí Exubery nastane u zdravých dobrovoľníkov nástup aktivity znižovania glukózy do 10 - 20 minút. Maximálny účinok na zníženie hladiny glukózy sa prejaví približne 2 hodiny po vdýchnutí. Trvanie aktivity znižujúcej hladinu glukózy je približne 6 hodín.
U pacientov s cukrovkou 1. alebo 2. typu má Exubera v priebehu prvých dvoch hodín po podaní dávky väčší účinok na zníženie glukózy v porovnaní so subkutánnym podaním bežného ľudského inzulínu.
Intraindividuálna variabilita aktivity Exubery na znižovanie glukózy je všeobecne porovnateľná s variabilitou subkutánne podávaného bežného ľudského inzulínu u pacientov s cukrovkou 1. a 2. typu.
Osobitné skupiny obyvateľstva
Pediatrickí pacienti
U detí (6-11 rokov) a adolescentov (12-17 rokov) s diabetom typu 1 bol čas na dosiahnutie maximálnej koncentrácie inzulínu v prípade Exubery dosiahnutý rýchlejšie ako v prípade subkutánneho bežného ľudského inzulínu, čo je v súlade s pozorovaniami u dospelých pacientov s typom 1 diabetes.
Geriatrickí pacienti
Pri porovnaní pacientov vo veku nad 65 rokov a mladších dospelých nie sú zjavné rozdiely vo farmakokinetických vlastnostiach Exubery.
rod
U jedincov s cukrovkou alebo bez nej sa nepozorovali žiadne zjavné rozdiely vo farmakokinetických vlastnostiach Exubery medzi mužmi a ženami.
závod
Štúdia sa uskutočnila na 25 zdravých belošských a japonských nediabetických osobách na porovnanie farmakokinetické a farmakodynamické vlastnosti Exubery verzus subkutánna injekcia bežného človeka inzulín. Farmakokinetické a farmakodynamické vlastnosti Exubery boli porovnateľné medzi týmito dvoma populáciami.
Obezita
Absorpcia Exubery je nezávislá od BMI pacienta.
Porucha funkcie obličiek
Účinok poškodenia obličiek na farmakokinetiku Exubery sa neskúmal. U pacientov s renálnou dysfunkciou môže byť potrebné starostlivé sledovanie hladiny glukózy a úprava dávky inzulínu (pozri časť 4.2) OPATRENIA, Porucha funkcie obličiek).
Hepatálne poškodenie
Účinok poškodenia funkcie pečene na farmakokinetiku Exubery sa neskúmal. U pacientov s pečeňovou dysfunkciou môže byť potrebné starostlivé sledovanie glukózy a úprava dávky inzulínu (pozri časť 4.2) OPATRENIA).
tehotenstvo
Absorpcia Exubery u tehotných pacientov s gestačným a predgestačným diabetes mellitus 2. typu bola rovnaká ako absorpcia u gravidných pacientov s diabetes mellitus 2. typu (pozri časť 4.8). OPATRENIA).
fajčenie
U fajčiarov sa očakáva, že systémová expozícia inzulínu Exubere bude 2 až 5 krát vyššia ako u nefajčiarov. Exubera je kontraindikovaná u pacientov, ktorí fajčia alebo ktorí prestali fajčiť menej ako 6 mesiacov pred začiatkom liečby Exuberou. Ak pacient začne fajčiť alebo v ňom pokračuje, Exubera musí byť okamžite prerušená kvôli zvýšenému riziku hypoglykémie a musí sa použiť alternatívna liečba (pozri Kontraindikácie).
V klinických štúdiách s Exuberou u 123 pacientov (z ktorých 69 boli fajčiari) sa u fajčiarov vyskytol rýchlejší nástup účinku na zníženie hladiny glukózy, väčší maximálny účinok a väčší celkový účinok na zníženie hladiny glukózy (najmä počas prvých 2 až 3 hodín po podaní dávky) v porovnaní s nefajčiari.
Pasívny cigaretový dym
Na rozdiel od zvýšenia expozície inzulínu po aktívnom fajčení, keď sa Exubera podávala 2 zdravým nefajčiarom po 2 hodiny expozície pasívnemu cigaretovému dymu v kontrolovanom experimentálnom prostredí boli AUC a Cmax inzulínu znížené približne o 20% a 30%, resp. Farmakokinetika Exubery sa neskúmala u nefajčiarov, ktorí sú chronicky vystavení pasívnemu cigaretovému dymu.
Pacienti so základným ochorením pľúc
Použitie Exubery u pacientov so základným ochorením pľúc, ako je astma alebo CHOCHP, sa neodporúča, pretože bezpečnosť a účinnosť Exubery v tejto populácii nebola stanovená (pozri časť 4.8). UPOZORNENIE). Použitie Exubery je kontraindikované u pacientov s nestabilným alebo zle kontrolovaným ochorením pľúc, a to z dôvodu širokého rozsahu zmeny pľúcnych funkcií, ktoré by mohli ovplyvniť absorpciu Exubery a zvýšiť riziko hypoglykémie alebo hyperglykémia (pozri Kontraindikácie).
Vo farmakokinetickej štúdii u 24 nediabetických jedincov s miernou astmou absorpcia inzulínu po podaní Exubera bola v neprítomnosti liečby bronchodilatátorom približne o 20% nižšia ako absorpcia pozorovaná u jedincov bez astma. Avšak v štúdii s 24 nediabetickými jedincami s chronickou obštrukčnou chorobou pľúc (COPD) bol systémový expozícia po podaní Exubery bola približne dvakrát vyššia ako u normálnych jedincov bez CHOCHP (pozri OPATRENIA).
Podávanie albuterolu 30 minút pred podaním Exubery nediabetickým jedincom s miernou astmou (n = 36) a stredne závažnou astma (n = 31) viedla k priemernému zvýšeniu AUC a Cmax inzulínu o 25 až 50% v porovnaní s tým, keď sa Exubera podávala samostatne (pozri časť 4.8). OPATRENIA).
top
Klinické štúdie
Bezpečnosť a účinnosť Exubery sa skúmala približne u 2 500 dospelých pacientov s cukrovkou 1. a 2. typu. Primárnym parametrom účinnosti vo väčšine štúdií bola kontrola glykémie, meraná znížením hemoglobínu A1c (HbA1c) oproti základnej hodnote.
Cukrovka 1. typu
U pacientov s diabetom typu 1 sa uskutočnila 24-týždňová, randomizovaná, otvorená štúdia aktívnej kontroly (štúdia A) na vyhodnotenie bezpečnosti a účinnosti Exubera sa podáva pred jedlom trikrát denne (TID) s jednou nočnou injekciou Humulin® U Ultralente® (ľudská inzulínová suspenzia s predĺženým uvoľňovaním zinku) (n = 136). Porovnávacia liečba bola subkutánny pravidelný ľudský inzulín podávaný dvakrát denne (BID). (pred raňajkami a pred večerou) s BID injekciou humánneho inzulínu NPH (suspenzia izofánu ľudského inzulínu) (n = 132). V tejto štúdii bol priemerný vek 38,2 rokov (rozmedzie: 20 - 64) a 52% účastníkov boli muži.
Druhá 24-týždňová, randomizovaná, otvorená štúdia aktívnej kontroly (štúdia B) sa uskutočnila u pacientov s diabetom 1. typu na vyhodnotenie bezpečnosť a účinnosť Exubery (n = 103) v porovnaní s bežným subkutánnym ľudským inzulínom (n = 103) pri podávaní TID pred jedlá. V oboch liečebných ramenách bol ľudskému inzulínu NPH podávaný BID (ráno a pred spaním) ako bazálny inzulín. V tejto štúdii bol priemerný vek 38,4 rokov (rozmedzie: 19 - 65) a 54% účastníkov boli muži.
V každej štúdii bolo zníženie HbA1c a miera hypoglykémie porovnateľné pre dve liečené skupiny. Pacienti liečení Exuberou mali väčšie zníženie hladiny glukózy v plazme nalačno ako pacienti v porovnávacej skupine. Percento pacientov, ktorí dosiahli hladinu HbA1c <8% (na akciu liečby American Diabetes Association Association) Hladina v čase vykonávania štúdie) a hladina HbA1c <7% bola porovnateľná medzi týmito dvoma liečenými skupinami. Výsledky štúdií A a B sú uvedené v tabuľke 2.
Tabuľka 2: Výsledky dvoch 24-týždňových, aktívnych kontrolných, otvorených skúšok u pacientov s diabetom 1. typu (štúdie A a B)
| Štúdia A | Štúdia B | |||
|---|---|---|---|---|
| Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) | Exubera (TID) + NPH (BID) | SC R (TID) + NPH (BID) | |
| Veľkosť vzorky | 136 | 132 | 103 | 103 |
| UL = humulín® U Ultralente®; SC R = subkutánny bežný ľudský inzulín | ||||
| ||||
| HbA1c (%) | ||||
| Základný priemer | 7.9 | 8.0 | 7.8 | 7.8 |
| Adj. priemerná zmena oproti základnej hodnote | -0.2 | -0.4 | -0.3 | -0.2 |
| Exubera mínus SCR* | 0.14 | -0.11 | ||
| 95% CI pre rozdiel v liečbe | (-0.03, 0.32) | (-0.30, 0.08) | ||
| Plazmatická glukóza nalačno (mg / dl) | ||||
| Základný priemer | 191 | 198 | 178 | 191 |
| Adj. priemerná zmena oproti základnej hodnote | -32 | -6 | -23 | 13 |
| Exubera mínus SCR | -27 | -35 | ||
| 95% CI pre rozdiel v liečbe | (-47, -6) | (-58, -13) | ||
| 2-hodinová postprandiálna koncentrácia glukózy (mg / dl) | ||||
| Základný priemer | 283 | 305 | 273 | 293 |
| Adj. priemerná zmena oproti základnej hodnote | -21 | 14 | -1 | -3 |
| Exubera mínus SCR | -35 | 2 | ||
| 95% CI pre rozdiel v liečbe | (-61, -8) | (-29, 32) | ||
| Pacienti s HbA na konci štúdie1c < 8%†| 64.0% | 68.2% | 74.8% | 66.0% |
| Pacienti s HbA na konci štúdie1c < 7% | 16.9% | 19.7% | 28.2% | 30.1% |
| Telesná hmotnosť | ||||
| Základný priemer (kg) | 77.4 | 76.4 | 76.0 | 76.9 |
| Adj. priemerná zmena oproti základnej hodnote (kg) | 0.4 | 1.1 | 0.4 | 0.6 |
| Exubera mínus SCR | -0.72 | -0.24 | ||
| 95% CI pre rozdiel v liečbe | (-1.48, 0.04) | (-1.07, 0.59) | ||
| Na konci štúdie denná dávka inzulínu | ||||
| Inzulín s krátkodobým účinkom | 13,4 mgC | 18,3 IU | 10,9 mgC | 25,7 IU |
| Inzulín s dlhodobým účinkom | 26,4 IU | 37,1 IU | 31,5 IU | 31,9 IU |
Cukrovka 2. typu
Monoterapia u pacientov, ktorí nie sú optimálne kontrolovaní diétou a cvičením
U pacientov s diabetes mellitus 2. typu sa uskutočnila 12-týždňová, randomizovaná, otvorená štúdia aktívnej kontroly (štúdia C). kontrolovaná diétou a cvičením, hodnotenie bezpečnosti a účinnosti pred jedlom TID Exubera (n = 75) v porovnaní s a látka zvyšujúca citlivosť na inzulín. V tejto štúdii bol priemerný vek 53,7 rokov (rozmedzie: 28 - 80), 55% jedincov bolo mužov a priemerný index telesnej hmotnosti bol 32,3 kg / m.2.
Po 12 týždňoch HbA1c hladiny u pacientov liečených Exuberou sa znížili o 2,2% (SD = 1,0) zo základnej hodnoty 9,5% (SD = 1,1). Podiel pacientov liečených Exuberou, ktorí dosiahli HbA na konci štúdie1c hladina <8% sa zvýšila na 82,7%. Podiel pacientov liečených Exuberou, ktorí dosiahli HbA na konci štúdie1c úroveň
Monoterapia a prídavná terapia u pacientov predtým liečených terapiou perorálnymi agentmi
U pacientov s typom sa uskutočnila 12-týždňová, randomizovaná, otvorená štúdia aktívnej kontroly (štúdia D) 2 diabetici, ktorí v súčasnosti dostávali liečbu, ale boli slabo kontrolovaní dvoma perorálnymi agensmi (OA). Základné OA zahŕňali sekretagog inzulínu a buď metformín alebo tiazolidíndión. Pacienti boli randomizovaní do jednej z troch vetiev: pokračovanie v samotnej liečbe OA (n = 96), prechod na pred jedlom TID Exubera v monoterapii (n = 102) alebo pridaním pred jedlom TID Exubera k pokračujúcej liečbe OA (n = 100). V tejto štúdii bol priemerný vek 57,4 rokov (rozmedzie: 33 - 80), 66% účastníkov boli muži a priemerný index telesnej hmotnosti bol 30 kg / m.2.
Monoterapia Exubera a Exubera v kombinácii s OA terapiou boli pri znižovaní HbA lepšie ako samotné OA terapie1c úrovne od základnej línie. Miera hypoglykémie pre dve liečené skupiny Exubera bola mierne vyššia ako v skupine liečenej samotnou OA. V porovnaní so samotnou liečbou OA percento pacientov, ktorí dosiahli HbA1c hladina <8% (podľa akčnej úrovne liečby American Diabetes Association v čase vykonávania štúdie) a HbA1c hladina <7% bola vyššia u pacientov liečených monoterapiou Exuberou a Exuberou v kombinácii s liečbou OA. Pacienti v oboch liečebných skupinách Exubera mali väčšie zníženie plazmatickej glukózy nalačno ako pacienti liečení samotnou liečbou OA. Výsledky štúdie D sú uvedené v tabuľke 3.
Tabuľka 3: Výsledky 12-týždňovej aktívnej kontroly s otvoreným označením u pacientov s diabetom typu 2, ktoré nie sú optimálne kontrolované terapiou duálnymi perorálnymi látkami (štúdia D)
| Štúdia D | Exubera v monoterapii | operačné hodnotenia* | Exubera + OAs |
|---|---|---|---|
| Veľkosť vzorky | 102 | 96 | 100 |
| |||
| HbA1c (%) | |||
| Základný priemer | 9.3 | 9.3 | 9.2 |
| Adj. priemerná zmena oproti základnej hodnote | -1.4 | -0.2 | -1.9 |
| Skupina Exubera mínus OA†| -1.18†,C, § | -1.67†, ¶, § | |
| 95% CI pre rozdiel v liečbe | (-1.41, -0.95) | (-1.90, -1.44) | |
| Plazmatická glukóza nalačno (mg / dl) | |||
| Základný priemer | 203 | 203 | 195 |
| Adj. priemerná zmena oproti základnej hodnote | -23 | 1 | -53 |
| Skupina Exubera mínus OA | -24C | -53 ¶ | |
| 95% CI pre rozdiel v liečbe | (-36, -11) | (-66, -41) | |
| Pacienti s HbA na konci štúdie1c < 8%# | 55.9% | 18.8% | 86.0% |
| Pacienti s HbA na konci štúdie1c < 7% | 16.7% | 1.0% | 32.0% |
| Telesná hmotnosť | |||
| Základný priemer (kg) | 89.5 | 88.0 | 88.6 |
| Adj. priemerná zmena oproti základnej hodnote (kg) | 2.8 | 0.0 | 2.7 |
| Skupina Exubera mínus OA | 2.80C | 2.75 ¶ | |
| 95% CI pre rozdiel v liečbe | (1.94, 3.65) | (1.89, 3.61) |
U pacientov s diabetom 2. typu, ktorí v súčasnosti dostávajú sulfonylmočovinu, sa uskutočnila 24-týždňová, randomizovaná, otvorená štúdia s aktívnou kontrolou (štúdia E). Táto štúdia bola navrhnutá na vyhodnotenie bezpečnosti a účinnosti pridávania Exubery pred jedlom, aby sa pokračovalo terapia sulfonylmočovinou (n = 214) v porovnaní s pridaním metformínu pred jedlom k pokračujúcej liečbe sulfonylmočovinou (n = 214) = 196). Subjekty boli stratifikované podľa HbA1c v týždni -1. Boli definované dve vrstvy: nízka vrstva HbA1c (HbA1c 8% až 9,5%) a vysoká HbA1c vrstva (HbA1c > 9,5 až ± 12%).
Exubera v kombinácii so sulfonylmočovinou bola lepšia ako metformín a sulfonylmočovina pri znižovaní hodnôt HbA1c od základnej línie v skupine s vysokou vrstvou. Exubera v kombinácii so sulfonylmočovinou bola porovnateľná s metformínom v kombinácii so sulfonylmočovinou pri znižovaní hodnôt HbA1c od základnej línie v skupine s nízkou vrstvou. Miera hypoglykémie bola vyššia po pridaní Exubery na sulfonylmočovinu ako po pridaní metformínu na sulfonylmočovinu. Percento pacientov, ktorí dosiahli cieľové hodnoty HbA1c 8% a 7%, bolo porovnateľné medzi liečebnými skupinami v oboch vrstvách, rovnako ako zníženie plazmatickej glukózy nalačno (pozri pozri nižšie). Tabuľka 4).
Ďalšia 24-týždňová, randomizovaná, otvorená štúdia aktívnej kontroly (štúdia F) sa uskutočnila u pacientov s diabetom 2. typu, ktorí v súčasnosti dostávajú metformínovú liečbu. Táto štúdia bola navrhnutá na vyhodnotenie bezpečnosti a účinnosti pridávania Exubery pred jedlom, aby sa pokračovalo liečba metformínom (n = 234) v porovnaní s pridaním glibenklamidu pred jedlom k pokračujúcej liečbe metformínom (n = 222). Subjekty v tejto štúdii boli tiež stratifikované do jednej z dvoch vrstiev, ako je definované v štúdii E.
Exubera v kombinácii s metformínom bola pri znižovaní HbA lepšia ako glibenklamid a metformín1c hodnoty od základnej línie a dosiahnutie cieľovej HbA1c hodnoty v skupine s vysokou vrstvou. Exubera v kombinácii s metformínom bola pri znižovaní HbA porovnateľná s glibenklamidom v kombinácii s metformínom.1c hodnoty od základnej línie a dosiahnutie cieľovej HbA1c hodnoty v skupine s nízkou vrstvou. Po pridaní Exubery k metformínu bola miera hypoglykémie mierne vyššia ako po pridaní glibenklamidu k metformínu. Zníženie plazmatickej glukózy nalačno bolo medzi liečenými skupinami porovnateľné (pozri Tabuľka 4).
Tabuľka 4: Výsledky dvoch 24-týždňových, aktívnych kontrolných, otvorených skúšok u pacientov s diabetom 2. typu predtým liečených perorálnymi látkami (štúdie E a F)
| Štúdia E | Štúdia F | |||||||
|---|---|---|---|---|---|---|---|---|
| Exubera + SU* | Met*+ SU* | Exubera + SU* | Met*+ SU* | Exubera + Met* | Gli* + Met* | Exubera + Met* | Gli* + Met* | |
| Vysoká vrstva†| Nízka vrstva†| Vysoká vrstva†| Nízka vrstva†| |||||
| Veľkosť vzorky | 113 | 103 | 101 | 93 | 109 | 103 | 125 | 119 |
| ||||||||
| HbA1c (%) | ||||||||
| Základný priemer | 10.5 | 10.6 | 8.8 | 8.8 | 10.4 | 10.6 | 8.6 | 8.7 |
| Adj. priemerná zmena oproti základnej hodnote | -2.2 | -1.8 | -1.9 | -1.9 | -2.2 | -1.9 | -1.8 | -1.9 |
| Exubera mínus OAC | -0.38C, § | -0.07 | -0.37C, ¶ | 0.04 | ||||
| 95% CI pre rozdiel v liečbe | (-0.63, -0.14) | (-0.33, 0.19) | (-0.62, -0.12) | (-0.19, 0.27) | ||||
| Plazmatická glukóza nalačno (mg / dl) | ||||||||
| Základný priemer | 241 | 237 | 197 | 198 | 223 | 243 | 187 | 196 |
| Priemerná zmena oproti základnej línii | -46 | -47 | -48 | -52 | -42 | -40 | -46 | -49 |
| Exubera mínus OA | 1 | 4 | -2 | 4 | ||||
| 95% CI pre rozdiel v liečbe | (-11, 12) | (-8, 16) | (-14, 10) | (-7, 15) | ||||
| Subjekty s koncom štúdie HbA1c < 8%# | 48.7% | 44.7% | 81.2% | 73.1% | 72.5% | 56.3% | 80.8% | 86.6% |
| Subjekty s koncom štúdie HbA1c < 7% | 20.4% | 14.6% | 30.7% | 32.3% | 33.9% | 17.5% | 40.0% | 42.9% |
| Telesná hmotnosť | ||||||||
| Základný priemer (kg) | 80.8 | 79.5 | 79.9 | 81.9 | 88.3 | 87.8 | 90.3 | 88.2 |
| Adj. priemerná zmena oproti základnej hodnote (kg) | 3.6 | -0.0 | 2.4 | -0.3 | 2.8 | 2.5 | 2.0 | 1.6 |
| Exubera mínus OA | 3.60 | 2.67 | 0.26 | 0.38 | ||||
| 95% CI pre rozdiel v liečbe | (2.81, 4.39) | (1.84, 3.51) | (-0.70, 1.21) | (-0.52, 1.27) |
Použitie u pacientov predtým liečených subkutánnym inzulínom
U pacientov liečených inzulínom s typom 2 sa uskutočnila 24-týždňová, randomizovaná, otvorená štúdia aktívnej kontroly (štúdia G). cukrovka na posúdenie bezpečnosti a účinnosti Exubery podanej pred jedlom TID s jednou nočnou injekciou do Humulin® U Ultralente® (n = 146) v porovnaní s bežným subkutánnym ľudským inzulínom podávaným BID (pred raňajkami a pred večerou) s BID injekciou ľudského inzulínu NPH (n = 149). V tejto štúdii bol priemerný vek 57,5 roka (rozmedzie: 23 - 80), 66% účastníkov boli muži a priemerný index telesnej hmotnosti bol 30,3 kg / m.2.
Zníženia oproti základnej hodnote v HbA1c, percento pacientov, ktorí dosiahli HbA1c hladina <8% (podľa akčnej úrovne liečby American Diabetes Association v čase vykonávania štúdie) a HbA1c hladina <7%, ako aj miera hypoglykémie, boli medzi liečenými skupinami podobné. Pacienti liečení Exuberou mali väčšie zníženie hladiny glukózy v plazme nalačno ako pacienti v porovnávacej skupine. Výsledky štúdie G sú uvedené v tabuľke 5.
Tabuľka 5: Výsledky 24-týždňovej aktívnej kontroly s otvoreným označením u pacientov s diabetom 2. typu, predtým liečených subkutánnym inzulínom (štúdia G)
| Štúdia G | Exubera (TID) + UL (QD) | SC R (BID) + NPH (BID) |
|---|---|---|
| Veľkosť vzorky | 146 | 149 |
| UL = humulín® U Ultralente®; SC R = subkutánny bežný ľudský inzulín | ||
| ||
| HbA1c (%) | ||
| Základný priemer | 8.1 | 8.2 |
| Adj. priemerná zmena oproti základnej hodnote | -0.7 | -0.6 |
| Exubera mínus SCR* | -0.07 | |
| 95% CI pre rozdiel v liečbe | (-0.31, 0.17) | |
| Plazmatická glukóza nalačno (mg / dl) | ||
| Základný priemer | 152 | 159 |
| Adj. priemerná zmena oproti základnej hodnote | -22 | -6 |
| Exubera mínus SCR | -16.36 | |
| 95% CI pre rozdiel v liečbe | (-27.09, -5.36) | |
| Pacienti s HbA na konci štúdie1c < 8%†| 76.0% | 69.1% |
| Pacienti s HbA na konci štúdie1c < 7% | 45.2% | 32.2% |
| Telesná hmotnosť | ||
| Základný priemer (kg) | 90.6 | 89.0 |
| Adj. priemerná zmena oproti základnej hodnote (kg) | 0.1 | 1.3 |
| Exubera mínus SCR | -1.28 | |
| 95% CI pre rozdiel v liečbe | (-1.96, -0.60) | |
| Na konci štúdie denná dávka inzulínu | ||
| Inzulín s krátkodobým účinkom | 16,6 mgC | 25,5 IU |
| Inzulín s dlhodobým účinkom | 37,9 IU | 52,3 IU |
top
Indikácie a použitie
Exubera je indikovaná na liečbu dospelých pacientov s diabetes mellitus na kontrolu hyperglykémie. Exubera má nástup účinku podobný rýchlo pôsobiacim analógom inzulínu a má trvanie aktivity znižujúcej hladinu glukózy porovnateľnú s podkožne podávaným bežným ľudským inzulínom. U pacientov s cukrovkou 1. typu sa má Exubera používať v režimoch, ktoré zahŕňajú dlhodobo pôsobiaci inzulín. U pacientov s diabetes mellitus 2. typu sa Exubera môže používať ako monoterapia alebo v kombinácii s perorálnymi liekmi alebo dlhšie pôsobiacimi inzulínmi.
top
kontraindikácie
Exubera je kontraindikovaná u pacientov precitlivených na Exuberu alebo na niektorú z pomocných látok.
Exubera je kontraindikovaná u pacientov, ktorí fajčia alebo ktorí prestali fajčiť menej ako 6 mesiacov pred začiatkom liečby Exuberou. Ak pacient začne fajčiť alebo v ňom pokračuje, Exubera musí byť okamžite prerušená kvôli zvýšenému riziku hypoglykémie a musí sa použiť alternatívna liečba (pozri KLINICKÁ FARMAKOLÓGIA, Špeciálne skupiny obyvateľstva, Fajčenie). Bezpečnosť a účinnosť Exubery u fajčiarov nebola stanovená.
Exubera je kontraindikovaná u pacientov s nestabilným alebo zle kontrolovaným ochorením pľúc, a to kvôli veľkým rozdielom pri pľúcnych funkciách, ktoré by mohli ovplyvniť absorpciu Exubery a zvýšiť riziko hypoglykémie alebo hyperglykémia.
top
varovanie
Exubera sa líši od bežného ľudského inzulínu rýchlym nástupom účinku. Ak sa používa ako inzulín pred jedlom, dávka Exubery sa má podať do 10 minút pred jedlom.
Hypoglykémia je najčastejšie hlásenou nežiaducou udalosťou inzulínovej liečby vrátane Exubery. Načasovanie hypoglykémie sa môže u rôznych inzulínových formulácií líšiť.
Pacienti s diabetom 1. typu tiež potrebujú dlhodobo pôsobiaci inzulín, aby si udržali primeranú kontrolu glukózy.
Akákoľvek zmena inzulínu sa musí robiť opatrne a iba pod lekárskym dohľadom. Zmeny sily inzulínu, výrobcu, typu (napr. Pravidelný, NPH, analógy) alebo druhu (zviera, človek) môžu viesť k potrebe zmeny dávkovania. Možno bude potrebné upraviť súbežnú perorálnu antidiabetickú liečbu.
Monitorovanie glukózy sa odporúča všetkým pacientom s cukrovkou.
Kvôli účinku Exubery na pľúcne funkcie by mali byť všetci pacienti pred začatím liečby Exuberou vyhodnotení pľúcnych funkcií (pozri časť 4.8). OPATRENIA: Pľúcna funkcia).
Použitie Exubery u pacientov so základným ochorením pľúc, ako je astma alebo CHOCHP, sa neodporúča, pretože bezpečnosť a účinnosť Exubery v tejto populácii nebola stanovená (pozri časť 4.8). OPATRENIA: Základná choroba pľúc).
V klinických štúdiách s Exuberou sa vyskytlo 6 novodiagnostikovaných prípadov primárnych pľúcnych malignit u pacientov liečených Exuberou a 1 novodiagnostikovaný prípad medzi pacientmi liečenými komparátorom. U pacientov liečených Exuberou sa vyskytla aj 1 postmarketingová správa o primárnej malignite pľúc. V kontrolovaných klinických skúšaniach s Exuberou bol výskyt nového primárneho karcinómu pľúc na 100 pacientorokov študovanej expozície lieku 0,13 (5 prípadov viac ako 3900 pacientorokov) u pacientov liečených Exuberou a 0,02 (1 prípad viac ako 4100 pacientorokov) u pacientov liečených komparátorom. Príliš málo prípadov bolo na určenie, či výskyt týchto udalostí súvisí s Exuberou. Všetci pacienti, u ktorých bola diagnostikovaná rakovina pľúc, mali v anamnéze fajčenie cigariet.
top
Opatrenia
všeobecný
Ako u všetkých inzulínových prípravkov, časový priebeh účinku Exubery sa môže líšiť u rôznych jedincov alebo v rôznych časoch u toho istého jedinca. Úprava dávky akéhokoľvek inzulínu môže byť potrebná, ak pacienti zmenia svoju fyzickú aktivitu alebo svoj obvyklý plán stravovania. Požiadavky na inzulín sa môžu meniť počas súbežných stavov, ako sú choroby, emočné poruchy alebo stres.
hypoglykémie
Tak ako pri všetkých inzulínových prípravkoch, hypoglykemické reakcie môžu byť spojené s podávaním Exubery. Rýchle zmeny koncentrácie glukózy v sére môžu u pacientov s cukrovkou vyvolať príznaky podobné hypoglykémii bez ohľadu na hodnotu glukózy. Včasné varovné príznaky hypoglykémie môžu byť za určitých podmienok, napríklad dlhé, odlišné alebo menej výrazné trvanie cukrovky, ochorenie diabetických nervov, použitie liekov, ako sú beta-blokátory alebo zosilnená kontrola cukrovky (pozri OPATRENIA: Liekové interakcie). Takéto situácie môžu mať za následok závažnú hypoglykémiu (a pravdepodobne stratu vedomia) predtým, ako si pacient uvedomí hypoglykémiu.
Porucha funkcie obličiek
Štúdie u pacientov s poruchou funkcie obličiek sa nevykonali. Tak ako pri iných inzulínových prípravkoch, aj u pacientov s poškodením funkcie obličiek sa môže dávka Exubery znížiť KLINICKÁ FARMAKOLÓGIA, Osobitné skupiny obyvateľstva.
Hepatálne poškodenie
Štúdie u pacientov s poškodením funkcie pečene sa nevykonali. Tak ako pri iných inzulínových prípravkoch, aj u pacientov s poškodením funkcie pečene sa môže dávka Exubery znížiť KLINICKÁ FARMAKOLÓGIA, Osobitné skupiny obyvateľstva.
alergie
Systémová alergia
V klinických štúdiách bol celkový výskyt alergických reakcií u pacientov liečených Exuberou podobný ako u pacientov užívajúcich subkutánne režimy s bežným ľudským inzulínom.
Tak ako pri iných inzulínových prípravkoch sa môže vyskytnúť zriedkavá, ale potenciálne závažná generalizovaná alergia na inzulín, ktorá môže spôsobiť vyrážka (vrátane svrbenia) na celom tele, dýchavičnosť, sipot, zníženie krvného tlaku, rýchly pulz alebo potenie. Závažné prípady generalizovanej alergie vrátane anafylaktických reakcií môžu byť život ohrozujúce. Ak sa takéto reakcie vyskytnú z Exubery, Exubera sa musí zastaviť a zvážiť alternatívne liečby.
Výroba protilátok
Počas liečby všetkými inzulínovými prípravkami vrátane Exubery sa môžu vytvárať inzulínové protilátky. V klinických štúdiách s Exuberou, kde bol komparátorom subkutánny inzulín, zvýšenie hladín protilátok na inzulín (čo sa odráža v testoch väzbová aktivita na inzulín) boli významne vyššie u pacientov, ktorí dostávali Exuberu, ako u pacientov, ktorí dostávali subkutánny inzulín Iba. Počas klinických štúdií s Exuberou neboli zistené žiadne klinické následky týchto protilátok; dlhodobý klinický význam tohto zvýšenia tvorby protilátok však nie je známy.
dýchacie
Pľúcna funkcia
V klinických štúdiách trvajúcich až do dvoch rokov pacienti liečení Exuberou preukázali väčší pokles pľúcnych funkcií, konkrétne vynútený exspiračný objem za sekundu (FEV1) a kapacita rozptyľovania oxidu uhoľnatého (DLCO), ako porovnávaný pacienti. Priemerný rozdiel v pľúcnej funkcii liečenej skupiny v prospech porovnávacej skupiny bol zaznamenaný v rámci prvých niekoľko týždňov liečby Exuberou a počas dvojročného obdobia liečby sa nezmenila (Pozri NEŽIADUCE REAKCIE: Pľúcna funkcia).
Počas kontrolovaných klinických skúšok došlo u jednotlivých pacientov k výraznému poklesu pľúcnych funkcií v oboch liečebných skupinách. Pokles oproti východiskovej hodnote FEV1 o 20% pri poslednom pozorovaní sa vyskytol u 1,5% pacientov liečených Exuberou a 1,3% pacientov liečených komparátorom. Pokles oproti základnej hodnote DLCO z 20% pri poslednom pozorovaní sa vyskytlo u 5,1% pacientov liečených Exuberou a 3,6% pacientov liečených komparátorom.
Z dôvodu účinku Exubery na pľúcnu funkciu by všetci pacienti mali mať pred začatím liečby Exuberou vyšetrenú spirometriu (FEV1). Posúdenie DLCO malo by sa brať do úvahy. Účinnosť a bezpečnosť Exubery u pacientov so základnou FEV1 alebo DLCO <70% predpovedaných nebolo stanovené a použitie Exubery v tejto populácii sa neodporúča.
Vyhodnotenie pľúcnych funkcií (napr. Spirometria) sa odporúča po prvých 6 mesiacoch liečby a potom každý rok, a to aj pri absencii pľúcnych príznakov. U pacientov, ktorí majú pokles FEV1 o 20% oproti východiskovým hodnotám, by sa mali vyšetriť pľúcne testy. Ak sa potvrdí pokles â ‰ 20% oproti východiskovej hodnote FEV1, Exubera sa musí vysadiť. Prítomnosť pľúcnych príznakov a menšie zníženie pľúcnych funkcií si môže vyžadovať častejšie monitorovanie pľúcnych funkcií a zváženie prerušenia liečby Exuberou.
Základná choroba pľúc
Použitie Exubery u pacientov so základným ochorením pľúc, ako je astma alebo CHOCHP, sa neodporúča, pretože účinnosť a bezpečnosť Exubery v tejto populácii nebola stanovená.
bronchospazmus
U pacientov užívajúcich Exuberu sa zriedkavo hlásil bronchospazmus. Pacienti, u ktorých sa vyskytla takáto reakcia, by mali prerušiť liečbu Exuberou a okamžite vyhľadať lekárske vyšetrenie. Opätovné podanie Exubery si vyžaduje dôkladné vyhodnotenie rizika a malo by sa vykonať iba pod prísnym lekárskym dohľadom s dostupnými vhodnými klinickými zariadeniami.
Interkurentné respiračné ochorenie
Exubera sa podáva v klinických štúdiách pacientom s interkurentným ochorením dýchacích ciest (napr. Bronchitída, infekcie horných dýchacích ciest, rinitída). U pacientov, u ktorých sa vyskytli tieto stavy, 3 - 4% dočasne prerušilo liečbu Exuberou. U pacientov liečených Exuberou nebolo v porovnaní s pacientmi liečenými subkutánnym inzulínom pozorované zvýšené riziko hypoglykémie alebo zhoršenej glykemickej kontroly. Počas interkurentného respiračného ochorenia môže byť potrebné dôkladné sledovanie koncentrácie glukózy v krvi a úprava dávky.
Informácie pre pacientov
Pacienti by mali byť poučení o postupoch samosprávy vrátane monitorovania glukózy; správna inhalačná technika Exubera; a manažment hypoglykémie a hyperglykémie. Pacienti musia byť poučení o zvládaní osobitných situácií, ako sú interkurentné stavy (choroba, stres alebo emocionálny stav) poruchy), neprimeraná alebo vynechaná dávka inzulínu, neúmyselné podanie zvýšenej dávky inzulínu, neprimeraný príjem potravy alebo vynechané jedlo.
Pacienti majú byť informovaní o tom, že v klinických štúdiách bola liečba Exuberou spojená s malým, progresívnym priemerným poklesom pľúcnych funkcií v porovnaní s porovnávacími liečbami. Kvôli účinku Exubery na pľúcne funkcie sa pred začatím liečby Exuberou odporúčajú testy na pľúcne funkcie. Po začatí liečby sa odporúčajú pravidelné testy pľúcnych funkcií (pozri časť 5.2) OPATRENIA Dýchacie, pľúcne funkcie).
Pacienti by mali informovať svojho lekára, ak majú v anamnéze ochorenie pľúc, pretože použitie Exubery sa neodporúča pacienti so základným ochorením pľúc (napr. astmou alebo CHOCHP) a je kontraindikovaný u pacientov so slabo kontrolovanými pľúcami choroby.
Ženy s cukrovkou by mali byť informované, aby informovali svojho lekára, ak sú tehotné alebo plánujú otehotnieť.
top
Liekové interakcie
Viaceré látky ovplyvňujú metabolizmus glukózy a môžu si vyžadovať úpravu dávky inzulínu a obzvlášť dôkladné monitorovanie.
Nasledujú príklady látok, ktoré môžu znižovať účinok inzulínu na znižovanie glukózy v krvi, ktorý môže viesť k hyperglykémii: kortikosteroidy, danazol, diazoxid, diuretiká, sympatomimetiká (napr. epinefrín, albuterol, terbutalín), glukagón, izoniazid, deriváty fenotiazínu, somatropín, hormóny štítnej žľazy, estrogény, progestogény (napr. v perorálnej antikoncepcii), inhibítory proteázy a atypické antipsychotické lieky (napr. olanzapín a klozapín).
Nasledujú príklady látok, ktoré môžu zvýšiť účinok inzulínu na zníženie hladiny glukózy v krvi a náchylnosť na hypoglykémiu: perorálne antidiabetické výrobky, ACE inhibítory, disopyramid, fibráty, fluoxetín, inhibítory MAO, pentoxifylín, propoxyfén, salicyláty a sulfónamid antibiotiká.
Beta-blokátory, klonidín, soli lítia a alkohol môžu zvýšiť alebo znížiť účinok inzulínu na zníženie hladiny glukózy v krvi. Pentamidín môže spôsobiť hypoglykémiu, po ktorej môže niekedy nasledovať hyperglykémia.
Okrem toho môžu byť pod vplyvom sympatolytických liekov, ako sú betablokátory, klonidín, guanetidín a rezerpín, znížené alebo chýbajúce príznaky a príznaky hypoglykémie.
Bronchodilatanciá a iné inhalačné produkty môžu zmeniť absorpciu inhalovaného ľudského inzulínu (pozri KLINICKÁ FARMAKOLÓGIA, Špeciálne populácie). Odporúča sa dôsledné načasovanie dávkovania bronchodilatátorov v porovnaní s podaním Exubery, dôkladné monitorovanie koncentrácií glukózy v krvi a prípadne titrácia dávky.
Karcinogenéza, mutagenéza, poškodenie plodnosti
Dvojročné štúdie karcinogenity na zvieratách sa nevykonali. Inzulín nebol mutagénny v Amesovom bakteriálnom reverznom mutačnom teste v prítomnosti a neprítomnosti metabolickej aktivácie.
U potkanov Sprague-Dawley sa uskutočnila šesťmesačná štúdia toxicity po opakovanom podaní s inhalačným práškom inzulínu v dávkach do 5,8 mg / kg / deň (v porovnaní s klinickými počiatočná dávka 0,15 mg / kg / deň, vysoká dávka potkana bola 39-krát alebo 8,3-násobok klinickej dávky, vztiahnuté na porovnanie buď plochy povrchu tela mg / kg alebo mg / m2). U opíc Cynomolgus sa vykonala 6-mesačná štúdia toxicity po opakovanom podaní inhalačného inzulínu v dávkach až 0,64 mg / kg / deň. V porovnaní s klinickou východiskovou dávkou 0,15 mg / kg / deň bola vysoká dávka opice 4,3-násobok alebo 1,4-násobok klinickej dávky, a to na základe porovnania buď plochy povrchu tela mg / kg alebo mg / m2. Boli to maximálne tolerované dávky založené na hypoglykémii.
V porovnaní s kontrolnými zvieratami neboli pozorované žiadne nepriaznivé účinky súvisiace s liečbou ani u jedného druhu na pľúcnu funkciu, hrubú alebo mikroskopickú morfológiu dýchacích ciest ani bronchiálne lymfatické uzliny. Podobne nebol žiadny účinok na indexy bunkovej proliferácie v alveolárnej alebo bronchiálnej oblasti pľúc u žiadneho druhu.
Pretože rekombinantný ľudský inzulín je identický s endogénnym hormónom, u zvierat sa nevykonali reprodukčné / fertilitné štúdie.
tehotenstvo
Teratogénne účinky
Tehotenstvo Kategória C
Štúdie reprodukcie na zvieratách s Exuberou neboli vykonané. Nie je tiež známe, či Exubera môže spôsobiť poškodenie plodu, keď sa podáva gravidnej žene, alebo či môže Exubera ovplyvniť reprodukčnú schopnosť. Exubera sa má podávať tehotnej žene iba v nevyhnutných prípadoch.
Dojčiace matky
Mnoho liekov vrátane ľudského inzulínu sa vylučuje do materského mlieka. Z tohto dôvodu je potrebná opatrnosť pri podávaní Exubery dojčiacej žene. Pacienti s diabetom, ktorí dojčia, môžu vyžadovať úpravu dávky Exubery, stravovacieho plánu alebo oboch.
Pediatrické použitie
Dlhodobá bezpečnosť a účinnosť Exubery u pediatrických pacientov nebola stanovená (pozri KLINICKÁ FARMAKOLÓGIA, Špeciálne populácie).
Geriatrické použitie
V kontrolovaných klinických štúdiách fázy 2/3 (n = 1975) sa Exubera podávala 266 pacientom vo veku 65 rokov a 30 pacientom vo veku 75 rokov. Väčšina z týchto pacientov mala diabetes 2. typu. Zmena HbA1C a miera hypoglykémie sa nelíšila vekom.
top
Nežiaduce reakcie
Bezpečnosť Exubery samotnej alebo v kombinácii so subkutánnym inzulínom alebo perorálnymi liekmi bola rovnaká hodnotené u približne 2500 dospelých pacientov s cukrovkou 1. alebo 2. typu, ktorí boli vystavení Exubera. Približne 2000 pacientov bolo vystavených Exubere dlhšie ako 6 mesiacov a viac ako 800 pacientov bolo vystavených viac ako 2 roky.
Ne respiračné nežiaduce účinky
Ne respiračné nežiaduce účinky hlásené u 1% z roku 1977 pacientov liečených Exuberou v kontrolovaných klinických štúdiách fázy 2/3, bez ohľadu na príčinnú súvislosť, zahŕňajú (ale neobmedzujú sa iba na):
Metabolické a výživné: hypoglykémia (pozri UPOZORNENIE a OPATRENIA)
Telo ako celok: bolesť na hrudníku
Tráviace: sucho v ústach
Špeciálne zmysly: zápal stredného ucha (pediatrickí diabetici 1. typu)
hypoglykémie
Miera a výskyt hypoglykémie boli porovnateľné medzi Exuberou a subkutánnym bežným ľudským inzulínom u pacientov s cukrovkou 1. a 2. typu. U pacientov typu 2, ktorí neboli primerane kontrolovaní terapiou jedným perorálnym liekom, pridanie Exubera bola spojená s vyššou mierou hypoglykémie ako pridanie druhého perorálneho roztoku agenta.
Bolesť v hrudi
Ako nežiaduce reakcie boli hlásené rôzne symptómy hrudníka a boli zoskupené podľa nešpecifického termínu bolesti na hrudníku. Tieto udalosti sa vyskytli u 4,7% pacientov liečených Exuberou a 3,2% pacientov v porovnávacích skupinách. Väčšina (> 90%) týchto udalostí bola hlásená ako mierna alebo stredne ťažká. Dvaja pacienti v skupine Exubera a jeden v porovnávacej skupine prerušili liečbu z dôvodu bolesti na hrudníku. Výskyt nepriaznivých udalostí spôsobených koronárnou artériou, ako je angína pectoris alebo infarkt myokardu, bol v prípade Exubera porovnateľný (0,7% angina pectoris; 0,7% infarkt myokardu) a komparátor (1,3% angina pectoris; Liečených skupín s 0,7% infarktom myokardu.
Suché ústa
Sucho v ústach bolo hlásené u 2,4% pacientov liečených Exuberou a 0,8% pacientov v porovnávacích skupinách. Takmer všetky hlásené suchosti v ústach (> 98%) boli mierne alebo stredne závažné. Žiadny pacient neskončil liečbu z dôvodu suchosti v ústach.
Ušné udalosti u pediatrickej diabetiky
Pediatrickí diabetici 1. typu v skupinách Exubera mali častejšie nežiaduce účinky súvisiace s uchom ako pediatrickí diabetici 1. typu v liečených skupinách, ktorí dostávali iba subkutánny inzulín. Tieto udalosti zahŕňali zápal stredného ucha (Exubera 6,5%; SC 3,4%), bolesť ucha (Exubera 3,9%; SC 1,4%) a porucha ucha (Exubera 1,3%; SC 0%).
Respiračné nežiaduce účinky
Tabuľka 6 ukazuje výskyt respiračných nepriaznivých udalostí pre každú hlásenú liečenú skupinu v â ‰ ¥ 1% akejkoľvek liečenej skupiny v kontrolovaných klinických štúdiách fázy 2 a 3, bez ohľadu na príčinnú súvislosť.
Tabuľka 6: Respiračné nežiaduce udalosti hlásené v 1% akejkoľvek liečebnej skupiny v kontrolovaných fázach 2 a 3 klinických štúdií, bez ohľadu na kauzalitu
| Percento hlásených udalostí | |||||
|---|---|---|---|---|---|
| Nepriaznivá udalosť | Cukrovka 1. typu | Cukrovka 2. typu | |||
| Exubera N = 698 |
SC N = 705 |
Exubera N = 1279 |
SC N = 488 |
operačné hodnotenia N = 644 |
|
| SC = subkutánny porovnávací inzulín; OA = porovnávače perorálnych látok | |||||
| Infekcia dýchacích ciest | 43.3 | 42.0 | 29.2 | 38.1 | 19.7 |
| Kašeľ sa zvýšil | 29.5 | 8.8 | 21.9 | 10.2 | 3.7 |
| zápal hltanu | 18.2 | 16.6 | 9.5 | 9.6 | 5.9 |
| nádcha | 14.5 | 10.9 | 8.8 | 10.5 | 3.0 |
| zápal dutín | 10.3 | 7.4 | 5.4 | 10.0 | 2.3 |
| Poruchy dýchacej sústavy | 7.4 | 4.1 | 6.1 | 10.2 | 1.7 |
| dýchavičnosť | 4.4 | 0.9 | 3.6 | 2.5 | 1.4 |
| Spútum sa zvýšilo | 3.9 | 1.3 | 2.8 | 1.0 | 0.5 |
| bronchitída | 3.2 | 4.1 | 5.4 | 3.9 | 4.0 |
| astma | 1.3 | 1.3 | 2.0 | 2.3 | 0.5 |
| krvácanie z nosa | 1.3 | 0.4 | 1.2 | 0.4 | 0.8 |
| zápal hrtana | 1.1 | 0.4 | 0.5 | 0.4 | 0.3 |
| pneumónia | 0.9 | 1.1 | 0.9 | 1.6 | 0.6 |
| Hlasová úprava | 0.1 | 0.1 | 1.3 | 0.0 | 0.3 |
kašeľ
V 3 klinických štúdiách pacienti, ktorí vyplnili dotazník proti kašľu, uviedli, že kašeľ sa v nich vyskytoval skôr sekúnd až minút po inhalácii Exubery, bol prevažne mierny a v zriedkavých prípadoch bol produktívny prírode. Výskyt tohto kašľa klesal s pokračujúcim používaním Exubery. V kontrolovaných klinických štúdiách 1,2% pacientov prerušilo liečbu Exuberou kvôli kašľu.
dýchavičnosť
Takmer celá (> 97%) dušnosť bola hlásená ako mierna alebo stredne ťažká. Malý počet pacientov liečených Exuberou (0,4%) prerušil liečbu z dôvodu dušnosti v porovnaní s 0,1% pacientov liečených komparátorom.
Iné respiračné nežiaduce účinky - faryngitída, zvýšenie spúta a epistaxa
Väčšina týchto udalostí bola hlásená ako mierna alebo stredne ťažká. Niekoľko pacientov liečených Exuberou prerušilo liečbu kvôli faryngitíde (0,2%) a zvýšilo sa spúta (0,1%); žiadny pacient neprerušil liečbu kvôli epistaxe.
Pľúcna funkcia
Účinok Exubery na dýchací systém bol hodnotený u viac ako 3800 pacientov v kontrolovaných klinických štúdiách fázy 2 a 3 (v ktorých bolo 1977 pacientov liečených Exuberou). V randomizovaných, otvorených klinických štúdiách trvajúcich až do dvoch rokov boli pacienti liečení Exuberou preukázali väčší pokles pľúcnych funkcií, konkrétne núteného výdychového objemu v jednom druhý (FEV1) a kapacita rozptyľovania oxidu uhoľnatého (DLCO) ako u pacientov liečených komparátorom. Priemerné rozdiely v liečebnej skupine pri FEV1 a DLCO, boli zaznamenané v priebehu niekoľkých prvých týždňov liečby Exuberou a počas dvojročného obdobia liečby nepostupovali. V jednej ukončenej kontrolovanej klinickej štúdii u pacientov s diabetom 2. typu po dvoch rokoch liečby Exuberou pacienti preukázali rozlíšenie rozdielu v liečebnej skupine pri FEV1 šesť týždňov po ukončení liečby. Po dlhodobej liečbe sa úcinok Exubery na pľúcne funkcie u pacientov s diabetes mellitus 1. typu nesledoval.
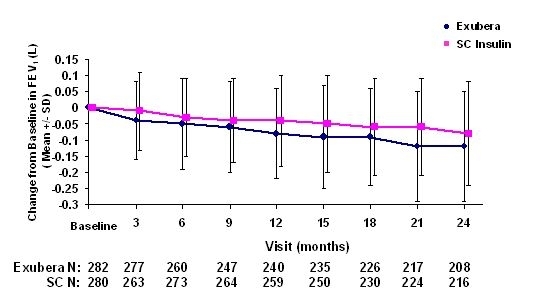
Obrázky 3 až 6 zobrazujú strednú hodnotu FEV1 a DLCO zmena oproti východiskovým hodnotám oproti času z dvoch prebiehajúcich randomizovaných, otvorených, dvojročných štúdií na 580 pacientoch s cukrovkou 1. typu a 620 pacientoch s cukrovkou 2. typu.
Obrázok 3: Zmena oproti východiskovej hodnote FEV1 (L) u pacientov s diabetom 1. typu (priemerná +/- štandardná odchýlka)
Obrázok 4: Zmena oproti východiskovej hodnote FEV1 (L) u pacientov s diabetom 2. typu (priemerná +/- štandardná odchýlka)
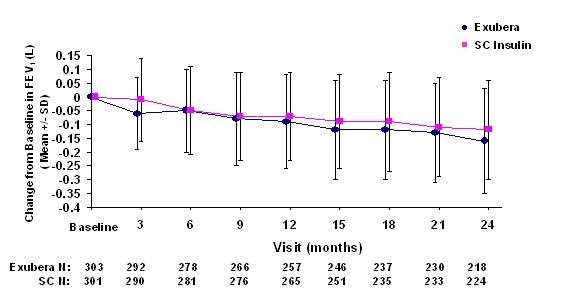
Po 2 rokoch liečby Exuberou u pacientov s cukrovkou 1. a 2. typu je rozdiel medzi liečenými skupinami bola priemerná zmena oproti východiskovej hodnote FEV1 približne 40 ml, čo uprednostňovalo komparátor.
Obrázok 5: Zmena z východiskovej hodnoty DLco (mL / min / mmHg) u pacientov s diabetom 1. typu (priemerná +/- štandardná odchýlka)
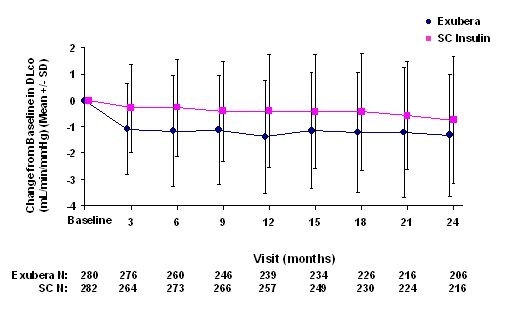
Obrázok 6: Zmena z východiskovej hodnoty DLco (mL / min / mmHg) u pacientov s diabetom 2. typu (priemerná +/- štandardná odchýlka)
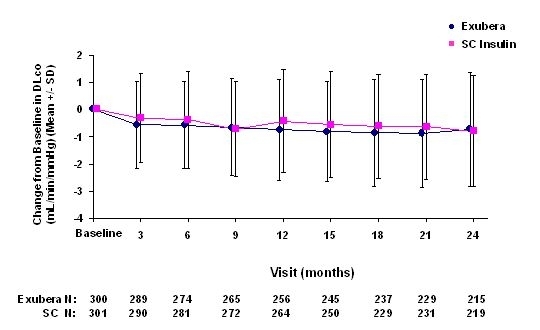
Po 2 rokoch liečby Exuberom je rozdiel medzi liečenými skupinami, pokiaľ ide o priemernú zmenu oproti základnej DLCO bola približne 0,5 ml / min / mmHg (diabetes typu 1), zvýhodňovala komparátor, a približne 0,1 ml / min / mmHg (diabetes typu 2), uprednostňovala Exuberu.
Počas dvojročných klinických skúšok došlo u jednotlivých pacientov k výraznému poklesu pľúcnych funkcií v oboch liečebných skupinách. Pokles oproti východiskovej hodnote FEV1 z 20% pri poslednom pozorovaní sa vyskytlo u 1,5% pacientov liečených Exuberou a 1,3% pacientov liečených komparátorom. Pokles oproti základnej hodnote DLCO z 20% pri poslednom pozorovaní sa vyskytlo u 5,1% pacientov liečených Exuberou a 3,6% pacientov liečených komparátorom.
top
predávkovania
Hypoglykémia sa môže vyskytnúť v dôsledku nadbytku inzulínu v porovnaní s príjmom potravy, výdajom energie alebo oboma spôsobmi.
Mierne až stredne ťažké epizódy hypoglykémie sa zvyčajne môžu liečiť perorálnou glukózou. Môže byť potrebné upraviť dávkovanie liečiva, stravovacie návyky alebo cvičenie.
Závažné epizódy hypoglykémie s kómou, záchvatmi alebo neurologickým poškodením sa môžu liečiť intramuskulárnym / subkutánnym glukagónom alebo koncentrovanou intravenóznou glukózou. Po zjavnom klinickom zotavení môže byť potrebný trvalý príjem sacharidov a ich sledovanie, pretože hypoglykémia sa môže opakovať.
top
Dávkovanie a spôsob podávania
Exubera, podobne ako rýchlo pôsobiace analógy inzulínu, má v porovnaní so subkutánne injikovaným bežným ľudským inzulínom rýchlejší nástup aktivity znižovania glukózy. Exubera má aktivitu znižujúcu hladinu glukózy porovnateľnú s podkožným injekčným podaním bežného ľudského inzulínu a dlhšiu ako rýchlo pôsobiaci inzulín. Dávky Exubery sa majú podávať bezprostredne pred jedlom (nie viac ako 10 minút pred každým jedlom).
U pacientov s cukrovkou 1. typu sa má Exubera používať v režimoch, ktoré zahŕňajú dlhodobo pôsobiaci inzulín. U pacientov s cukrovkou 2. typu sa Exubera môže používať ako monoterapia alebo v kombinácii s perorálnymi liekmi alebo dlhodobo pôsobiacim inzulínom.
Kvôli účinku Exubery na pľúcnu funkciu by všetci pacienti mali mať pľúcnu funkciu vyhodnotenú pred začatím liečby Exuberou. U pacientov liečených Exuberou sa odporúča pravidelné monitorovanie pľúcnych funkcií (pozri časť 6.1) OPATRENIAPľúcna funkcia).
Exubera je určená na podávanie inhaláciou a musí sa podávať iba pomocou Exubery® Inhalátor. Pozri Sprievodca liekmi Exubera popis Exubery® Inhalátor a návod na použitie inhalátora.
Výpočet počiatočnej dávky Exubera pred jedlom
Počiatočná dávka Exubery sa musí individualizovať a určiť na základe rady lekára v súlade s potrebami pacienta. Odporúčané počiatočné dávky pred jedlom sú založené na klinických skúškach, v ktorých boli pacienti požiadaní, aby jedli tri jedlá denne. Počiatočné dávky pred jedlom sa môžu vypočítať podľa tohto vzorca: [telesná hmotnosť (kg) X 0,05 mg / kg = dávka pred jedlom (mg)] zaokrúhlená nadol na najbližšie celé miligramové číslo (napr. 3,7 mg zaokrúhlené nadol na 3 mg).
Približné pokyny pre počiatočné dávky Exubery pred jedlom, založené na telesnej hmotnosti pacienta, sú uvedené v tabuľke 7:
Tabuľka 7: Približné pokyny pre počiatočnú dávku Exubera pred jedlom (na základe telesnej hmotnosti pacienta)
| Hmotnosť pacienta (v kg) |
Hmotnosť pacienta (v librách) |
Počiatočná dávka na jedlo | Počet 1 mg blistrov na dávku | Počet 3 mg blistrov na dávku |
|---|---|---|---|---|
| 30 až 39,9 kg | 66 - 87 libier | 1 mg na jedlo | 1 | - |
| 40 až 59,9 kg | 88 - 132 libier | 2 mg na jedno jedlo | 2 | - |
| 60 až 79,9 kg | 133 - 176 libier | 3 mg na jedno jedlo | - | 1 |
| 80 až 99,9 kg | 177 - 220 libier | 4 mg na jedlo | 1 | 1 |
| 100 až 119,9 kg | 221 až 264 libier | 5 mg na jedno jedlo | 2 | 1 |
| 120 až 139,9 kg | 265 - 308 lb | 6 mg na jedlo | - | 2 |
1 mg blister inhalačného inzulínu Exubera je približne ekvivalentný 3 IU subkutánne injikovaného bežného ľudského inzulínu. 3 mg blister inhalačného inzulínu Exubera je približne ekvivalentný 8 IU subkutánne injikovaného bežného ľudského inzulínu. Tabuľka 8 uvádza približnú IU dávku pravidelného subkutánneho ľudského inzulínu pre inhalačné dávky inzulínu Exubera od 1 mg do 6 mg.
Tabuľka 8: Približná ekvivalentná IU dávka pravidelného ľudského subkutánneho inzulínu pre inhalačné dávky inzulínu Exubera v rozmedzí od 1 mg do 6 mg
| Dávka (mg) | Približná pravidelná dávka inzulínu SC v IU | Počet 1 mg blistrov Exubera na dávku | Počet 3 mg blistrov Exubera na dávku |
|---|---|---|---|
| 1 mg | 3 | 1 | - |
| 2 mg | 6 | 2 | - |
| 3 mg | 8 | - | 1 |
| 4 mg | 11 | 1 | 1 |
| 5 mg | 14 | 2 | 1 |
| 6 mg | 16 | - | 2 |
Pacienti majú kombinovať 1 mg a 3 mg blistre, aby sa užil najmenší počet blistrov na dávku (napr. Dávka 4 mg sa má podať ako jeden blister s obsahom 1 mg a jeden blister s obsahom 3 mg). Následná inhalácia troch blistrov s jednotkovou dávkou 1 mg vedie k významne vyššej expozícii inzulínu ako pri inhalácii jedného blistra s jednotkovou dávkou 3 mg. Preto by sa jedna dávka 3 mg nemala nahrádzať tromi dávkami 1 mg (pozri časť 4.2) KLINICKÁ FARMAKOLÓGIA, Farmakokinetika). Keď je pacient stabilizovaný v dávkovacom režime, ktorý obsahuje 3 mg blistre a 3 mg blistre Ak sa stane dočasne nedostupnou, pacient môže dočasne nahradiť dve 3 mg blistre za jednu 3 mg pľuzgier. Hladina glukózy v krvi by sa mala dôkladne sledovať.
Ako pri všetkých inzulínoch, pri určovaní počiatočnej dávky Exubery by sa mali brať do úvahy aj ďalšie faktory, ale nie sú obmedzené na súčasnú glykemickú kontrolu pacienta, predchádzajúcu reakciu na inzulín, trvanie cukrovky a diétu a cvičenie návyky.
Úvahy o titrácii dávky
Po začatí liečby Exuberou, rovnako ako u iných látok znižujúcich hladinu glukózy, môže byť potrebná úprava dávky na základe potreby pacienta (napr. koncentrácie glukózy v krvi, veľkosť jedla a zloženie živín, denný čas a nedávny alebo očakávaný) cvičenia). Každý pacient by mal byť titrovaný na optimálne dávkovanie na základe výsledkov monitorovania hladiny glukózy v krvi.
Pokiaľ ide o všetky inzulíny, časový priebeh účinku Exubery sa môže líšiť u rôznych jedincov alebo v rôznych časoch u toho istého jedinca.
Exubera sa môže používať počas interkurentného respiračného ochorenia (napr. Bronchitídy, infekcie horných dýchacích ciest, nádchy). Na individuálnom základe môže byť potrebné dôkladné sledovanie koncentrácie glukózy v krvi a úprava dávky. Inhalačné lieky (napr. Bronchodilatátory) sa majú podávať pred podaním Exubery.
top
Ako dodávané
Exubera (ľudský inzulín [pôvod rDNA]) Inhalačný prášok je dostupný v 1 mg a 3 mg blistroch s jednotkovou dávkou. Blistre sa vydávajú na perforované karty so šiestimi jednotkovými blistrami (PVC / hliník). Tieto dve silné stránky sa odlišujú farebnou potlačou a taktilnými značkami, ktoré sa dajú rozlíšiť dotykom. 1 mg blistre a príslušné perforované karty sú vytlačené zeleným atramentom a karty sú označené jednou vyvýšenou čiarou. 3 mg blistre a príslušné perforované karty sú vytlačené modrým atramentom a karty sú označené tromi zvýšenými pruhmi.
Päť blistrov je balených v priehľadnom plastovom (PET) termoformovanom podnose. Každý podnos s PET obsahuje aj sušidlo a je zakrytý priehľadným plastovým (PET) vekom. Podnos piatich blistrov (30 blistrov s jednotkovou dávkou) je utesnený vo fóliovom laminátovom vrecku s vysušovadlom.
Exubera (ľudský inzulín [pôvod rDNA]) Inhalačné pľuzgiere na prášok, Exubera® Inhalátor a náhrada Exubera® Uvoľňovacie jednotky sú potrebné na začatie liečby Exuberou a sú súčasťou súpravy Exubera. Kompletne zostavená Exubera® Inhalátor pozostáva zo základne inhalátora, komory a Exubery® Uvoľnite jednotku. Plne zostavený inhalátor je balený s náhradnou komorou a je k dispozícii v súprave Exubera a ako samostatná jednotka. Komora je k dispozícii aj ako samostatná zložka.
Exubera® Uvoľňovacie jednotky sú jednotlivo balené v utesnenom termoformovanom zásobníku. Jedna Exubera® Uvoľňovacia jednotka je súčasťou každého kompletne zostaveného inhalátora. V súprave Exubera av každom kombinovanom balení sú dve ďalšie uvoľňovacie jednotky. Vydávacie jednotky Exubera sú k dispozícii aj jednotlivo.
Opis týchto konfigurácií nájdete v tabuľkách 9 a 10.
Tabuľka 9
| Exubera (ľudský inzulín [pôvod rDNA]) Inhalačný prášok je k dispozícii takto: | ||
|---|---|---|
| popis | obsah | NDC |
| Exubera KIT | 1 Exubera Inhaler 1 Náhradná komora 1 mg x 180 blistrov 3 mg x 90 blistrov 2 Exubera® Uvoľnenie jednotiek |
0069-0050-85 |
| Kombinácia balenia Exubera 12 | 1 mg x 90 blistrov 3 mg x 90 blistrov 2 Exubera® Uvoľnenie jednotiek |
0069-0050-19 |
| Kombinácia balenia Exubera 15 | 1 mg x 180 blistrov 3 mg x 90 blistrov 2 Exubera® Uvoľnenie jednotiek |
0069-0050-53 |
| Balenie pre pacienta 1 mg Exubera | 90 — - 1 mg 2 Exubera® Uvoľnenie jednotiek |
0069-0707-37 |
| Balenie pre pacienta Exubera 3 mg | 90 až 3 mg 2 Exubera® Uvoľnenie jednotiek |
0069-0724-37 |
Tabuľka 10
| Exubera® Inhalátor a komponenty sú k dispozícii takto: | ||
|---|---|---|
| popis | obsah | NDC |
| Exubera® Inhalátor a komora | 1 Exubera® inhalátor 1 Náhradná komora |
0069-0054-19 |
| Exubera® Uvoľnenie jednotiek | 2 Exubera® Uvoľnenie jednotiek | 0069-0097-41 |
| Exubera® komora | 1 Náhradná komora | 0069-0061-19 |
Ukladanie blistrov
Nepoužívané (neotvorené): Uchovávajte pri kontrolovanej izbovej teplote, 25 ° C (77 ° F); odchýlky povolené na 15 - 30 ° C (pozri regulovanú izbovú teplotu USP). Neuchovávajte v mrazničke. Neuchovávajte v chladničke.
Použitie: Po otvorení obalovej fólie by sa pľuzgiere s jednotkovou dávkou mali chrániť pred vlhkosťou a uchovávať pri 25 ° C; odchýlky povolené na 15 - 30 ° C (pozri regulovanú izbovú teplotu USP). Neuchovávajte v mrazničke. Neuchovávajte v chladničke. Blistre s jednotkovou dávkou sa majú použiť do 3 mesiacov po otvorení prebalu fólie. Vráťte pľuzgiere do prebalu, aby ste ich chránili pred vlhkosťou. Ďalšia pozornosť by sa mala venovať tomu, aby sa zabránilo vlhkým prostrediam, napr. zaparená kúpeľňa po sprche.
Zlikvidujte blister, ak je zmrazený.
Uchovávanie inhalátora
Skladujte pri kontrolovanej izbovej teplote, 25 ° C (77 ° F); odchýlky povolené na 15 - 30 ° C (pozri regulovanú izbovú teplotu USP). Neuchovávajte v mrazničke. Neuchovávajte v chladničke.
Exubera® Inhalátor sa môže používať až 1 rok od dátumu prvého použitia.
Výmena zariadenia Exubera® Uvoľnite jednotku
Exubera® Uvoľnite jednotku v Exubere® Inhalátor sa má vymieňať každé 2 týždne.
Uchovávajte mimo dosahu detí
Iba Rx

LAB-0331 - 12,0
posledná revízia 04/2008
Exubera, ľudský inzulín [pôvod rDNA] Informácie o pacientovi (v jednoduchej angličtine)
Podrobné informácie o príznakoch, príznakoch, príčinách, liečbe cukrovky
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
späť k: Prejdite si všetky lieky na diabetes



