Janumet na liečbu cukrovky
Názov značky: Janumet
Všeobecný názov: sitagliptín a hydrochlorid metformínu
obsah:
Indikácie a použitie
Dávkovanie a spôsob podávania
Dávkové formy a sily
kontraindikácie
Varovania a bezpečnostné opatrenia
Nežiaduce reakcie
Liekové interakcie
Použitie v špecifických populáciách
predávkovať
popis
farmakológia
Neklinická toxikológia
Klinické štúdie
Ako dodávané
Informácie o poradenstve pre pacientov
Janumet, sitagliptín a metformín hydrochlorid, informácie o pacientovi (v jednoduchej angličtine)
VAROVANIE: Laktická kyslosť
Laktátová acidóza je zriedkavá, ale závažná komplikácia, ktorá sa môže vyskytnúť v dôsledku akumulácie metformínu. Riziko sa zvyšuje s podmienkami, ako sú sepsa, dehydratácia, nadmerný príjem alkoholu, hepatálna insuficiencia, poškodenie obličiek a akútne kongestívne zlyhanie srdca.
Nástup je často jemný, sprevádzaný iba nešpecifickými symptómami, ako sú malátnosť, myalgia, respiračná tieseň, zvýšenie ospalosti a nešpecifická brušná tieseň. Laboratórne abnormality zahŕňajú nízke pH, zvýšenú aniónovú medzeru a zvýšenú hladinu laktátu v krvi.
Ak existuje podozrenie na acidózu, Janumet1 sa má prerušiť a pacient musí byť okamžite hospitalizovaný. [See Varovania a bezpečnostné opatrenia]
Indikácie a použitie
Janumet je indikovaný ako doplnok k diéte a cvičeniu na zlepšenie kontroly glykémie u dospelých s diabetes mellitus 2. typu, ak je vhodná liečba sitagliptínom a metformínom. [See Klinické štúdie.]
Dôležité obmedzenia použitia
Liek Janumet by nemali užívať pacienti s diabetom 1. typu alebo na liečbu diabetickej ketoacidózy, pretože by v týchto podmienkach nebola účinná.
Janumet sa neskúmal v kombinácii s inzulínom.
top
Dávkovanie a spôsob podávania
Odporúčané dávkovanie
Dávka antihyperglykemickej liečby Janumetom by mala byť individualizovaná na základe súčasného režimu pacienta, účinnosť a znášanlivosť, pričom sa neprekročí maximálna odporúčaná denná dávka 100 mg sitagliptínu a 2 000 mg metformín. Počiatočná kombinovaná terapia alebo udržiavanie kombinovanej terapie by sa malo individualizovať a malo by byť ponechané na uváženie poskytovateľa zdravotnej starostlivosti.
Janumet sa má obvykle podávať dvakrát denne s jedlom, s postupným zvyšovaním dávky, aby sa znížili gastrointestinálne (GI) vedľajšie účinky v dôsledku metformínu.
Počiatočná dávka Janumetu by mala vychádzať z aktuálneho režimu pacienta. Janumet sa má podávať dvakrát denne s jedlom. K dispozícii sú nasledujúce dávky:
50 mg sitagliptínu / 500 mg metformíniumchloridu
50 mg sitagliptínu / 1 000 mg metformíniumchloridu.
Pacienti nedostatočne kontrolovaní diétou a cvičením sami
Ak sa terapia kombinovanou tabletou obsahujúcou sitagliptín a metformín považuje za vhodnú pre pacienta s diabetes mellitus 2. typu pri nedostatočnej kontrole samotnou diétou a cvičením je odporúčaná počiatočná dávka 50 mg sitagliptínu / 500 mg metformíniumchloridu dvakrát. denne. Pacienti s nedostatočnou glykemickou kontrolou tejto dávky môžu byť titrovaní až do 50 mg sitagliptínu / 1 000 mg metformíniumchloridu dvakrát denne.
Pacienti nedostatočne kontrolovaní monoterapiou metformínom
Ak sa liečba kombinovanou tabletou obsahujúcou sitagliptín a metformín považuje za vhodnú pre pacienta, ktorý nie je dostatočne kontrolovaný samotným metformínom, odporúčaná počiatočná dávka Janumetu by mala poskytovať sitagliptín dávkovaný ako 50 mg dvakrát denne (celková denná dávka 100 mg) a dávka metformínu už je prijatá. U pacientov užívajúcich 850 mg metformínu dvakrát denne je odporúčaná počiatočná dávka Janumetu 50 mg sitagliptínu / 1 000 mg metformíniumchloridu dvakrát denne.
Pacienti nedostatočne kontrolovaní monoterapiou sitagliptínom
Ak sa terapia kombinovanou tabletou obsahujúcou sitagliptín a metformín považuje za primeranú pre pacienta, je neprimeraná pri kontrole samotným sitagliptínom je odporúčaná počiatočná dávka Janumetu 50 mg sitagliptínu / 500 mg metformíniumchloridu dvakrát. denne. Pacienti s nedostatočnou kontrolou tejto dávky môžu byť titrovaní až do 50 mg sitagliptínu / 1 000 mg metformíniumchloridu dvakrát denne. U pacientov užívajúcich monoterapiu sitagliptínu upravenú o dávku z dôvodu renálnej insuficiencie sa nemá prejsť na liek Janumet [pozri kontraindikácie].
Pacienti prechádzajú zo súbežného podávania sitagliptínu a metformínu
U pacientov, ktorí prechádzajú zo sitagliptínu súbežne podávaného s metformínom, sa Janumet môže začať dávkou sitagliptínu a už podávaného metformínu.
Pacienti s nedostatočnou kontrolou na duálnej kombinovanej liečbe s akýmikoľvek dvoma z nasledujúcich antihyperglykemických látok: sitagliptín, metformín alebo sulfonylmočovina
Ak sa v tomto prípade považuje liečba kombinovanou tabletou obsahujúcou sitagliptín a metformín Zvyčajná počiatočná dávka Janumetu by mala poskytovať sitagliptín podávaný v dávke 50 mg dvakrát denne (celkovo 100 mg) denná dávka). Pri určovaní počiatočnej dávky metformínovej zložky by sa mala zvážiť hladina glykemickej kontroly pacienta a aktuálna dávka (ak existuje) metformínu. Malo by sa zvážiť postupné zvyšovanie dávky na zníženie gastrointestinálnych (GI) vedľajších účinkov spojených s metformínom. Pacienti, ktorí v súčasnosti začínajú alebo začínajú sulfonylmočovinu, môžu na zníženie rizika hypoglykémie vyžadovať nižšie dávky sulfonylmočoviny [pozri Varovania a bezpečnostné opatrenia].
Neuskutočnili sa žiadne štúdie, ktoré by špecificky skúmali bezpečnosť a účinnosť Janumetu u pacientov predtým liečených inými perorálnymi antihyperglykemikami a prešli na Janumet. Akákoľvek zmena v terapii diabetu typu 2 by sa mala vykonávať opatrne a vhodným monitorovaním, pretože môžu nastať zmeny v glykemickej kontrole.
top
Dávkové formy a sily
- 50 mg / 500 mg tablety sú svetloružové, filmom obalené tablety v tvare kapsuly s vyrazením „575“ na jednej strane.
- 50 mg / 1 000 mg tablety sú červené filmom obalené tablety v tvare kapsuly s vyrazením „577“ na jednej strane.
top
kontraindikácie
Janumet (sitagliptín / metformín HCl) je kontraindikovaný u pacientov s:
- Ochorenie obličiek alebo renálna dysfunkcia, ako napríklad naznačujú hladiny kreatinínu v sére 1,5 mg / dl [muži], 1,4 mg / dl [ženy] alebo abnormálne klírens kreatinínu, ktorý môže byť tiež dôsledkom stavov, ako je kardiovaskulárny kolaps (šok), akútny infarkt myokardu a septikémia [pozri Varovania a bezpečnostné opatrenia].
- Akútna alebo chronická metabolická acidóza vrátane diabetickej ketoacidózy, s kómou alebo bez kómy.
- Anamnéza závažnej reakcie z precitlivenosti na Janumet alebo sitagliptín (jedna zo zložiek Janumetu), ako je anafylaxia alebo angioedém. [See Varovania a bezpečnostné opatrenia a Nežiaduce reakcie.]
Liek Janumet sa má dočasne vysadiť u pacientov, ktorí sa podrobujú rádiologickým štúdiám zahŕňajúcim intravaskulárny systém podávanie jódových kontrastných materiálov, pretože použitie takýchto produktov môže viesť k akútnej zmene obličiek funkcia [pozri Varovania a bezpečnostné opatrenia].
top
Varovania a bezpečnostné opatrenia
Laktátová acidóza
Hydrochlorid metformínu
Laktátová acidóza je zriedkavá, ale závažná metabolická komplikácia, ktorá sa môže vyskytnúť v dôsledku akumulácie metformínu počas liečby liekom Janumet; keď sa vyskytne, je smrteľný v približne 50% prípadov. Laktátová acidóza sa môže vyskytnúť aj v súvislosti s celým radom patofyziologických stavov, vrátane diabetes mellitus, a vždy, keď existuje významná tkanivová hypoperfúzia a hypoxémia. Laktátová acidóza sa vyznačuje zvýšenými hladinami laktátu v krvi (> 5 mmol / l), zníženým pH krvi, poruchami elektrolytov so zvýšenou aniónovou medzerou a zvýšeným pomerom laktát / pyruvát. Ak je metformín implikovaný ako príčina laktátovej acidózy, všeobecne sa zistia plazmatické hladiny metformínu> 5 μg / ml.
Hlásený výskyt laktátovej acidózy u pacientov dostávajúcich metformíniumchlorid je veľmi nízky (približne 0,03 prípadov / 1 000 pacientorokov, s približne 0,015 fatálnymi prípadmi / 1 000 pacient-rokov). Vo viac ako 20 000 pacientorokových expozíciách metformínu v klinických skúšaniach neboli hlásené žiadne prípady laktátovej acidózy. Hlásené prípady sa vyskytli predovšetkým u diabetických pacientov so signifikantnou renálnou insuficienciou, vrátane intrinzickej renálnej insuficiencie choroba a obličková hypoperfúzia, často pri vzniku viacerých sprievodných lekárskych / chirurgických problémov a viacpočetných sprievodných ochorení lieky. Pacienti s kongestívnym zlyhaním srdca, ktorí potrebujú farmakologický manažment, najmä tí, ktorí sú nestabilní alebo akútne kongestívne zlyhanie srdca, ktoré je vystavené riziku hypoperfúzie a hypoxémie, má zvýšené riziko laktátu acidóza. Riziko laktátovej acidózy sa zvyšuje so stupňom renálnej dysfunkcie a s vekom pacienta. Riziko laktátovej acidózy sa preto môže významne znížiť pravidelným monitorovaním renálnych funkcií u pacientov užívajúcich metformín a použitím minimálnej účinnej dávky metformínu. Liečba starších pacientov by mala byť sprevádzaná najmä starostlivým monitorovaním funkcie obličiek. Liečba metformínom sa nemá začať u pacientov vo veku 80 rokov, pokiaľ sa nezmeria klírens kreatinínu ukazuje, že funkcia obličiek nie je znížená, pretože títo pacienti sú náchylnejší na vznik laktátovej acidózy. Okrem toho by sa mal metformín okamžite zadržať v prítomnosti akýchkoľvek stavov spojených s hypoxémiou, dehydratáciou alebo sepsou. Pretože zhoršená funkcia pečene môže významne obmedziť schopnosť čistiť laktát, u pacientov s klinickým alebo laboratórnym dôkazom ochorenia pečene by sa mal metformín vo všeobecnosti vyhnúť. Pri užívaní metformínu je potrebné pacientov upozorniť na nadmerný príjem alkoholu, či už akútny alebo chronický, pretože alkohol zosilňuje účinky metformíniumchloridu na metabolizmus laktátu. Okrem toho sa má metformín dočasne prerušiť pred akoukoľvek intravaskulárnou rádiokontrastnou štúdiou a pred akýmkoľvek chirurgickým zákrokom [pozri Varovania a bezpečnostné opatrenia].
Nástup laktátovej acidózy je často jemný a sprevádzaný iba nešpecifickými príznakmi, ako sú malátnosť, myalgia, respiračná tieseň, zvýšená ospalosť a nešpecifická brušná úzkosť. Môžu byť spojené s podchladením, hypotenziou a rezistentnými bradyarytmiami s výraznejšou acidózou. Pacient a lekár pacienta si musia byť vedomí možnej dôležitosti takýchto príznakov a pacient by mal byť poučený, aby okamžite informoval lekára, ak sa vyskytnú [pozri Varovania a bezpečnostné opatrenia]. Metformín sa má vysadiť, až kým sa situácia neobjasní. Užitočné môžu byť elektrolyty v sére, ketóny, glukóza v krvi, a ak je to uvedené, pH krvi, hladiny laktátu a dokonca aj hladiny metformínu v krvi. Keď sa pacient stabilizuje na akejkoľvek dávkovej hladine metformínu, je nepravdepodobné, že by gastrointestinálne príznaky, ktoré sú bežné na začiatku liečby, súviseli s liekom. Neskorší výskyt gastrointestinálnych príznakov môže byť spôsobený laktátovou acidózou alebo iným závažným ochorením.
Hladiny laktátu nalačno v plazme nalačno nad hornou hranicou normálu, ale nižšou ako 5 mmol / l u pacientov užívajúcich metformín, nemusia nevyhnutne naznačovať hroziace laktátové acidóza a dá sa vysvetliť inými mechanizmami, ako je zle kontrolovaná cukrovka alebo obezita, intenzívna fyzická aktivita alebo technické problémy pri manipulácii so vzorkou [pozri Varovania a bezpečnostné opatrenia].
U každého diabetického pacienta s podozrením na ketoacidózu (ketonúria a ketonémia) by sa malo vyskytnúť podozrenie na laktátovú acidózu.
Laktátová acidóza je lekárska pohotovosť, ktorá sa musí liečiť v nemocničnom prostredí. U pacientov s laktátovou acidózou, ktorí užívajú metformín, sa má liek okamžite vysadiť a okamžite by sa mali zaviesť všeobecné podporné opatrenia. Pretože hydrochlorid metformínu je dialyzovateľný (s klírensom až 170 ml / min pri dobrej hemodynamike) podmienky), odporúča sa okamžitá hemodialýza na korekciu acidózy a odstránenie nahromadených metformín. Takéto riadenie často vedie k okamžitému zvráteniu príznakov a uzdraveniu [pozri kontraindikácie; Varovania a bezpečnostné opatrenia].
Poškodená funkcia pečene
Keďže zhoršená funkcia pečene bola spojená s niektorými prípadmi laktátovej acidózy, Janumet by sa mal všeobecne vyhnúť pacientom s klinickými alebo laboratórnymi dôkazmi ochorenia pečene.
Posúdenie funkcie obličiek
Je známe, že metformín a sitagliptín sa vylučujú obličkami. Riziko hromadenia metformínu a laktátovej acidózy sa zvyšuje so stupňom poškodenia funkcie obličiek. Pacienti s hladinami kreatinínu v sére nad hornou hranicou normy pre ich vek by preto nemali dostávať Janumet. U starších pacientov sa Janumet má starostlivo titrovať, aby sa stanovila minimálna dávka na primeraný glykemický účinok, pretože starnutie môže byť spojené so zníženou funkciou obličiek. [See Varovania a bezpečnostné opatrenia a Použitie v špecifických populáciách.]
Pred začatím liečby liekom Janumet a potom najmenej raz ročne by sa mala obličková funkcia vyhodnotiť a overiť ako normálna. U pacientov, u ktorých sa predpokladá vývoj renálnej dysfunkcie, najmä u starších pacientov, obličiek Funkcie sa majú hodnotiť častejšie a Janumet sa má vysadiť, ak existuje dôkaz o poškodení funkcie obličiek prítomná.
Vitamín B12 úrovne
V kontrolovaných klinických skúšaniach s metformínom trvajúcim 29 týždňov, pokles na subnormálne hladiny predtým normálneho sérového vitamínu B12 hladiny, bez klinických prejavov, sa pozorovali približne u 7% pacientov. Takéto zníženie, pravdepodobne v dôsledku interferencie s B12 absorpcia z B12komplex komplexu vnútorných faktorov je však veľmi zriedkavo spojený s anémiou a zdá sa, že je rýchlo reverzibilný po prerušení liečby metformínom alebo vitamínom B12 suplementácia. U pacientov užívajúcich liek Janumet sa odporúča každoročné meranie hematologických parametrov a všetky zjavné abnormality sa musia náležite vyšetriť a liečiť. [See Nežiaduce reakcie.]
Niektorí jednotlivci (osoby s nedostatočným vitamínom B12 alebo príjem alebo absorpcia vápnika) sa zdá byť náchylný na vývoj subnormálneho vitamínu B12 úrovniach. U týchto pacientov rutinné sérové vitamín B12 užitočné môžu byť merania v dvoj- až trojročných intervaloch.
Príjem alkoholu
Je známe, že alkohol zosilňuje účinok metformínu na metabolizmus laktátu. Pacienti by preto mali byť počas liečby Janumetom upozornení na nadmerný príjem alkoholu, akútny alebo chronický.
Chirurgické postupy
Použitie Janumetu sa má dočasne prerušiť z dôvodu chirurgického zákroku (s výnimkou menších zákrokov, ktoré nie sú spojené s obmedzeným príjmom) potravín a tekutín) a nemalo by sa obnoviť, kým sa neobnoví perorálny príjem pacienta a kým sa nevyhodnotí funkcia obličiek normálu.
Zmena klinického stavu pacientov s predtým kontrolovanou cukrovkou 2. typu
U pacienta s cukrovkou 2. typu, ktorý bol predtým dobre kontrolovaný liekom Janumet a u ktorého sa vyvinuli laboratórne abnormality alebo klinický obraz choroba (najmä neurčitá a zle definovaná choroba) by sa mala okamžite vyhodnotiť na základe dôkazov o ketoacidóze alebo laktácii. acidóza. Vyhodnotenie by malo zahŕňať sérové elektrolyty a ketóny, glukózu v krvi a, ak je to uvedené, pH krvi, hladiny laktátu, pyruvátu a metformínu. Ak dôjde k acidóze ktorejkoľvek formy, Janumet sa musí okamžite zastaviť a musia sa začať ďalšie vhodné nápravné opatrenia.
Používajte s liekmi, o ktorých je známe, že spôsobujú hypoglykémiu
sitagliptín
Ako je typické u iných antihyperglykemických látok používaných v kombinácii so sulfonylmočovinou, keď sa sitagliptín použil v kombinácii s metformínom a sulfonylmočovina, liek, o ktorom je známe, že spôsobuje hypoglykémiu, sa výskyt hypoglykémie zvýšil v porovnaní s placebom v kombinácii s metformínom a sulfonylmočovina [pozri Nežiaduce reakcie]. Preto pacienti, ktorí tiež dostávajú sekretagog inzulínu (napr. Sulfonylmočovina, meglitinid), môžu na zníženie rizika hypoglykémie vyžadovať nižšiu dávku inzulínového sekretagogu [pozri Dávkovanie a spôsob podávania].
Hydrochlorid metformínu
Hypoglykémia sa nevyskytuje u pacientov, ktorí dostávajú metformín samotný za obvyklých okolností použitia, ale môže sa vyskytnúť, keď je kalorický príjem nedostatočný, keď namáhavé cvičenie nie je kompenzované kalorickým doplnením alebo počas súbežného používania s inými látkami znižujúcimi hladinu glukózy (ako sú sulfonylmočoviny a inzulín) alebo etanol. Starší pacienti, oslabení alebo podvyživení pacienti a pacienti s adrenálnou alebo hypofýzou alebo intoxikáciou alkoholom sú obzvlášť náchylní na hypoglykemické účinky. Hypoglykémia môže byť ťažko rozpoznateľná u starších ľudí au ľudí, ktorí užívajú lieky blokujúce adrenergiu.
Sprievodné lieky ovplyvňujúce funkciu obličiek alebo dispozíciu metformínu
Sprievodné lieky, ktoré môžu ovplyvniť funkciu obličiek alebo spôsobiť alebo môžu mať za následok významnú hemodynamickú zmenu interferujú s dispozíciou metformínu, ako sú katiónové lieky, ktoré sú vylučované renálnou tubulárnou sekréciou [pozri Liekové interakcie], by sa mali používať opatrne.
Radiologické štúdie s intravaskulárnymi jódovými kontrastnými látkami
Intravaskulárne kontrastné štúdie s jódovými materiálmi (napríklad intravenózny urogram, intravenózna cholangiografia, angiografia a snímky počítačovej tomografie (CT)) s intravaskulárnymi kontrastnými látkami) môže viesť k akútnej zmene funkcie obličiek a môže byť spojená s laktátovou acidózou u pacientov liečených metformínom [pozri kontraindikácie]. Preto u pacientov, u ktorých je takáto štúdia plánovaná, sa má Janumet dočasne vysadiť v čase alebo pred začiatkom liečby. po 48 hodinách od zákroku a obnovená až po opätovnom vyhodnotení funkcie obličiek a zistení, že byť normálny.
Hypoxické štáty
Kardiovaskulárny kolaps (šok) z akejkoľvek príčiny, akútne kongestívne zlyhanie srdca, akútny infarkt myokardu a s laktátovou acidózou sú spojené aj ďalšie stavy charakterizované hypoxémiou a môžu tiež spôsobiť prerenal azotémia. Ak sa takéto udalosti vyskytnú u pacientov liečených Janumetom, liek sa musí okamžite vysadiť.
Strata kontroly nad hladinou glukózy v krvi
Ak je pacient stabilizovaný akýmkoľvek diabetickým režimom vystavený stresu, ako je horúčka, trauma, infekcia alebo chirurgický zákrok, môže sa vyskytnúť dočasná strata glykemickej kontroly. V takomto prípade môže byť potrebné Janumet zadržať a dočasne podať inzulín. Po odstránení akútnej epizódy sa môže Janumet obnoviť.
Reakcie z precitlivenosti
U pacientov liečených sitagliptínom, jednou zo zložiek lieku Janumet, boli hlásené postmarketingové hlásenia o závažných reakciách z precitlivenosti. Tieto reakcie zahŕňajú anafylaxiu, angioedém a exfoliatívne kožné stavy vrátane Stevensovho-Johnsonovho syndrómu. Pretože tieto reakcie sú hlásené dobrovoľne z populácie neistej veľkosti, je to spravidla nie je možné spoľahlivo odhadnúť ich frekvenciu alebo zistiť príčinnú súvislosť s vystavením drogám. Nástup týchto reakcií sa objavil počas prvých 3 mesiacov po začatí liečby sitagliptínom, pričom niektoré hlásenia sa objavili po prvej dávke. Ak existuje podozrenie na reakciu z precitlivenosti, prerušte liečbu Janumetom, vyhodnotte ďalšie možné príčiny udalosti a začnite alternatívnu liečbu cukrovky. [See Nežiaduce reakcie.]
Makrovaskulárne výsledky
Neuskutočnili sa žiadne klinické štúdie, ktoré by preukázali presvedčivé dôkazy o znížení makrovaskulárneho rizika s Janumetom alebo akýmkoľvek iným antidiabetickým liekom.
top
Nežiaduce reakcie
Skúsenosti s klinickými testami
Pretože klinické skúšky sa uskutočňujú za veľmi premenlivých podmienok, miera nežiaducich reakcií pozorovaná v klinických skúškach podľa a liek sa nedá priamo porovnávať s mierami v klinických skúškach s iným liekom a nemusí odrážať hodnoty pozorované v roku 2006 cvičiť.
Súbežné podávanie sitagliptínu a metformínu u pacientov s diabetom 2. typu nedostatočne kontrolovanými diétou a cvičením
Tabuľka 1 sumarizuje najčastejšie hlásené (â ‰ ¥ 5% pacientov) hlásené nežiaduce účinky (bez ohľadu na hodnotenie príčinnosti výskumníkom) za 24 týždňov placebom kontrolovaná faktoriálna štúdia, v ktorej sa sitagliptín a metformín podávali súčasne pacientom s cukrovkou 2. typu nedostatočne kontrolovanou stravou a cvičenie.
Tabuľka 1: Sitagliptín a metformín súbežne podávané pacientom s diabetom 2. typu nedostatočne kontrolovanými diétou a cvičením: Nežiaduce reakcie Hlásené (bez ohľadu na hodnotenie kauzality skúšajúcim) u 5% pacientov, ktorí dostávajú kombinovanú liečbu (a vyššie ako u pacientov, ktorí dostávajú kombinovanú liečbu) Placebo) *
| Počet pacientov (%) | ||||
placebo |
sitagliptín 100 mg QD |
Metformín 500 mg / Metformín 1 000 mg dvakrát denne†|
sitagliptín 50 mg bid + Metformín 500 mg / Metformín 1 000 mg dvakrát denne†|
|
| N = 176 | N = 179 | N = 364†| N = 372†| |
| ||||
| Hnačka | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) |
| Infekcia horných dýchacích ciest | 9 (5.1) | 8 (4.5) | 19 (5.2) | 23 (6.2) |
| bolesť hlavy | 5 (2.8) | 2 (1.1) | 14 (3.8) | 22 (5.9) |
Doplnková liečba sitagliptínom u pacientov s diabetom 2. typu nedostatočne kontrolovaná na metformíne samotnom
V 24-týždňovej placebom kontrolovanej štúdii so 100 mg sitagliptínu podávaného jedenkrát denne do režimu metformínu podávaného dvakrát denne sa nezistili žiadne nežiaduce reakcie hlásené bez ohľadu na hodnotenie kauzality skúšajúcim u 5% pacientov a častejšie ako u pacientov, ktorí dostali placebo. Ukončenie liečby z dôvodu klinických nežiaducich reakcií bolo podobné ako v skupine liečenej placebom (sitagliptín a metformín, 1,9%; placebo a metformín, 2,5%).
hypoglykémie
Nežiaduce reakcie hypoglykémie boli založené na všetkých správach o hypoglykémii; nebolo potrebné súčasné meranie glukózy. Celkový výskyt vopred špecifikovaných nežiaducich účinkov hypoglykémie u pacientov s diabetom 2. typu nedostatočne kontrolovaných diétou a cvičením bol 0,6% u pacienti dostávajúci placebo, 0,6% u pacientov, ktorí dostávali samotný sitagliptín, 0,8% u pacientov, ktorí dostávali samotný metformín, a 1,6% u pacientov, ktorí dostávali sitagliptín v kombinácii s metformín. U pacientov s diabetom 2. typu nedostatočne kontrolovaným samotným metformínom je celkový výskyt nežiaducich účinkov reakcie hypoglykémie boli 1,3% u pacientov, ktorí dostávali prídavný sitagliptín, a 2,1% u pacientov, ktorí dostávali prídavný sitagliptín placebo.
Gastrointestinálne nežiaduce reakcie
Výskyt vopred vybraných gastrointestinálnych nežiaducich účinkov u pacientov liečených sitagliptínom a metformínom bol podobný ako u pacientov liečených samotným metformínom. Pozri tabuľku 2.
Tabuľka 2: Predvolené gastrointestinálne nežiaduce reakcie (bez ohľadu na hodnotenie kauzality výskumného pracovníka) hlásené u pacientov s diabetom 2. typu, ktorí dostávajú sitagliptín a metformín.
| Počet pacientov (%) | ||||||
| Štúdium sitagliptínu a metformínu u pacientov s nedostatočnou kontrolou o diéte a cvičení |
Štúdia doplnku sitagliptínu u pacientov s nedostatočnou kontrolou na metformíne samotnom | |||||
placebo |
sitagliptín 100 mg QD |
Metformín 500 mg / Metformín 1 000 mg dvakrát denne* |
sitagliptín 50 mg bid + Metformín 500 mg / Metformín 1 000 mg dvakrát denne* |
Placebo a Metformin - 1500 mg denne |
Sitagliptín 100 mg QD a metformín - 1500 mg denne |
|
| N = 176 | N = 179 | N = 364 | N = 372 | N = 237 | N = 464 | |
| ||||||
| Hnačka | 7 (4.0) | 5 (2.8) | 28 (7.7) | 28 (7.5) | 6 (2.5) | 11 (2.4) |
| nevoľnosť | 2 (1.1) | 2 (1.1) | 20 (5.5) | 18 (4.8) | 2 (0.8) | 6 (1.3) |
| zvracanie | 1 (0.6) | 0 (0.0) | 2 (0.5) | 8 (2.2) | 2 (0.8) | 5 (1.1) |
| Bolesť brucha†| 4 (2.3) | 6 (3.4) | 14 (3.8) | 11 (3.0) | 9 (3.8) | 10 (2.2) |
Sitagliptín v kombinácii s metformínom a glimepiridom
V 24-týždňovej placebom kontrolovanej štúdii so 100 mg sitagliptínu ako doplnkovej liečby u pacientov s diabetom 2. typu nedostatočne kontrolovaným metformínom a glimepiridom (sitagliptín, N = 116; placebo, N = 113), nežiaduce reakcie boli hlásené bez ohľadu na hodnotenie kauzality u 5% pacientov. liečení sitagliptínom a častejšie ako u pacientov liečených placebom boli: hypoglykémia (sitagliptín, 16,4%; placebo, 0,9%) a bolesti hlavy (6,9%, 2,7%).
Pri kombinácii sitagliptínu a metformínu sa nepozorovali žiadne klinicky významné zmeny vitálnych znakov alebo EKG (vrátane QTc intervalu).
Najčastejšie nepriaznivé skúsenosti s monoterapiou sitagliptínom boli hlásené bez ohľadu na skúšajúceho hodnotenie kauzality u 5% pacientov a častejšie ako u pacientov, ktorým bolo podávané placebo, bolo zápal nosohltanu.
Najčastejšie (> 5%) zistené nežiaduce reakcie v dôsledku začatia liečby metformínom sú hnačka, nevoľnosť / zvracanie, plynatosť, bolesti brucha, poruchy trávenia, asténia a bolesti hlavy.
Laboratórne testy
sitagliptín
Výskyt laboratórnych nežiaducich reakcií bol podobný u pacientov liečených sitagliptínom a metformínom (7,6%) v porovnaní s pacientmi liečenými placebom a metformínom (8,7%). Vo väčšine, ale nie vo všetkých štúdiách, malé zvýšenie počtu bielych krviniek (rozdiel približne 200 buniek / mikroL vo WBC verzus placebo; priemerná východisková hodnota WBC približne 6600 buniek / mikroL) bola pozorovaná kvôli malému zvýšeniu neutrofilov. Táto zmena laboratórnych parametrov sa nepovažuje za klinicky relevantnú.
Hydrochlorid metformínu
V kontrolovaných klinických skúšaniach s metformínom trvajúcim 29 týždňov, pokles na subnormálne hladiny predtým normálneho sérového vitamínu B12 hladiny, bez klinických prejavov, sa pozorovali približne u 7% pacientov. Takéto zníženie, pravdepodobne v dôsledku interferencie s B12 absorpcia z B12komplex komplexu vnútorných faktorov je však veľmi zriedkavo spojený s anémiou a zdá sa, že je rýchlo reverzibilný po prerušení liečby metformínom alebo vitamínom B12 suplementácia. [See Varovania a bezpečnostné opatrenia.]
Postmarketingové skúsenosti
Nasledujúce ďalšie nežiaduce reakcie sa zistili počas post-schvaľovacieho použitia Janumetu alebo sitagliptínu, jednej zo zložiek lieku Janumet. Pretože tieto reakcie sú hlásené dobrovoľne z populácie neistej veľkosti, je to spravidla nie je možné spoľahlivo odhadnúť ich frekvenciu alebo zistiť príčinnú súvislosť s vystavením drogám.
Medzi reakcie z precitlivenosti patrí anafylaxia, angioedém, vyrážka, žihľavka, kožná vaskulitída a exfoliatívne kožné stavy vrátane Stevensovho-Johnsonovho syndrómu [pozri Varovania a bezpečnostné opatrenia]; infekcia horných dýchacích ciest; zvýšenie hladiny pečeňových enzýmov; zápal slinivky brušnej.
top
Liekové interakcie
Kationické lieky
Katiónové lieky (napr. Amilorid, digoxín, morfín, prokaínamid, chinidín, chinín, ranitidín, triamterén, trimetoprim alebo vankomycín), ktoré sú eliminované renálnou tubulárnou sekréciou majú teoreticky potenciál interakcie s metformínom súťažením o spoločný renálny tubulárny transport systémy. Takáto interakcia medzi metformínom a perorálnym cimetidínom bola pozorovaná u zdravých zdravých dobrovoľníkov u jednorazovej aj viacdávkovej metformín-cimetidínu. štúdie liekových interakcií so 60% zvýšením maximálnych koncentrácií metformínu v plazme a plnej krvi a 40% zvýšením plazmy a metformínu v plnej krvi AUC. V štúdii s jednorazovou dávkou sa polčas eliminácie nezmenil. Metformín nemal žiadny vplyv na farmakokinetiku cimetidínu. Aj keď takéto interakcie zostávajú teoretické (s výnimkou cimetidínu), starostlivé monitorovanie pacienta a úprava dávky Janumetu a / alebo liečiva interferujúce liečivo sa odporúča u pacientov, ktorí užívajú katiónové lieky, ktoré sa vylučujú prostredníctvom proximálnej tubulárnej sekrecie obličiek Systém.
digoxín
V oblasti pod krivkou bolo mierne zvýšenie (AUC, 11%) a priemerná maximálna koncentrácia liečiva (Cmax, 18%) digoxínu pri súčasnom podaní 100 mg sitagliptínu počas 10 dní. Tieto zvýšenia sa nepovažujú za pravdepodobne klinicky významné. Digoxín, ako katiónové liečivo, má potenciál konkurovať metformínu o bežné renálne tubulárne transportné systémy, a tak ovplyvňuje koncentrácie digoxínu, metformínu alebo obidvoch týchto sérov. Pacientov, ktorí dostávajú digoxín, je potrebné náležite sledovať. Neodporúča sa úprava dávkovania digoxínu alebo Janumetu.
glyburidu
V interakčnej štúdii s jednou dávkou u pacientov s diabetom 2. typu nemalo súčasné podávanie metformínu a glyburidu za následok žiadne zmeny vo farmakokinetike ani farmakodynamike metformínu. Zníženie AUC a C glyburidumax boli pozorované, ale boli vysoko variabilné. Jednorazová povaha tejto štúdie a neexistencia korelácie medzi hladinami glyburidu v krvi a farmakodynamickými účinkami robia klinický význam tejto interakcie neistý.
furosemid
Štúdia liekových interakcií s metformín-furosemidom s jednou dávkou u zdravých jedincov preukázala, že súbežné podávanie ovplyvnilo farmakokinetické parametre oboch zlúčenín. Furosemid zvyšuje plazmatickú hladinu metformínu a krv Cmax o 22% a AUC v krvi o 15%, bez akejkoľvek významnej zmeny renálneho klírensu metformínu. Keď sa podáva s metformínom, Cmax a AUC furosemidu boli o 31% a 12% nižšie, ako keď sa podávali samostatne, a terminálny polčas sa znížil o 32%, bez akejkoľvek významnej zmeny furosemidovej obličky klírens. Nie sú dostupné informácie o interakcii metformínu a furosemidu pri dlhodobom súbežnom podávaní.
Nifedipine
Štúdia liekových interakcií s metformínom a nifedipínom v jednej dávke u zdravých dobrovoľníkov preukázala, že súčasné podávanie nifedipínu zvýšilo plazmatický metformín Cmax a AUC o 20%, respektíve 9%, a zvyšuje množstvo vylúčené močom. Tmax a polčas rozpadu neboli ovplyvnené. Zdá sa, že nifedipín zvyšuje absorpciu metformínu. Metformín mal na nifedipín minimálne účinky.
Použitie metformínu s inými liekmi
Niektoré lieky majú tendenciu vyvolávať hyperglykémiu a môžu viesť k strate kontroly glykémie. Medzi tieto lieky patria tiazidy a iné diuretiká, kortikosteroidy, fenotiazíny, produkty štítnej žľazy, estrogény, perorálne kontraceptíva, fenytoín, kyselina nikotínová, sympatomimetiká, lieky blokujúce vápnikové kanály a izoniazid. Ak sa takéto lieky podávajú pacientovi, ktorý dostáva Janumet, pacienta treba starostlivo sledovať, aby sa udržala primeraná glykemická kontrola.
U zdravých dobrovoľníkov nebola farmakokinetika metformínu a propranololu, metformínu a ibuprofénu pri súbežnom podávaní v interakčných štúdiách s jednou dávkou ovplyvnená.
Metformín sa zanedbateľne viaže na plazmatické bielkoviny, a preto je menej pravdepodobné, že interaguje s liečivami s vysokou väzbou na proteíny, ako sú napr salicyláty, sulfonamidy, chloramfenikol a probenecid v porovnaní so sulfonylmočovinami, ktoré sa vo veľkej miere viažu na sérum proteíny.
top
Použitie v špecifických populáciách
tehotenstvo
Tehotenstvo kategória B:
Janumet
Neexistujú dostatočné a dobre kontrolované štúdie s tehotnými ženami s Janumetom alebo s jeho jednotlivými zložkami; preto nie je známa bezpečnosť lieku Janumet u tehotných žien. Janumet sa má používať počas gravidity iba v nevyhnutných prípadoch.
Merck & Co., Inc. vedie register na monitorovanie výsledkov tehotenstva u žien vystavených Janumet počas tehotenstva. Poskytovatelia zdravotnej starostlivosti sa vyzývajú, aby oznámili akékoľvek prenatálne vystavenie účinkom lieku Janumet tak, že sa obrátia na register tehotenstva na čísle (800) 986-8999.
S kombinovanými liekmi v lieku Janumet sa nevykonali žiadne štúdie na zvieratách na vyhodnotenie účinkov na reprodukciu. Nasledujúce údaje sú založené na zisteniach v štúdiách uskutočňovaných individuálne so sitagliptínom alebo metformínom.
sitagliptín
Reprodukčné štúdie sa vykonali na potkanoch a králikoch. Dávky sitagliptínu až do 125 mg / kg (približne 12-násobok expozície u ľudí pri maximálnej odporúčanej dávke pre človeka) nenarušili plodnosť ani nepoškodili plod. Neexistujú však adekvátne a dobre kontrolované štúdie so sitagliptínom u tehotných žien.
Sitagliptín podávaný gravidným samiciam potkanov a králikom od 6. do 20. dňa gravidity (organogenéza) nebol teratogénny pri perorálnych dávkach do 250 mg / kg. (potkany) a 125 mg / kg (králiky) alebo približne 30 a 20-násobok expozície u ľudí pri maximálnej odporúčanej dávke u ľudí (MRHD) 100 mg / deň na základe AUC Porovnanie. Vyššie dávky zvýšili výskyt malformácií rebier u potomkov pri dávke 1 000 mg / kg alebo približne 100-násobnej expozícii u ľudí pri MRHD.
Sitagliptín podávaný samiciam potkanov od 6. dňa gravidity do 21. dňa laktácie znížil telesnú hmotnosť samcov a samíc potomstva o 1 000 mg / kg. U potomkov potkanov sa nepozorovala žiadna funkčná alebo behaviorálna toxicita.
Placentárny prenos sitagliptínu podávaného gravidným potkanom bol približne 45% po 2 hodinách a 80% po 24 hodinách po podaní dávky. Placentárny prenos sitagliptínu podávaného gravidným králikom bol približne 66% po 2 hodinách a 30% po 24 hodinách.
Hydrochlorid metformínu
Metformín nebol teratogénny u potkanov a králikov pri dávkach do 600 mg / kg / deň. To predstavuje expozíciu približne 2-krát a 6-násobok maximálnej odporúčanej dennej dávky pre ľudí 2 000 mg na základe porovnania plochy povrchu tela pre potkany a králiky. Stanovenie koncentrácií plodu preukázalo parciálnu placentárnu bariéru metformínu.
Dojčiace matky
S kombinovanými zložkami Janumetu sa nevykonali žiadne štúdie na laktujúcich zvieratách. V štúdiách uskutočňovaných s jednotlivými zložkami sa sitagliptín a metformín vylučujú do mlieka dojčiacich potkanov. Nie je známe, či sa sitagliptín vylučuje do materského mlieka. Pretože sa veľa liekov vylučuje do materského mlieka, pri podávaní Janumetu dojčiacej žene by sa malo postupovať opatrne.
Pediatrické použitie
Bezpečnosť a účinnosť Janumetu u detských pacientov mladších ako 18 rokov nebola stanovená.
Geriatrické použitie
Janumet
Pretože sitagliptín a metformín sú vylučované obličkami a pretože starnutie môže byť spojené so zníženou funkciou obličiek, Janumet sa má používať so zvyšujúcim sa vekom opatrne. Pri výbere dávky je potrebné postupovať opatrne a musí sa zakladať na starostlivom a pravidelnom monitorovaní funkcie obličiek. [See Varovania a bezpečnostné opatrenia; Klinická farmakológia.]
sitagliptín
Z celkového počtu subjektov (N = 3884) v klinických štúdiách so sitagliptínom vo fáze II a III bolo 725 pacientov vo veku 65 a viac rokov, zatiaľ čo 61 pacientov bolo vo veku 75 a viac rokov. Neboli pozorované žiadne celkové rozdiely v bezpečnosti alebo účinnosti medzi jedincami vo veku 65 rokov a staršími a mladšími. Aj keď táto a ďalšie hlásené klinické skúsenosti nezistili rozdiely v reakciách medzi staršími a mladšími pacientmi nemôže byť väčšia citlivosť niektorých starších jedincov vylúčený.
Hydrochlorid metformínu
Kontrolované klinické štúdie s metformínom nezahŕňali dostatočný počet starších pacientov, aby bolo možné určiť, či reagujú odlišne od mladších pacientov, hoci iné hlásené klinické skúsenosti nezistili rozdiely v odpovediach medzi starými a mladými pacienti. Metformín by sa mal používať iba u pacientov s normálnou funkciou obličiek. Počiatočné a udržiavacie dávkovanie metformínu by malo byť u pacientov s pokročilým vekom konzervatívne kvôli možnému zníženiu funkcie obličiek v tejto populácii. Akákoľvek úprava dávky by mala byť založená na starostlivom vyhodnotení funkcie obličiek. [See kontraindikácie; Varovania a bezpečnostné opatrenia; a Klinická farmakológia.]
top
predávkovať
sitagliptín
Počas kontrolovaných klinických štúdií so zdravými jedincami sa podávali jednotlivé dávky až do 800 mg sitagliptínu. Maximálne priemerné zvýšenie QTc o 8,0 ms bolo pozorované v jednej štúdii pri dávke 800 mg sitagliptínu, čo je priemerný účinok, ktorý sa nepovažuje za klinicky dôležitý [pozri Klinická farmakológia]. Nie sú žiadne skúsenosti s dávkami nad 800 mg u ľudí. V štúdiách fázy I s opakovanými dávkami sa nepozorovali žiadne klinické nežiaduce reakcie súvisiace so dávkou pri sitagliptíne pri dávkach až 400 mg za deň po dobu až 28 dní.
V prípade predávkovania je vhodné použiť obvyklé podporné opatrenia, napr. Odstrániť neabsorbovaný materiál z gastrointestinálneho traktu. traktu, využívajú klinické monitorovanie (vrátane získavania elektrokardiogramu) a zavádzajú podpornú terapiu, ako je indikované klinickou postavenie.
Sitagliptín je mierne dialyzovateľný. V klinických štúdiách sa približne 13,5% dávky odstránilo v priebehu 3 až 4 hodín hemodialýzy. Ak je to klinicky vhodné, môže sa zvážiť predĺžená hemodialýza. Nie je známe, či je sitagliptín dialyzovateľný peritoneálnou dialýzou.
Hydrochlorid metformínu
Vyskytlo sa predávkovanie hydrochlorid metformínu, vrátane požitia množstiev vyšších ako 50 gramov. Hypoglykémia bola hlásená približne v 10% prípadov, ale nebola preukázaná žiadna príčinná súvislosť s hydrochloridom metformínu. Laktátová acidóza bola hlásená u približne 32% prípadov predávkovania metformínom [pozri Varovania a bezpečnostné opatrenia]. Metformín je dialyzovateľný s klírensom až 170 ml / min za dobrých hemodynamických podmienok. Preto môže byť hemodialýza užitočná na odstránenie nahromadeného lieku od pacientov, u ktorých existuje podozrenie na predávkovanie metformínom.
top
popis
Tablety Janumet (sitagliptín / metformín HCl) obsahujú dve perorálne antihyperglykemické lieky používané na liečbu cukrovky typu 2: sitagliptín a metformíniumchlorid.
sitagliptín
Sitagliptín je perorálne aktívny inhibítor enzýmu dipeptidylpeptidáza-4 (DPP-4). Sitagliptín je prítomný v tabletách Janumet vo forme monohydrátu sitagliptíniumfosfátu. Monohydrát sitagliptíniumfosfátu je chemicky opísaný ako 7 - [(3R) - 3 - amino - 1 - oxo - 4 - (2,4,5 - trifluórfenyl) butyl] - Monohydrát 5,6,7,8 - tetrahydro - 3 - (trifluórmetyl) - 1,2,4 - triazolo [4,3 - a] pyrazín fosfátu (1: 1) s empirickým vzorcom C16H15F6N5O-H3PO4-H2O a molekulová hmotnosť 523,32. Štrukturálny vzorec je:
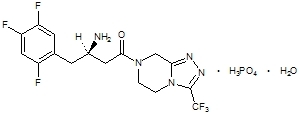
Monohydrát sitagliptíniumfosfátu je biely až takmer biely kryštalický nehygroskopický prášok. Je rozpustný vo vode a N, N-dimetylformamide; mierne rozpustný v metanole; veľmi slabo rozpustný v etanole, acetóne a acetonitrile; a nerozpustný v izopropanole a izopropylacetáte.
Hydrochlorid metformínu
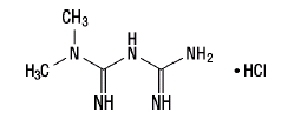
Hydrochlorid metformínu (hydrochlorid N, N-dimetylimidodikarbonimidového diamidu) nie je chemicky ani farmakologicky príbuzný so žiadnou inou triedou perorálnych antihyperglykemických látok. Hydrochlorid metformínu je biela až takmer biela kryštalická zlúčenina s molekulovým vzorcom C4H11N5-HCl a molekulová hmotnosť 165,63. Hydrochlorid metformínu je voľne rozpustný vo vode a je prakticky nerozpustný v acetóne, éteri a chloroforme. PK metformínu je 12,4. PH 1% vodného roztoku metformíniumchloridu je 6,68. Štrukturálny vzorec je uvedený:
Janumet
Janumet je dostupný na perorálne podanie vo forme tabliet obsahujúcich 64,25 mg monohydrátu sitagliptíniumfosfátu a ekvivalentu metformíniumchloridu. do: 50 mg sitagliptínu ako voľnej bázy a 500 mg metformíniumchloridu (Janumet 50 mg / 500 mg) alebo 1 000 mg metformíniumchloridu (Janumet 50 mg / 1000 mg). Každá filmom obalená tableta Janumetu obsahuje tieto neaktívne zložky: mikrokryštalická celulóza, polyvinylpyrolidón, laurylsulfát sodný a stearylfumarát sodný. Ďalej filmový povlak obsahuje nasledujúce neaktívne zložky: polyvinylalkohol, polyetylénglykol, mastenec, oxid titaničitý, červený oxid železitý a čierny oxid železitý.
top
Klinická farmakológia
Mechanizmus akcie
Janumet
Liek Janumet kombinuje dve antihyperglykemické látky s komplementárnymi mechanizmami účinku na zlepšenie kontroly glykémie u pacientov s cukrovka typu 2: sitagliptín, inhibítor dipeptidylpeptidázy-4 (DPP-4) a metformíniumchlorid, člen biguanidu trieda.
sitagliptín
Sitagliptín je inhibítor DPP-4, o ktorom sa predpokladá, že účinkuje u pacientov s diabetom 2. typu spomaľovaním inaktivácie inkretínových hormónov. Koncentrácie aktívnych intaktných hormónov sa zvyšujú sitagliptínom, čím sa zvyšuje a predlžuje účinok týchto hormónov. Inkretínové hormóny, vrátane glukagónu podobného peptidu-1 (GLP-1) a glukózy-dependentného inzulínotropu polypeptid (GIP), sa uvoľňujú v tenkom čreve po celý deň a hladiny sa zvyšujú v reakcii na jedlo. Tieto hormóny sú rýchlo inaktivované enzýmom DPP-4. Inkretíny sú súčasťou endogénneho systému zapojeného do fyziologickej regulácie homeostázy glukózy. Keď sú koncentrácie glukózy v krvi normálne alebo zvýšené, GLP-1 a GIP zvyšujú syntézu inzulínu a uvoľňovanie z beta buniek pankreasu intracelulárnymi signálnymi cestami zahŕňajúcimi cyklický AMP. GLP-1 tiež znižuje sekréciu glukagónu z alfa buniek pankreasu, čo vedie k zníženej produkcii glukózy v pečeni. Zvýšením a predĺžením hladín aktívneho inkretínu sitagliptín zvyšuje uvoľňovanie inzulínu a znižuje hladiny glukagónu v obehu glukózovo závislým spôsobom. Sitagliptín demonštruje selektivitu pre DPP-4 a neinhibuje aktivitu DPP-8 alebo DPP-9 in vitro pri koncentráciách približne rovnakých ako terapeutické dávky.
Hydrochlorid metformínu
Metformín je antihyperglykemické činidlo, ktoré zlepšuje glukózovú toleranciu u pacientov s diabetom 2. typu a znižuje tak bazálnu, ako aj postprandiálnu plazmatickú glukózu. Jeho farmakologické mechanizmy pôsobenia sú odlišné od iných tried orálnych antihyperglykemických látok. Metformín znižuje produkciu glukózy v pečeni, znižuje absorpciu glukózy v čreve a zvyšuje citlivosť na inzulín zvýšením absorpcie a využitia periférnej glukózy. Na rozdiel od sulfonylmočovín metformín nevyvoláva hypoglykémiu ani u pacientov s cukrovkou 2. typu, ani u zdravých jedincov (s výnimkou osobitných okolností [pozri Varovania a bezpečnostné opatrenia]) a nespôsobuje hyperinzulinémiu. Pri liečbe metformínom zostáva sekrécia inzulínu nezmenená, zatiaľ čo hladiny inzulínu nalačno nalačno a denná plazmová inzulínová odpoveď sa môžu skutočne znížiť.
12.2 Farmakodynamika
sitagliptín
všeobecný
U pacientov s diabetom 2. typu viedlo podávanie sitagliptínu k inhibícii enzýmovej aktivity DPP-4 počas 24 hodín. Po perorálnom podaní glukózy alebo jedla viedla táto inhibícia DPP-4 k 2- až 3-násobnému zvýšeniu hladín aktívneho GLP-1 a GIP v obehu, znížené koncentrácie glukagónu a zvýšená citlivosť uvoľňovania inzulínu na glukózu, čo vedie k vyššiemu C-peptidu a inzulínu koncentráciou. Zvýšenie inzulínu so znížením glukagónu bolo spojené s nižšími koncentráciami glukózy na lačno a zníženým výkyvom glukózy po perorálnom podaní glukózy alebo po jedle.
Súbežné podávanie sitagliptínu a hydrochloridu metformínu
V dvojdňovej štúdii u zdravých jedincov zvyšoval samotný sitagliptín koncentrácie aktívneho GLP-1, zatiaľ čo samotný metformín zvýšil koncentráciu aktívneho a celkového GLP-1 v podobnom rozsahu. Súbežné podávanie sitagliptínu a metformínu malo aditívny účinok na koncentrácie aktívneho GLP-1. Sitagliptín, ale nie metformín, zvyšoval koncentrácie aktívneho GIP. Nie je jasné, čo tieto nálezy znamenajú pre zmeny v glykemickej kontrole u pacientov s cukrovkou 2. typu.
V štúdiách so zdravými jedincami sitagliptín neznížil hladinu glukózy v krvi ani nespôsobil hypoglykémiu.
Srdcová elektrofyziológia
V randomizovanej, placebom kontrolovanej skríženej štúdii sa 79 zdravým jedincom podávala jednorazová perorálna dávka 100 mg sitagliptínu, 800 mg sitagliptínu (8-násobok odporúčanej dávky) a placebo. Pri odporúčanej dávke 100 mg sa nezistil žiadny účinok na QTc interval dosiahnutý pri maximálnej plazmatickej koncentrácii alebo kedykoľvek počas štúdie. Po podaní dávky 800 mg bolo maximálne zvýšenie priemernej zmeny QTc korigovanej o placebo od základnej hodnoty 3 hodiny po podaní dávky 8,0 ms. Toto zvýšenie sa nepovažuje za klinicky významné. Pri dávke 800 mg boli maximálne plazmatické koncentrácie sitagliptínu približne 11-krát vyššie ako najvyššie koncentrácie po 100 mg dávke.
U pacientov s cukrovkou 2. typu sa podáva sitagliptín v dávke 100 mg (N = 81) alebo sitagliptín v dávke 200 mg (N = 63) denne. neboli žiadne významné zmeny v intervale QTc na základe údajov EKG získaných v čase očakávanej maximálnej plazmy koncentráciu.
farmakokinetika
Janumet
Výsledky štúdie bioekvivalencie u zdravých jedincov preukázali, že liek Janumet (sitagliptín / metformín HCl) 50 mg / 500 kombinované tablety mg a 50 mg / 1 000 mg sú bioekvivalentné súčasnému podávaniu zodpovedajúcich dávok sitagliptínu (JANUVIA)™2) a hydrochlorid metformínu ako jednotlivé tablety.
vstrebávanie
sitagliptín
Absolútna biologická dostupnosť sitagliptínu je približne 87%. Súbežné podávanie jedla s vysokým obsahom tukov so sitagliptínom nemalo žiadny vplyv na farmakokinetiku sitagliptínu.
Hydrochlorid metformínu
Absolútna biologická dostupnosť 500 mg tablety metformíniumchloridu podaného nalačno je približne 50 - 60%. Štúdie s použitím jednorazových perorálnych dávok tabliet metformíniumchloridu 500 mg až 1500 mg a 850 mg až 2550 mg naznačujú, že existuje absencia proporcionality dávky so zvyšujúcimi sa dávkami, ktorá je spôsobená skôr zníženou absorpciou ako zmenou eliminácie. Jedlo znižuje rozsah a mierne oneskoruje absorpciu metformínu, ako ukazuje približne o 40% nižšia priemerná maximálna maximálna plazmatická koncentrácia (Cmax), o 25% nižšia plocha pod krivkou závislosti koncentrácie na plazme od času (AUC) a predĺženie času na dosiahnutie maximálnej plazmatickej koncentrácie o 35 minút (T)max) po podaní jednej 850 mg tablety metformínu s jedlom v porovnaní s rovnakou silou tablety, ktorá sa podáva nalačno. Klinický význam týchto poklesov nie je známy.
distribúcia
sitagliptín
Priemerný distribučný objem v rovnovážnom stave po jednorazovej 100 mg intravenóznej dávke sitagliptínu zdravým jedincom je približne 198 litrov. Frakcia sitagliptínu reverzibilne viazaná na plazmatické proteíny je nízka (38%).
Hydrochlorid metformínu
Zdanlivý distribučný objem (V / F) metformínu po jednorazovej perorálnej dávke tabliet hydrochloridu metformínu 850 mg bol v priemere 654 ± 358 L. Metformín sa zanedbateľne viaže na plazmatické proteíny, na rozdiel od sulfonylmočovín, ktoré sa viažu na viac ako 90% proteínov. Metformín sa delí na erytrocyty, pravdepodobne ako funkcia času. Pri obvyklých klinických dávkach a dávkovacích schémach tabliet hydrochloridu metformínu sa plazmatické koncentrácie metformínu v rovnovážnom stave dosahujú do 24 - 48 hodín a zvyčajne sa vyskytujú
metabolizmus
sitagliptín
Približne 79% sitagliptínu sa vylučuje nezmenené močom, pričom metabolizmus je menšou cestou vylučovania.
Po [14C] perorálna dávka sitagliptínu, približne 16% rádioaktivity sa vylúčilo ako metabolity sitagliptínu. Zistilo sa šesť metabolitov pri stopových hladinách a neočakáva sa, že prispeje k inhibičnej aktivite sitagliptínu v plazme DPP-4. Štúdie in vitro naznačili, že primárnym enzýmom zodpovedným za obmedzený metabolizmus sitagliptínu bol CYP3A4 s prispením CYP2C8.
Hydrochlorid metformínu
Intravenózne štúdie s jednou dávkou u normálnych jedincov ukazujú, že metformín sa vylučuje v nezmenenej forme moč a nepodlieha metabolizmu v pečeni (u ľudí sa nezistili žiadne metabolity) ani biliárne vylučovanie.
vylučovanie
sitagliptín
Po perorálnom podaní [14C] dávka sitagliptínu zdravým jedincom sa približne 100% podanej rádioaktivity vylúčilo stolicou (13%) alebo močom (87%) do jedného týždňa po podaní. Zdanlivý terminál t1/2 po perorálnej dávke 100 mg sitagliptínu bola približne 12,4 hodín a renálny klírens bol približne 350 ml / min.
K eliminácii sitagliptínu dochádza primárne vylučovaním obličkami a zahŕňa aktívnu tubulárnu sekréciu. Sitagliptín je substrát pre ľudský organický aniónový transportér-3 (hOAT-3), ktorý sa môže podieľať na vylučovaní sitagliptínu obličkami. Klinický význam hOAT-3 pri transporte sitagliptínu nebol stanovený. Sitagliptín je tiež substrátom p-glykoproteínu, ktorý môže byť tiež zapojený do sprostredkovania renálnej eliminácie sitagliptínu. Cyklosporín, inhibítor p-glykoproteínu, však neznížil renálny klírens sitagliptínu.
Hydrochlorid metformínu
Renálny klírens je približne 3,5-krát vyšší ako klírens kreatinínu, čo naznačuje, že tubulárna sekrécia je hlavnou cestou eliminácie metformínu. Po perorálnom podaní je približne 90% absorbovaného liečiva eliminovaných obličkovou cestou počas prvých 24 hodín, s plazmatickým eliminačným polčasom približne 6,2 hodín. V krvi je eliminačný polčas približne 17,6 hodín, čo naznačuje, že masa erytrocytov môže byť distribučným priestorom.
Osobitné skupiny obyvateľstva
Renálna nedostatočnosť
Janumet
Janumet by nemali užívať pacienti s renálnou insuficienciou [pozri kontraindikácie; Varovania a bezpečnostné opatrenia].
sitagliptín
U pacientov so stredne ťažkou renálnou insuficienciou sa pozorovalo približne 2-násobné zvýšenie plazmatickej AUC sitagliptínu a približne 4-násobne u hemodialyzovaných pacientov s ťažkou renálnou insuficienciou vrátane pacientov s ESRD sa pozorovalo zvýšenie v porovnaní s normálnou zdravou kontrolou predmety.
Hydrochlorid metformínu
U pacientov so zníženou funkciou obličiek (na základe odmeraného klírensu kreatinínu) je plazmatický polčas a polčas v krvi metformínu sa predlžuje a renálny klírens sa znižuje úmerne poklesu kreatinínu klírens.
Hepatálna nedostatočnosť
sitagliptín
U pacientov so stredne ťažkou hepatálnou insuficienciou (skóre Child-Pugh 7 až 9) je priemerná AUC a Cmax sitagliptínu sa zvýšil približne o 21%, respektíve 13%, v porovnaní so zdravými kontrolnými kontrolami po podaní jednorazovej dávky 100 mg sitagliptínu. Tieto rozdiely sa nepovažujú za klinicky významné.
Nie sú klinické skúsenosti s pacientmi s ťažkou hepatálnou insuficienciou (skóre Child-Pugh> 9).
Hydrochlorid metformínu
U pacientov s hepatálnou insuficienciou sa nevykonali žiadne farmakokinetické štúdie s metformínom.
rod
sitagliptín
Pohlavie nemalo klinicky významný vplyv na farmakokinetiku sitagliptínu založeného na kompozite analýza farmakokinetických údajov fázy I a populačnej farmakokinetickej analýzy fázy I a fázy II dát.
Hydrochlorid metformínu
Farmakokinetické parametre metformínu sa pri analýze podľa pohlavia významne nelíšili medzi normálnymi jedincami a pacientmi s cukrovkou 2. typu. Podobne v kontrolovaných klinických štúdiách u pacientov s diabetom 2. typu bol antihyperglykemický účinok metformínu porovnateľný u mužov a žien.
geriatrickej
sitagliptín
Keď sa vezmú do úvahy účinky veku na funkciu obličiek, vek sám nemal klinicky významný vplyv na farmakokinetiku sitagliptínu založený na populačnej farmakokinetike Analýza. Starší pacienti (65 až 80 rokov) mali približne o 19% vyššie plazmatické koncentrácie sitagliptínu v porovnaní s mladšími jedincami.
Hydrochlorid metformínu
Obmedzené údaje z kontrolovaných farmakokinetických štúdií s metformínom u zdravých starších jedincov naznačujú, že celkový plazmatický klírens metformínu je znížený, polčas je predĺžený a Cmax je v porovnaní so zdravými mladými jedincami zvýšená. Z týchto údajov vyplýva, že zmena farmakokinetiky metformínu so starnutím je primárne spôsobená zmenou funkcie obličiek (pozri GLUCOPHAGE).3 informácie o predpisovaní: KLINICKÁ FARMAKOLÓGIA, Špeciálne populácie, Geriatria).
Liečba liekom Janumet sa nemá začať u pacientov vo veku 80 rokov, pokiaľ meranie klírensu kreatinínu nepreukáže, že funkcia obličiek nie je znížená [pozri časť Varovania a bezpečnostné opatrenia].
Pediatric
U pediatrických pacientov sa nevykonali žiadne štúdie s Janumetom.
závod
sitagliptín
Rasa nemala na základe kombinovanej analýzy klinicky významný vplyv na farmakokinetiku sitagliptínu dostupných farmakokinetických údajov, vrátane jedincov bielej, hispánskej, čiernej, ázijskej a iných rasových skupiny.
Hydrochlorid metformínu
Neuskutočnili sa žiadne štúdie farmakokinetických parametrov metformínu podľa rasy. V kontrolovaných klinických štúdiách s metformínom u pacientov s diabetom 2. typu bol antihyperglykemický účinok porovnateľný u bielych (n = 249), čiernych (n = 51) a hispáncov (n = 24).
Index telesnej hmotnosti (BMI)
sitagliptín
Index telesnej hmotnosti nemal klinicky významný účinok na farmakokinetiku sitagliptínu založeného na kompozite analýza farmakokinetických údajov fázy I a populačnej farmakokinetickej analýzy fázy I a fázy II dát.
Liekové interakcie
Sitagliptín a metformíniumchlorid
Uskutočnilo sa spoločné podávanie viacerých dávok sitagliptínu (50 mg) a metformínu (1 000 mg) podávaných dvakrát denne významne nezmenili farmakokinetiku sitagliptínu ani metformínu u pacientov s typom 2 diabetes.
Farmakokinetické liekové interakčné štúdie s Janumetom sa neuskutočnili; tieto štúdie sa však uskutočnili s jednotlivými zložkami lieku Janumet (sitagliptín a metformíniumchlorid).
sitagliptín
Hodnotenie liekových interakcií in vitro
Sitagliptín nie je inhibítorom CYP izozýmov CYP3A4, 2C8, 2C9, 2D6, 1A2, 2C19 alebo 2B6 a nie je induktorom CYP3A4. Sitagliptín je substrát p-glykoproteínu, ale neinhibuje transport digoxínu sprostredkovaný p-glykoproteínom. Na základe týchto výsledkov sa predpokladá, že sitagliptín pravdepodobne nespôsobí interakcie s inými liekmi, ktoré tieto cesty využívajú.
Sitagliptín sa vo veľkej miere neviaže na plazmatické bielkoviny. Preto je sklon sitagliptínu podieľať sa na klinicky významných liekových interakciách sprostredkovaných vytesnením väzby na plazmatické bielkoviny veľmi nízky.
In vivo hodnotenie liekových interakcií
Účinok sitagliptínu na iné lieky
V klinických štúdiách, ako je opísané nižšie, sitagliptín významne nezmenil farmakokinetiku metformínu, glyburidu, simvastatínu, rosiglitazónu, warfarínu alebo perorálne antikoncepcie, poskytujúce in vivo dôkaz nízkej náchylnosti na spôsobovanie liekových interakcií so substrátmi CYP3A4, CYP2C8, CYP2C9 a organickým katiónovým transportérom (OCT).
Digoxín: Sitagliptín mal minimálny vplyv na farmakokinetiku digoxínu. Po súčasnom podaní 0,25 mg digoxínu so 100 mg sitagliptínu denne počas 10 dní sa plazmatická AUC digoxínu zvýšila o 11% a plazmatická Cmax o 18%.
Sulfonylmočoviny: Farmakokinetika jednorazovej dávky glyburidu, substrátu CYP2C9, sa významne nezmenila u subjektov, ktoré dostávali viacnásobné dávky sitagliptínu. Klinicky významné interakcie by sa neočakávali s inými sulfonylmočovinami (napr. Glipizid, tolbutamid a glimepirid), ktoré sú podobne ako glyburid primárne eliminované CYP2C9 [pozri Varovania a bezpečnostné opatrenia].
Simvastatín: Farmakokinetika jednorazovej dávky simvastatínu, substrátu CYP3A4, sa významne nezmenila u jedincov, ktorí dostávali viacnásobné denné dávky sitagliptínu. Preto sitagliptín nie je inhibítorom metabolizmu sprostredkovaného CYP3A4.
Tiazolidíndióny: Farmakokinetika jednorazovej dávky rosiglitazónu sa u jedincov významne nezmenila ktorí dostávajú viacnásobné denné dávky sitagliptínu, čo naznačuje, že sitagliptín nie je inhibítorom CYP2C8-sprostredkovaného metabolizmus.
Warfarín: Opakované denné dávky sitagliptínu významne nezmenili farmakokinetiku, ako bolo stanovené meraním Enantioméry S (-) alebo R (+) warfarínu alebo farmakodynamika (hodnotená meraním protrombínu INR) jednej dávky warfarín. Pretože S (-) warfarín je primárne metabolizovaný prostredníctvom CYP2C9, tieto údaje tiež podporujú záver, že sitagliptín nie je inhibítorom CYP2C9.
Perorálne kontraceptíva: Súbežné podávanie so sitagliptínom významne nezmenilo farmakokinetiku noretindrónu alebo etinylestradiolu v rovnovážnom stave.
Účinok iných liekov na sitagliptín
Klinické údaje opísané nižšie naznačujú, že sitagliptín nie je citlivý na klinicky významné interakcie pri súčasnom podávaní liekov.
Cyklosporín: Uskutočnila sa štúdia na vyhodnotenie účinku cyklosporínu, silného inhibítora p-glykoproteínu, na farmakokinetiku sitagliptínu. Súbežné podanie jednej 100 mg perorálnej dávky sitagliptínu a jednej 600 mg perorálnej dávky cyklosporínu zvýšilo AUC a Cmax sitagliptínu približne o 29%, respektíve 68%. Tieto mierne zmeny vo farmakokinetike sitagliptínu sa nepovažovali za klinicky významné. Renálny klírens sitagliptínu sa tiež významne nezmenil. Z tohto dôvodu by sa neočakávali zmysluplné interakcie s inými inhibítormi p-glykoproteínu.
Hydrochlorid metformínu
[See Liekové interakcie]
top
Neklinická toxikológia
Karcinogenéza, mutagenéza, poškodenie plodnosti
Janumet
S kombinovanými liekmi v lieku Janumet sa nevykonali žiadne štúdie na zvieratách na vyhodnotenie karcinogenézy, mutagenézy alebo poškodenia plodnosti. Nasledujúce údaje vychádzajú zo zistení v štúdiách so sitagliptínom a metformínom jednotlivo.
sitagliptín
U samcov a samíc potkanov, ktorým boli podávané perorálne dávky sitagliptínu 50, 150 a 500 mg / kg / deň, sa uskutočnila dvojročná štúdia karcinogenity. Zvýšil sa výskyt kombinovaného adenómu / karcinómu pečene u mužov a žien a karcinómu pečene u žien pri dávke 500 mg / kg. Výsledkom tejto dávky je expozícia približne 60-násobok expozície u človeka pri maximálnej odporúčanej dennej dávke pre dospelých (MRHD) 100 mg / deň na základe porovnania AUC. Nádory pečene neboli pozorované pri 150 mg / kg, čo je približne 20-násobok expozície u ľudí pri MRHD. U samcov a samíc myší, ktorým sa podávali perorálne dávky sitagliptínu 50, 125, 250 a 500 mg / kg / deň, sa uskutočnila dvojročná štúdia karcinogenity. Výskyt nádorov v žiadnom orgáne nebol zvýšený do 500 mg / kg, čo je približne 70-násobok expozície u ľudí pri MRHD. Sitagliptín nebol mutagénny ani klastogénny s metabolickou aktiváciou alebo bez metabolickej aktivácie v teste bakteriálnej mutagenity Ames, ováriu čínskeho škrečka (CHO). chromozómová aberačná skúška, in vitro cytogenetická skúška v CHO, in vitro test na alkalickú elúciu potkanieho hepatocytu DNA a mikronukleus in vivo Test.
V štúdiách fertility na potkanoch s perorálnymi dávkami žalúdočnej sondy 125, 250 a 1 000 mg / kg boli samce liečené 4 týždne pred párením, počas párenie až do plánovaného ukončenia (celkom približne 8 týždňov) a samice boli ošetrené 2 týždne pred párením graviditou deň 7. Pri 125 mg / kg nebol pozorovaný žiadny nepriaznivý účinok (približne 12-násobok expozície u ľudí pri MRHD 100 mg / deň na základe porovnania AUC). Pri vyšších dávkach boli u žien pozorované zvýšené resorpcie u žien (približne 25 a 100-násobok expozície u ľudí pri MRHD na základe porovnania AUC).
Hydrochlorid metformínu
U potkanov (trvanie dávky 104 týždňov) a myší sa uskutočnili dlhodobé štúdie karcinogenity (trvanie dávky 91 týždňov) v dávkach až do 900 mg / kg / deň vrátane a 1500 mg / kg / deň, resp. Tieto dávky sú približne štvornásobkom maximálnej odporúčanej dennej dávky u ľudí 2000 mg na základe porovnania plochy povrchu tela. U samcov alebo samíc myší sa nezistil žiadny dôkaz karcinogenity s metformínom. Podobne sa u samcov potkanov nepozoroval žiadny tumorigénny potenciál s metformínom. U samíc potkanov liečených 900 mg / kg / deň sa však vyskytol zvýšený výskyt benígnych stromálnych maternicových polypov.
Pri nasledujúcich in vitro testoch sa nepreukázal mutagénny potenciál metformínu: Amesov test (S. S. typhimurium), génové mutačné testy (bunky myšacieho lymfómu) alebo chromozomálne aberácie (ľudské lymfocyty). Výsledky in vivo testu na mikrojadrách myší boli tiež negatívne. Plodnosť samcov alebo samíc potkanov nebola ovplyvnená metformínom, keď sa podával v dávkach až 600 mg / kg / deň, čo je približne trojnásobok maximálnej odporúčanej dennej dávky pre človeka na základe plochy povrchu tela Porovnanie.
top
Klinické štúdie
Súbežné podávanie sitagliptínu a metformínu sa skúmalo u pacientov s cukrovkou 2. typu nedostatočne kontrolovanou diétou a cvičením av kombinácii s glimepiridom.
Neuskutočnili sa žiadne štúdie klinickej účinnosti s Janumetom; preukázala sa však bioekvivalencia Janumetu so súbežne podávanými tabletami sitagliptínu a metformíniumchloridu.
Súbežné podávanie sitagliptínu a metformínu u pacientov s diabetom 2. typu nedostatočne kontrolovanými diétou a cvičením
24 týždňa sa zúčastnilo celkom 1091 pacientov s cukrovkou 2. typu a nedostatočnou glykemickou kontrolou stravovania a cvičenia, randomizovaná, dvojito zaslepená, placebom kontrolovaná faktoriálna štúdia navrhnutá na vyhodnotenie účinnosti sitagliptínu a metformínu Súčasné podanie. Pacienti s antihyperglykemickým činidlom (N = 541) podstúpili diétu, cvičenie a vymývanie liečiva po dobu až 12 týždňov. Po vymývacom období boli pacienti s neadekvátnou glykemickou kontrolou (A1C 7,5% až 11%) randomizovaní po dokončení dvojtýždňového jednorazovo slepého placebového obdobia. Pacienti, ktorí na vstupe do štúdie neboli liečení antihyperglykemikami (N = 550) s nedostatočnou glykemickou kontrolou (A1C) 7,5% až 11%) okamžite vstúpilo do dvojtýždňového slepého pokusu s placebom a potom bolo náhodne. Približne rovnaký počet pacientov bol randomizovaný na placebo, 100 mg sitagliptínu jedenkrát denne, 500 mg alebo 1 000 mg metformínu dvakrát denne alebo 50 mg sitagliptínu dvakrát denne v kombinácii s 500 mg alebo 1 000 mg metformínu dvakrát denne. Pacienti, ktorí v priebehu štúdie nespĺňali konkrétne glykemické ciele, boli liečení záchranou glyburidom (glibenklamid).
Súbežné podávanie sitagliptínu a metformínu poskytlo významné zlepšenie v A1C, FPG a 2-hodinovom PPG v porovnaní s placebom, samotným metformínom a samotným sitagliptínom (tabuľka 3, obrázok 1). Priemerné zníženie východiskovej hodnoty A1C bolo vo všeobecnosti väčšie u pacientov s vyššími východiskovými hodnotami A1C. U pacientov, ktorí neboli na začiatku štúdie liečení antihyperglykemickými látkami, boli priemerné zníženia východiskovej hodnoty A1C: sitagliptín 100 mg jedenkrát denne, -1,1%; metformín 500 mg dvakrát denne, -1,1%; metformín 1 000 mg dvakrát denne, -1,2%; sitagliptín 50 mg dvakrát denne s metformínom 500 mg dvakrát denne, -1,6%; sitagliptín 50 mg dvakrát denne s metformínom 1 000 mg dvakrát denne, -1,9%; a u pacientov, ktorí dostávajú placebo, -0,2%. Lipidové účinky boli vo všeobecnosti neutrálne. Pokles telesnej hmotnosti v skupinách, ktorým bol podávaný sitagliptín v kombinácii s metformínom, bol podobný ako v skupinách, ktorým bol podávaný samotný metformín alebo placebo.
Tabuľka 3: Glykemické parametre pri záverečnej návšteve (24-týždňová štúdia) pre sitagliptín a metformín, samotné a v kombinácii u pacientov s diabetom 2. typu nedostatočne kontrolovanými diétou a cvičením *
placebo |
sitagliptín 100 mg QD |
metformín 500 mg dvakrát denne |
metformín 1 000 mg dvakrát denne |
sitagliptín 50 mg bid + metformín 500 mg dvakrát denne |
sitagliptín 50 mg bid + metformín 1 000 mg dvakrát denne |
|
| ||||||
| A1C (%) | N = 165 | N = 175 | N = 178 | N = 177 | N = 183 | N = 178 |
| Základná hodnota (stredná hodnota) | 8.7 | 8.9 | 8.9 | 8.7 | 8.8 | 8.8 |
| Zmena zo základnej línie (upravený priemer†) | 0.2 | -0.7 | -0.8 | -1.1 | -1.4 | -1.9 |
| Rozdiel oproti placebu (upravený priemer†) (95% CI) |
-0.8C (-1.1, -0.6) |
-1.0C (-1.2, -0.8) |
-1.3C (-1.5, -1.1) |
-1.6C (-1.8, -1.3) |
-2.1C (-2.3, -1.8) |
|
| Pacienti (%) dosahujúci A1C <7% | 15 (9%) | 35 (20%) | 41 (23%) | 68 (38%) | 79 (43%) | 118 (66%) |
| % Pacientov, ktorí dostávajú záchranný liek | 32 | 21 | 17 | 12 | 8 | 2 |
| FPG (mg / dl) | N = 169 | N = 178 | N = 179 | N = 179 | N = 183 | N = 180 |
| Základná hodnota (stredná hodnota) | 196 | 201 | 205 | 197 | 204 | 197 |
| Zmena zo základnej línie (upravený priemer†) | 6 | -17 | -27 | -29 | -47 | -64 |
| Rozdiel oproti placebu (upravený priemer†) (95% CI) |
-23C (-33, -14) |
-33C (-43, -24) |
-35C (-45, -26) |
-53C (-62, -43) |
-70C (-79, -60) |
|
| 2-hodinový PPG (mg / dl) | N = 129 | N = 136 | N = 141 | N = 138 | N = 147 | N = 152 |
| Základná hodnota (stredná hodnota) | 277 | 285 | 293 | 283 | 292 | 287 |
| Zmena zo základnej línie (upravený priemer†) | 0 | -52 | -53 | -78 | -93 | -117 |
| Rozdiel oproti placebu (upravený priemer†) (95% CI) |
-52C (-67, -37) |
-54C (-69, -39) |
-78C (-93, -63) |
-93C (-107, -78) |
-117C (-131, -102) |
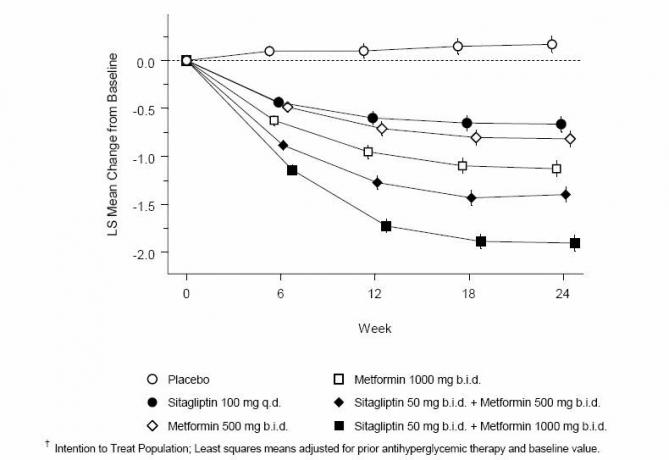
Obrázok 1: Priemerná zmena oproti základnej hodnote pre A1C (%) za 24 týždňov s použitím sitagliptínu a metformínu, samotný a v kombinácii u pacientov s diabetom 2. typu nedostatočne kontrolovaným stravou a cvičením
Okrem toho táto štúdia zahŕňala pacientov (N = 117) s ťažšou hyperglykémiou (A1C> 11% alebo krv) glukóza> 280 mg / dl), ktorí boli liečení dvakrát denne otvoreným sitagliptínom v dávke 50 mg a metformínom 1 000 mg. V tejto skupine pacientov bola priemerná východisková hodnota A1C 11,2%, priemerná FPG bola 314 mg / dl a priemerná dvojhodinová PPG bola 441 mg / dl. Po 24 týždňoch bolo pozorované priemerné zníženie oproti východiskovej hodnote -2,9% pre A1C, -127 mg / dl pre FPG a -208 mg / dl pre 2-hodinové PPG.
Počiatočná kombinovaná terapia alebo udržiavanie kombinovanej terapie by mali byť individualizované a mali by byť ponechané na uváženie poskytovateľa zdravotnej starostlivosti.
Doplnková liečba sitagliptínom u pacientov s diabetom 2. typu nedostatočne kontrolovaná na metformíne samotnom
Celkovo 701 pacientov s diabetom 2. typu sa zúčastnilo na 24-týždňovej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii zameranej na hodnotenie účinnosti sitagliptínu v kombinácii s metformínom. Pacienti, ktorí už užívali metformín (N = 431) v dávke najmenej 1500 mg za deň, boli randomizovaní po ukončení dvojtýždňového, slepého pokusu s placebom. Pacienti s metformínom a iným antihyperglykemickým činidlom (N = 229) a pacienti, ktorí nemajú žiadne antihyperglykemické látky (mimo liečby najmenej 8 týždne, N = 41), boli randomizované po dobe zábehu približne 10 týždňov na metformíne (v dávke najmenej 1500 mg za deň) v monoterapia. Pacienti boli randomizovaní na pridanie buď 100 mg sitagliptínu alebo placeba, podávaného jedenkrát denne. Pacienti, ktorí počas štúdií nespĺňali konkrétne glykemické ciele, boli liečení záchranou pioglitazónom.
V kombinácii s metformínom sitagliptín poskytoval významné zlepšenia A1C, FPG a 2-hodinového PPG v porovnaní s placebom s metformínom (tabuľka 4). Záchranná glykemická terapia bola použitá u 5% pacientov liečených sitagliptínom v 100 mg a 14% pacientov liečených placebom. Podobné zníženie telesnej hmotnosti bolo pozorované pre obe liečené skupiny.
Tabuľka 4: Glykemické parametre pri záverečnej návšteve (24-týždňová štúdia) sitagliptínu v doplnkovej kombinovanej terapii s metformínom *
| Sitagliptín 100 mg QD + Metformín |
placebo + Metformín |
|
| ||
| A1C (%) | N = 453 | N = 224 |
| Základná hodnota (stredná hodnota) | 8.0 | 8.0 |
| Zmena zo základnej línie (upravený priemer†) | -0.7 | -0.0 |
| Rozdiel od placeba + metformínu (upravený priemer†) (95% CI) |
-0.7C (-0.8, -0.5) |
|
| Pacienti (%) dosahujúci A1C <7% | 213 (47%) | 41 (18%) |
| FPG (mg / dl) | N = 454 | N = 226 |
| Základná hodnota (stredná hodnota) | 170 | 174 |
| Zmena zo základnej línie (upravený priemer†) | -17 | 9 |
| Rozdiel od placeba + metformínu (upravený priemer†) (95% CI) |
-25C (-31, -20) |
|
| 2-hodinový PPG (mg / dl) | N = 387 | N = 182 |
| Základná hodnota (stredná hodnota) | 275 | 272 |
| Zmena zo základnej línie (upravený priemer†) | -62 | -11 |
| Rozdiel od placeba + metformínu (upravený priemer†) (95% CI) |
-51C (-61, -41) |
Doplnková liečba sitagliptínom u pacientov s diabetom 2. typu nedostatočne kontrolovaná kombináciou metformínu a glimepiridu
Celkom 441 pacientov s diabetom 2. typu sa zúčastnilo na 24-týždňovom, randomizovanom, dvojito zaslepenom, placebom kontrolovaná štúdia určená na hodnotenie účinnosti sitagliptínu v kombinácii s glimepiridom, s alebo bez metformínu. Pacienti vstúpili do liečebnej periódy so samotným glimepiridom (± 4 mg denne) alebo glimepiridom v kombinácii s metformínom (± 1500 mg za deň). Po titrácii dávky a dobe zábehu, ktorá je stabilná počas dávky až do 16 týždňov a po dvojtýždňovej dobe zábehu placeba, sú pacienti s nedostatočnou dávkou kontrola glykémie (A1C 7,5% až 10,5%) bola randomizovaná na pridanie buď 100 mg sitagliptínu alebo placeba, podaných jedenkrát denne. Pacienti, ktorí počas štúdií nespĺňali konkrétne glykemické ciele, boli liečení záchranou pioglitazónom.
U pacientov užívajúcich sitagliptín s metformínom a glimepiridom došlo k významnému zlepšeniu A1C a FPG v porovnaní s pacientmi, ktorí dostávali placebo s metformínom a glimepiridom (tabuľka 5), s priemerným znížením od východiskovej hodnoty v porovnaní s placebom v A1C o -0,9% a v FPG o -21 mg / dl. Záchranná liečba sa použila u 8% pacientov liečených sitagliptínom v dávke 100 mg a 29% pacientov liečených prídavným placebom. U pacientov liečených prídavným sitagliptínom došlo k priemernému zvýšeniu telesnej hmotnosti o 1,1 kg oproti prídavné placebo (+0,4 kg vs. -0,7 kg). Okrem toho prídavný sitagliptín mal za následok zvýšenú mieru hypoglykémie v porovnaní s prídavným placebom. [See Varovania a bezpečnostné opatrenia; Nežiaduce reakcie.]
Tabuľka 5: Glykemické parametre pri záverečnej návšteve (24-týždňová štúdia) pre sitagliptín v kombinácii s metformínom a glimepiridom *
| Sitagliptín 100 mg + Metformín a Glimepiride |
placebo + Metformín a Glimepiride |
|
| ||
| A1C (%) | N = 115 | N = 105 |
| Základná hodnota (stredná hodnota) | 8.3 | 8.3 |
| Zmena zo základnej línie (upravený priemer†) | -0.6 | 0.3 |
| Rozdiel oproti placebu (upravený priemer†) (95% CI) | -0.9C (-1.1, -0.7) |
|
| Pacienti (%) dosahujúci A1C <7% | 26 (23%) | 1 (1%) |
| FPG (mg / dl) | N = 115 | N = 109 |
| Základná hodnota (stredná hodnota) | 179 | 179 |
| Zmena zo základnej línie (upravený priemer†) | -8 | 13 |
| Rozdiel oproti placebu (upravený priemer†) (95% CI) | -21C (-32, -10) |
Terapia doplnkom Sitagliptin vs. Doplnková liečba glipizidom u pacientov s diabetom 2. typu nedostatočne kontrolovaná metformínom
Účinnosť sitagliptínu sa hodnotila v 52-týždňovej, dvojito zaslepenej, glipizidom kontrolovanej neinferioritnej štúdii u pacientov s cukrovkou 2. typu. Pacienti, ktorí nie sú liečení alebo inými antihyperglykemikami, vstúpili do liečebnej periódy v trvaní až 12 týždňov s monoterapiou metformínom (dávka - 1500 mg denne), ktorá zahŕňala vymiznutie iných liekov ako metformínu, ak použiteľné. Po období zábehu boli randomizované skupiny s nedostatočnou glykemickou kontrolou (A1C 6,5% až 10%) 1: 1 po pridaní 100 mg sitagliptínu jedenkrát denne alebo glipizidu po dobu 52 týždňov. Pacientom, ktorí dostávali glipizid, bola podaná úvodná dávka 5 mg / deň a potom boli titrovaní elektricky titrovaní v priebehu nasledujúcich 18 týždňov na maximálnu dávku 20 mg / deň podľa potreby na optimalizáciu kontroly glykémie. Potom sa dávka glipizidu mala udržiavať konštantná, s výnimkou titrácie smerom nadol, aby sa zabránilo hypoglykémii. Priemerná dávka glipizidu po titračnom období bola 10 mg.
Po 52 týždňoch mal sitagliptín a glipizid podobné priemerné zníženie z východiskovej hodnoty pri A1C v analýze zameranej na liečbu (tabuľka 6). Tieto výsledky boli konzistentné s analýzou podľa protokolu (obrázok 2). Záver v prospech nevýhodnosti sitagliptínu voči glipizidu sa môže obmedziť na pacientov s východiskovou hodnotou. A1C porovnateľné s tými zahrnutými v štúdii (viac ako 70% pacientov malo východiskovú hladinu A1C <8% a viac ako 90% malo A1C <9%).
Tabuľka 6: Glykemické parametre v 52týždňovej štúdii porovnávajúce sitagliptín s glipizidom ako doplnkovú liečbu u pacientov nedostatočne kontrolovaných metformínom (populácia zameraná na liečbu) *
| Sitagliptín 100 mg + Metformín |
glipizid + Metformín |
|
| ||
| A1C (%) | N = 576 | N = 559 |
| Základná hodnota (stredná hodnota) | 7.7 | 7.6 |
| Zmena zo základnej línie (upravený priemer†) | -0.5 | -0.6 |
| FPG (mg / dl) | N = 583 | N = 568 |
| Základná hodnota (stredná hodnota) | 166 | 164 |
| Zmena zo základnej línie (upravený priemer†) | -8 | -8 |
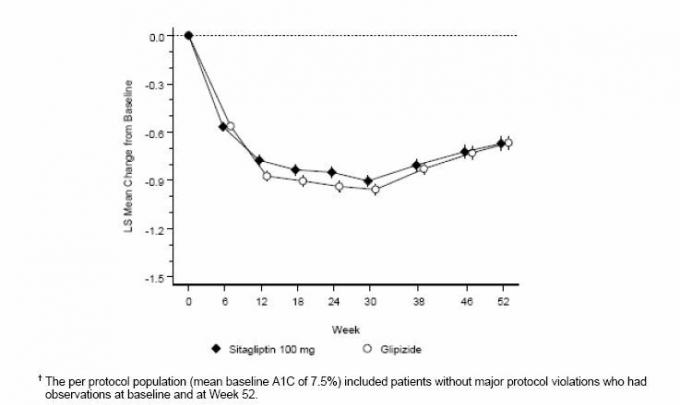
Obrázok 2: Priemerná zmena oproti základnej hodnote pre A1C (%) počas 52 týždňov v štúdii porovnávajúcej sitagliptín s Glipizid ako doplnková terapia u pacientov nedostatočne kontrolovaných metformínom (populácia podľa protokolu) â€
Výskyt hypoglykémie v skupine so sitagliptínom (4,9%) bol významne (p <0,001) nižší ako v skupine s glipizidom (32,0%). Pacienti liečení sitagliptínom vykazovali významné priemerné zníženie telesnej hmotnosti oproti východiskovým hodnotám v porovnaní s významným prírastkom hmotnosti u pacientov, ktorým bol podávaný glipizid (-1,5 kg oproti +1,1 kg).
top
Ako dodávané
6747 - Tablety Janumet, 50 mg / 500 mg, sú svetloružové, filmom obalené tablety v tvare kapsuly s vyrazením „575“ na jednej strane. Dodávajú sa nasledovne:
NDC 0006-0575-61 fľaše na jedno použitie s obsahom 60
NDC 0006-0575-62 fľaše na jedno použitie so 180
NDC 0006-0575-52 blistrové balenia s jednotkovou dávkou po 50 ks
NDC 0006-0575-82 fľaše s objemom 1000.
6749 - Tablety Janumet, 50 mg / 1 000 mg, sú červené filmom obalené tablety v tvare kapsuly s vyrazením „577“ na jednej strane. Dodávajú sa nasledovne:
NDC 0006-0577-61 fľaše na jedno použitie s obsahom 60
NDC 0006-0577-62 fľaše na jedno použitie so 180
NDC 0006-0577-52 blistrové balenia s jednotkovou dávkou po 50 ks
NDC 0006-0577-82 fľaše s objemom 1000.
Uchovávajte pri teplote 20 - 25 ° C (exkurzie) povolené pri teplote 15 - 30 ° C (59 - 86 ° F).
top
Informácie o poradenstve pre pacientov
Inštrukcie
Pacienti majú byť informovaní o potenciálnych rizikách a výhodách Janumetu ao alternatívnych spôsoboch liečby. Mali by byť informovaní aj o dôležitosti dodržiavania diétnych pokynov, pravidelnej fyzickej aktivity, pravidelnej krvi monitorovanie glukózy a testovanie A1C, rozpoznávanie a riadenie hypoglykémie a hyperglykémie a hodnotenie diabetu komplikácie. Počas období stresu, ako je horúčka, trauma, infekcia alebo chirurgický zákrok, sa môžu požiadavky na lieky zmeniť a pacienti by mali byť poučení, aby okamžite vyhľadali lekársku pomoc.
Riziká laktátovej acidózy v dôsledku metformínovej zložky, jej príznakov a stavov, ktoré predisponujú k jej vývoju, ako je uvedené v Varovania a bezpečnostné opatrenia, by sa malo vysvetliť pacientom. Pacientom by sa malo odporučiť, aby okamžite prerušili liečbu liekom Janumet a aby okamžite informovali svojho lekára v prípade nevysvetliteľnej hyperventilácie, myalgie, nevoľnosť, nezvyčajná ospalosť, závraty, pomalý alebo nepravidelný srdcový rytmus, pocit chladu (najmä na končatinách) alebo iné nešpecifické príznaky nastať. Gastrointestinálne príznaky sú časté počas začatia liečby metformínom a môžu sa vyskytnúť počas začatia liečby Janumetom; ak sa u nich objavia nevysvetlené príznaky, mali by sa poradiť so svojím lekárom. Hoci gastrointestinálne symptómy, ktoré sa vyskytujú po stabilizácii, pravdepodobne nesúvisia s liekom, sú napr výskyt symptómov by sa mal vyhodnotiť, aby sa určilo, či to môže byť spôsobené laktátovou acidózou alebo iným závažným choroby.
Počas liečby Janumetom je potrebné pacientov informovať o nadmernom príjme alkoholu, či už akútnom alebo chronickom.
Počas liečby Janumetom je potrebné pacientov informovať o dôležitosti pravidelného testovania funkcie obličiek a hematologických parametrov.
Pacienti majú byť informovaní, že počas postmarketingového používania sitagliptínu, jednej zo zložiek lieku Janumet, boli hlásené alergické reakcie. Pri príznakoch alergických reakcií (vrátane vyrážky, žihľavky a opuchu tváre, pier, jazyka a hrdla) sa môžu vyskytnúť spôsobiť ťažkosti s dýchaním alebo prehĺtaním), pacienti musia prestať užívať Janumet a vyhľadať lekársku pomoc okamžite.
Lekári majú poučiť svojich pacientov, aby si pred začatím liečby liekom Janumet prečítali príbalový leták pre pacienta a aby si pri každom obnovení predpisovania prečítali znova. Pacienti majú byť poučení, aby informovali svojho lekára alebo lekárnika, ak sa u nich vyskytnú akékoľvek nezvyčajné príznaky alebo ak akýkoľvek známy príznak pretrváva alebo sa zhoršuje.
Laboratórne testy
Odpoveď na všetky diabetické terapie by sa mala monitorovať pravidelnými meraniami hladiny glukózy v krvi a hladín A1C s cieľom znížiť tieto hladiny smerom k normálnemu rozsahu. A1C je zvlášť užitočný na hodnotenie dlhodobej glykemickej kontroly.
Počiatočné a periodické monitorovanie hematologických parametrov (napr. Hemoglobínu / hematokritu a červenej krvi indexy buniek) a funkcia obličiek (sérový kreatinín) by sa mali vykonávať aspoň raz ročne. Aj keď megaloblastická anémia bola pri liečbe metformínom zriedkavo pozorovaná, v prípade podozrenia na ňu by sa mal vylúčiť nedostatok vitamínu B12.
Distribuovaný:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
9794108
US patent č.: 6 699 871
1Registrovaná ochranná známka spoločnosti MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
2Trademark spoločnosti MERCK & CO., Inc., Whitehouse Station, New Jersey 08889 USA
3GLUCOPHAGE® je registrovaná ochranná známka spoločnosti Merck Sante S.A.S, spoločník spoločnosti Merck KGaA v Darmstadte v Nemecku.
Licencia je poskytnutá spoločnosti Bristol-Myers Squibb.
AUTORSKÉ PRÁVO © 2007, 2008 MERCK & CO., Inc.
Všetky práva vyhradené
Označovanie pacientov schválené FDA
Informácie o pacientovi
Janumet® (JAN-you-met)
(sitagliptín / metformín HCl)
tablety
Predtým, ako ju začnete užívať, a zakaždým, keď dostanete doplnenie, prečítajte si informácie o pacientovi, ktoré sa dodávajú s liekom Janumet1. Môžu existovať nové informácie. Táto písomná informácia pre používateľov nenahrádza rozhovor so svojím lekárom o vašom zdravotnom stave alebo liečbe.
Aké najdôležitejšie informácie by som mal vedieť o lieku Janumet?
Metformíniumchlorid, jedna zo zložiek lieku Janumet, môže spôsobiť zriedkavý, ale závažný vedľajší účinok nazývaný laktátová acidóza (nahromadenie kyseliny mliečnej v krvi), ktorý môže spôsobiť smrť. Laktátová acidóza je lekárska pohotovosť a musí sa liečiť v nemocnici.
Prestaňte užívať Janumet a okamžite vyhľadajte svojho lekára, ak sa u vás vyskytne ktorýkoľvek z nasledujúcich príznakov laktátovej acidózy:
- Cítiš sa veľmi slabý a unavený.
- Máte nezvyčajnú (nie normálnu) bolesť svalov.
- Máte problémy s dýchaním.
- Máte nevysvetlené žalúdočné alebo črevné problémy s nevoľnosťou a zvracaním alebo hnačkou.
- Cítite sa zima, hlavne v rukách a nohách.
- Cítite závraty alebo závraty.
- Máte pomalý alebo nepravidelný srdcový rytmus.
Máte vyššiu šancu na získanie laktátovej acidózy, ak:
- mať problémy s obličkami.
- mať problémy s pečeňou.
- máte kongestívne zlyhanie srdca, ktoré si vyžaduje liečbu liekmi.
- pite veľa alkoholu (veľmi často alebo krátkodobo „fajčenie“).
- dehydratovať (stratiť veľké množstvo telových tekutín). To sa môže stať, ak ste chorí s horúčkou, zvracaním alebo hnačkou. K dehydratácii môže dôjsť aj vtedy, keď sa veľa potíte aktivitou alebo cvičením a nepijete dostatok tekutín.
- mať určité röntgenové testy s injekčnými farbivami alebo kontrastnými látkami.
- mať operáciu.
- máte srdcový infarkt, závažnú infekciu alebo mozgovú príhodu.
- máte 80 rokov alebo viac a nemáte testovanú funkciu obličiek.
Čo je liek Janumet?
Tablety Janumet obsahujú dva lieky na predpis, sitagliptín (JANUVIA ™ 2) a metformín. Liek Janumet sa môže používať spolu s diétou a cvičením na zníženie hladiny cukru v krvi u dospelých pacientov s cukrovkou 2. typu. Váš lekár určí, či je Janumet pre vás ten pravý a určí najlepší spôsob, ako začať a pokračovať v liečbe cukrovky.
Janumet:
- pomáha zvyšovať hladinu inzulínu po jedle.
- pomáha telu lepšie reagovať na inzulín, ktorý vytvára.
- znižuje množstvo cukru vyrobeného v tele.
- je nepravdepodobné, že spôsobí nízku hladinu cukru v krvi (hypoglykémia), keď sa užíva na liečbu vysokej hladiny cukru v krvi.
Liek Janumet sa neskúmal u detí mladších ako 18 rokov.
Janumet sa neskúmal s inzulínom, liekom, o ktorom je známe, že spôsobuje nízku hladinu cukru v krvi.
Kto by nemal užívať liek Janumet?
Neužívajte Janumet, ak:
- mať diabetes 1. typu.
- mať určité problémy s obličkami.
- máte stavy nazývané metabolická acidóza alebo diabetická ketoacidóza (zvýšené ketóny v krvi alebo moči).
- mali alergickú reakciu na Janumet alebo sitagliptín (JANUVIA), jednu zo zložiek Janumetu.
- dostanú injekciu farbiva alebo kontrastných látok na röntgenové vyšetrenie, Janumet bude potrebné na krátku dobu zastaviť. Porozprávajte sa so svojím lekárom o tom, kedy zastaviť liečbu Janumetom a kedy začať znova. Pozrite si „Čo sú najdôležitejšie informácie, ktoré by som mal vedieť o lieku Janumet?“
Čo by som mal povedať svojmu lekárovi pred liečbou a počas liečby Janumetom?
Janumet nemusí byť pre vás to pravé. Povedzte svojmu lekárovi o všetkých vašich zdravotných stavoch, vrátane prípadov, keď:
- mať problémy s obličkami.
- mať problémy s pečeňou.
- mali alergickú reakciu na Janumet alebo sitagliptín (JANUVIA), jednu zo zložiek Janumetu.
- máte srdcové problémy vrátane kongestívneho zlyhania srdca.
- sú staršie ako 80 rokov. Pacienti starší ako 80 rokov by nemali užívať Janumet, pokiaľ nie je skontrolovaná ich funkcia obličiek a je to normálne.
- pite veľa alkoholu (stále alebo krátkodobo „fajčenie“).
- ste tehotná alebo plánujete otehotnieť. Nie je známe, či Janumet poškodí vaše nenarodené dieťa. Ak ste tehotná, porozprávajte sa so svojím lekárom o najlepšom spôsobe kontroly hladiny cukru v krvi počas tehotenstva. Ak používate Janumet počas tehotenstva, porozprávajte sa so svojím lekárom o tom, ako môžete byť v registri Janumet. Bezplatné telefónne číslo pre register tehotenstva je 1-800-986-8999.
- dojčia alebo plánujú dojčiť. Nie je známe, či Janumet prechádza do materského mlieka. Ak užívate Janumet, porozprávajte sa so svojím lekárom o najlepšom spôsobe kŕmenia dieťaťa.
Povedzte svojmu lekárovi o všetkých liekoch, ktoré užívate, vrátane liekov na lekársky predpis a bez lekárskeho predpisu, vitamínov a rastlinných doplnkov. Janumet môže ovplyvniť, ako dobre fungujú iné lieky, a niektoré lieky môžu ovplyvniť, ako dobre Janumet účinkuje.
Poznajte lieky, ktoré užívate. Uschovajte si zoznam svojich liekov a keď dostanete nový liek, ukážte ich lekárovi a lekárnikovi. Skôr ako začnete užívať nový liek, povedzte to svojmu lekárovi.
Ako by som mal užívať liek Janumet?
- Váš lekár vám povie, koľko tabliet Janumet máte užiť a ako často ich máte užívať. Užívajte Janumet presne tak, ako Vám povedal lekár.
- Váš lekár možno bude musieť zvýšiť vašu dávku, aby mohol kontrolovať hladinu cukru v krvi.
- Váš lekár vám môže predpísať Janumet spolu so sulfonylmočovinou (ďalší liek na zníženie hladiny cukru v krvi). Pozri „Aké sú možné vedľajšie účinky lieku Janumet?“ informácie o zvýšenom riziku nízkej hladiny cukru v krvi.
- Užívajte Janumet spolu s jedlom, aby ste znížili riziko žalúdka.
- Pokračujte v užívaní Janumetu tak dlho, ako Vám povedal lekár.
- Ak užijete priveľa Janumetu, zavolajte ihneď svojho lekára alebo toxikologické stredisko.
- Ak vynecháte dávku, užite ju s jedlom, len čo si spomeniete. Ak si nepamätáte, kým nie je čas na ďalšiu dávku, vynechajte vynechanú dávku a vráťte sa k svojmu pravidelnému rozvrhu. Neužívajte dve dávky Janumetu súčasne.
- Možno budete musieť prestať užívať Janumet na krátky čas. Požiadajte svojho lekára o pokyny, ak:
- sú dehydrované (stratili príliš veľa telesnej tekutiny). Dehydratácia sa môže vyskytnúť, ak ste chorí so silným zvracaním, hnačkou alebo horúčkou alebo ak pijete oveľa menej tekutín, ako je obvyklé.
- plán na operáciu.
- dostanú injekciu farbiva alebo kontrastného činidla na röntgenové vyšetrenie.
Pozrite si „Čo sú najdôležitejšie informácie, ktoré by som mal vedieť o lieku Janumet?“ a „Kto by nemal užívať liek Janumet?“
- Ak je vaše telo vystavené stresu, ako je horúčka, trauma (napríklad pri dopravnej nehode), infekcia alebo chirurgický zákrok, môže sa zmeniť množstvo liekov na diabetes, ktoré potrebujete. Ak máte niektorý z týchto stavov, okamžite to oznámte svojmu lekárovi a riaďte sa pokynmi svojho lekára.
- Sledujte hladinu cukru v krvi podľa pokynov lekára.
- Počas užívania Janumetu dodržujte predpísanú diétu a cvičebný program.
- Porozprávajte sa so svojím lekárom o tom, ako predchádzať, rozpoznať a zvládnuť nízku hladinu cukru v krvi (hypoglykémia), vysokú hladinu cukru v krvi (hyperglykémiu) a komplikácie pri cukrovke.
- Váš lekár bude monitorovať Váš diabetes pravidelnými krvnými testami, vrátane hladiny cukru v krvi a hemoglobínu A1C.
- Váš lekár vykoná krvné testy, aby skontroloval funkciu obličiek pred a počas liečby Janumetom.
Aké sú možné vedľajšie účinky lieku Janumet?
Janumet môže spôsobiť vážne vedľajšie účinky. Pozrite si „Čo sú najdôležitejšie informácie, ktoré by som mal vedieť o lieku Janumet?“
Časté vedľajšie účinky pri užívaní Janumetu sú:
- upchatý alebo výtok z nosa a bolesť hrdla
- infekcia horných dýchacích ciest
- hnačka
- nevoľnosť a zvracanie
- plyn, žalúdočné ťažkosti, tráviace ťažkosti
- slabosť
- bolesť hlavy
Užívanie Janumetu s jedlom môže pomôcť znížiť bežné vedľajšie účinky metformínu, ktoré sa zvyčajne vyskytujú na začiatku liečby, na žalúdok. Ak máte nezvyčajné alebo neočakávané problémy so žalúdkom, povedzte to svojmu lekárovi. Problémy so žalúdkom, ktoré sa objavia neskôr počas liečby, môžu byť príznakom niečoho vážnejšieho.
Niektoré lieky na cukrovku, ako napríklad sulfonylmočoviny a meglitinidy, môžu spôsobiť nízku hladinu cukru v krvi (hypoglykémia). Ak sa Janumet používa s týmito liekmi, môžete mať príliš nízku hladinu cukru v krvi. Váš lekár vám môže predpísať nižšie dávky sulfonylmočoviny alebo meglitinidu. Ak máte problémy s nízkou hladinou cukru v krvi, povedzte to svojmu lekárovi.
Pri používaní Janumetu alebo sitagliptínu sa všeobecne hlásili nasledujúce vedľajšie účinky:
- S Janumetom alebo sitagliptínom, jedným z liekov lieku Janumet, sa môžu vyskytnúť závažné alergické reakcie. Medzi príznaky závažnej alergickej reakcie patria vyrážky, žihľavka a opuch tváre, pier, jazyka a hrdla, ťažkosti s dýchaním alebo prehĺtaním. Ak máte alergickú reakciu, prestaňte užívať Janumet a ihneď zavolajte svojho lekára. Váš lekár vám môže predpísať liek na liečbu alergickej reakcie a iný liek na cukrovku.
- Zvýšené pečeňové enzýmy.
- Zápal podžalúdkovej žľazy.
Nie sú to všetky možné vedľajšie účinky lieku Janumet. Viac informácií získate od svojho lekára.
Povedzte svojmu lekárovi, ak máte akékoľvek vedľajšie účinky, ktoré vám bránia, sú nezvyčajné alebo nezmiznú.
Ako mám Janumet uchovávať?
Skladujte Janumet pri izbovej teplote, 20-25 ° C.
Uchovávajte Janumet a všetky lieky mimo dosahu detí.
Všeobecné informácie o používaní lieku Janumet
Lieky sa niekedy predpisujú pre stavy, ktoré nie sú uvedené v informáciách pre používateľov. Nepoužívajte Janumet na stav, na ktorý nebolo predpísané. Nedávajte Janumet iným ľuďom, aj keď majú rovnaké príznaky. Môže im to uškodiť.
V tejto písomnej informácii pre používateľov sú zhrnuté najdôležitejšie informácie o lieku Janumet. Ak by ste chceli vedieť viac informácií, obráťte sa na svojho lekára. Môžete požiadať svojho lekára alebo lekárnika o informácie o lieku Janumet, ktorý je určený pre zdravotníckych pracovníkov. Pre viac informácií volajte 1-800-622-4477.
Aké sú zložky lieku Janumet?
Účinné látky: sitagliptín a metformíniumchlorid.
Neaktívne zložky: mikrokryštalická celulóza, polyvinylpyrolidón, laurylsulfát sodný a stearylfumarát sodný. Filmový poťah tablety obsahuje nasledujúce neaktívne zložky: polyvinylalkohol, polyetylénglykol, mastenec, oxid titaničitý, červený oxid železitý a čierny oxid železitý.
Čo je to cukrovka 2. typu?
Cukrovka 2. typu je stav, pri ktorom vaše telo nevytvára dostatok inzulínu a inzulín, ktorý vaše telo produkuje, nefunguje tak dobre, ako by mal. Vaše telo môže tiež vyrobiť priveľa cukru. Ak k tomu dôjde, v krvi sa hromadí cukor (glukóza). To môže viesť k vážnym zdravotným problémom.
Hlavným cieľom liečby cukrovky je znížiť hladinu cukru v krvi na normálnu úroveň. Zníženie a kontrola hladiny cukru v krvi môže pomôcť predchádzať alebo oddialiť komplikácie cukrovky, ako sú srdcové problémy, problémy s obličkami, slepota a amputácia.
Vysoká hladina cukru v krvi môže byť znížená diétou a cvičením av prípade potreby určitými liekmi.
Vydané v marci 2009
Distribuovaný:
MERCK & CO., INC., Whitehouse Station, NJ 08889, USA
Posledná aktualizácia: 03/09
Janumet, sitagliptín a metformín hydrochlorid, informácie o pacientovi (v jednoduchej angličtine)
Podrobné informácie o príznakoch, príznakoch, príčinách, liečbe cukrovky
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
späť k: Prejdite si všetky lieky na diabetes



