Byetta na liečbu cukrovky
Názov značky: Byetta
Všeobecné meno: exenatid
Dávkovacia forma: Injekcia
obsah:
popis
Klinická farmakológia
Klinické štúdie
Indikácie a použitie
kontraindikácie
Opatrenia
Nežiaduce reakcie
predávkovania
Dávkovanie a spôsob podávania
skladovanie
Ako dodávané
Informácie o pacientovi Byetta (exenatide) (v jednoduchej angličtine)
popis
Byetta® (exenatid) je syntetický peptid, ktorý má inkretín-mimetické účinky a bol pôvodne identifikovaný v jašterici Heloderma suspectum. Byetta zvyšuje sekréciu inzulínu v závislosti od glukózy pankreatickými beta-bunkami, potláča neprimerane zvýšenú sekréciu glukagónu a spomaľuje vyprázdňovanie žalúdka. Exenatid sa líši chemickou štruktúrou a farmakologickým účinkom od inzulínu, sulfonylmočovín (vrátane Deriváty D-fenylalanínu a meglitinidy), biguanidy, tiazolidíndióny a alfa-glukozidáza inhibítory.
Exenatid je peptidový amid s 39 aminokyselinami. Exenatid má empirický vzorec C184H282N50O60S a molekulová hmotnosť 4186,6 Daltonov. Aminokyselinová sekvencia exenatidu je uvedená nižšie.
H - His - Gly - Glu - Gly - Thr - Phe - Thr - Ser - Asp - Leu - Ser - Lys - Gln - Met - Glu - Glu - Glu - Ala - Val - Arg - Leu - Phe - Ile - Glu - Trp - Leu - Lys - Asn - Gly - Gly - Pro - Ser - Ser - Gly - Ala - Pro - Pro - Pro - Ser - NH2
Byetta sa dodáva na subkutánnu injekciu (SC) ako sterilný konzervovaný izotonický roztok v sklenenej náplni, ktorá bola zostavená v injektore na pero (pero). Každý mililiter (ml) obsahuje 250 mikrogramov (mcg) syntetického exenatidu, 2,2 mg metakrezolu ako antimikrobiálneho konzervačného činidla, manitol ako činidlo upravujúce tonicitu a ľadová kyselina octová a trihydrát octanu sodného vo vode na injekciu ako tlmivý roztok pri pH 4,5. K dispozícii sú dve predplnené perá na podávanie jednotkových dávok 5 mcg alebo 10 mcg. Každé naplnené pero dodá 60 dávok, aby sa dosiahlo 30 dní podávania dvakrát denne (BID).
top
Klinická farmakológia
Mechanizmus akcie
Inkretíny, ako je glukagónu podobný peptid-1 (GLP-1), zvyšujú sekréciu inzulínu závislú od glukózy a vykazujú ďalšie antihyperglykemické účinky po ich uvoľnení do obehu z čreva. Exenatid je mimetikum inkretínu, ktoré napodobňuje zvýšenie sekrécie inzulínu závislé od glukózy a niekoľko ďalších antihyperglykemických účinkov inkretínov.
Aminokyselinová sekvencia exenatidu sa čiastočne prekrýva so sekvenciou ľudského GLP-1. Ukázalo sa, že exenatid sa viaže a aktivuje známy ľudský receptor GLP-1 in vitro. To vedie k zvýšeniu syntézy inzulínu závislej od glukózy a sekrécii inzulínu in vivo z pankreatických beta buniek mechanizmami zahŕňajúcimi cyklický AMP a / alebo inú intracelulárnu signalizáciu dráh. Exenatid podporuje uvoľňovanie inzulínu z beta buniek v prítomnosti zvýšených koncentrácií glukózy. Keď sa exenatid podáva in vivo, napodobňuje určité antihyperglykemické účinky GLP-1.
Byetta zlepšuje kontrolu glykémie znížením hladín glukózy nalačno a postprandiálnej koncentrácie glukózy u pacientov s diabetom 2. typu pomocou nižšie opísaných účinkov.
Glukóza-dependentná sekrécia inzulínu: Byetta má akútne účinky na reakciu beta-buniek pankreasu na glukózu a vedie k uvoľňovaniu inzulínu iba za prítomnosti zvýšených koncentrácií glukózy. Táto sekrécia inzulínu ustupuje, keď sa koncentrácia glukózy v krvi znižuje a blíži sa k euglykémii.
Prvá fáza inzulínovej odpovede: U zdravých jedincov dochádza k silnej sekrécii inzulínu počas prvých 10 minút po intravenóznom podaní (IV) glukózy. Táto sekrécia, známa ako „prvá fáza inzulínovej odpovede“, je charakteristická u pacientov s diabetom 2. typu. Strata inzulínovej odpovede v prvej fáze je skorý defekt beta-buniek pri diabete 2. typu. Podávanie Byetty pri terapeutických plazmatických koncentráciách obnovilo prvú fázu inzulínovej odpovede na IV bolus glukózy u pacientov s cukrovkou 2. typu (obrázok 1). U pacientov s diabetes mellitus 2. typu liečených Byetta v porovnaní s fyziologickým roztokom (p
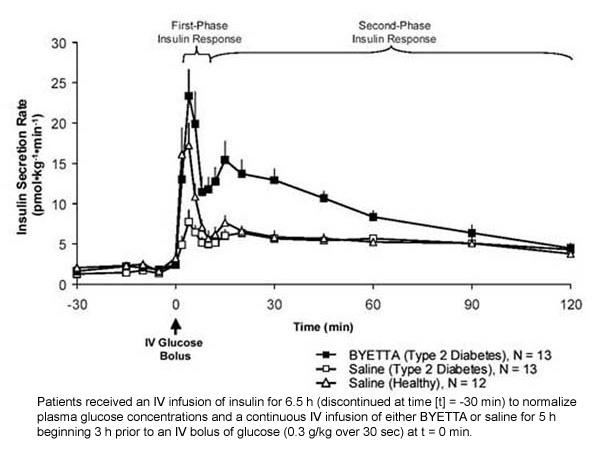
Postava 1: Priemerný (+ SEM) stupeň sekrécie inzulínu počas infúzie byéty alebo fyziologického roztoku u pacientov s cukrovkou 2. typu a počas infúzie soľného roztoku u zdravých jedincov
Glukagónová sekrécia: Byetta u pacientov s cukrovkou 2. typu zmierňuje sekréciu glukagónu a znižuje koncentráciu glukagónu v sére počas hyperglykémie. Nižšie koncentrácie glukagónu vedú k zníženiu produkcie glukózy v pečeni a zníženej potrebe inzulínu. Byetta však nenarušuje normálnu glukagónovú odpoveď na hypoglykémiu.
Vyprázdňovanie žalúdka: Byetta spomaľuje vyprázdňovanie žalúdka, čím znižuje rýchlosť, pri ktorej sa glukóza získaná z jedla objavuje v obehu.
Príjem potravy: Ukázalo sa, že podávanie exenatidu u zvierat a ľudí znižuje príjem potravy.
farmakokinetika
vstrebávanie
Po podaní SC pacientom s cukrovkou 2. typu dosahuje exenatid strednú maximálnu plazmatickú koncentráciu za 2,1 hodiny. Priemerná maximálna koncentrácia exenatidu (Cmax) bola 211 pg / ml a celková priemerná plocha pod krivkou (AUCO-inf) bola 1036 pg-h / ml po podaní SC dávky 10 mcg Byetty. Expozícia exenatidu (AUC) sa zvyšovala úmerne v rozmedzí terapeutických dávok od 5 mcg do 10 mcg. Hodnoty Cmax sa v rovnakom rozsahu zvýšili menej ako proporcionálne. Podobná expozícia sa dosiahne pri SC podaní Byetty do brucha, stehna alebo ramena.
distribúcia
Priemerný zdanlivý distribučný objem exenatidu po podaní jednej dávky Byetty SC je 28,3 l.
Metabolizmus a eliminácia
Neklinické štúdie ukázali, že exenatid sa vylučuje prevažne glomerulárnou filtráciou s následnou proteolytickou degradáciou. Priemerný zdanlivý klírens exenatidu u ľudí je 9,1 l / ha priemerný terminálny polčas je 2,4 hodiny. Tieto farmakokinetické vlastnosti exenatidu sú nezávislé od dávky. U väčšiny jedincov sú koncentrácie exenatidu merateľné približne 10 hodín po podaní dávky.
Osobitné skupiny obyvateľstva
Renálna nedostatočnosť
U pacientov s miernym až stredne ťažkým poškodením obličiek (klírens kreatinínu 30 až 80 ml / min) bol klírens exenatidu iba mierne znížený; preto nie je potrebná úprava dávkovania Byetty u pacientov s miernym až stredne ťažkým poškodením obličiek. Avšak u pacientov s terminálnym ochorením obličiek, ktorí dostávajú dialýzu, je priemerný klírens exenatidu znížený na 0,9 l / h v porovnaní s 9,1 l / h u zdravých jedincov (pozri OPATRENIA, Všeobecné).
Hepatálna nedostatočnosť
U pacientov s diagnózou akútnej alebo chronickej hepatálnej insuficiencie sa nevykonala žiadna farmakokinetická štúdia. Pretože exenatid sa vylučuje predovšetkým obličkami, neočakáva sa, že dysfunkcia pečene ovplyvní koncentrácie exenatidu v krvi (pozri pozri časť 4.4). farmakokinetika, Metabolizmus a eliminácia).
geriatrickej
Populačná farmakokinetická analýza pacientov (v rozmedzí od 22 do 73 rokov) naznačuje, že vek nemá vplyv na farmakokinetické vlastnosti exenatidu.
Pediatric
Exenatid sa u pediatrických pacientov neskúmal.
rod
Populačná farmakokinetická analýza pacientov a mužov naznačuje, že pohlavie nemá vplyv na distribúciu a elimináciu exenatidu.
závod
Populačná farmakokinetická analýza pacientov vrátane kaukazských, hispánskych a čiernych pacientov naznačuje, že rasa nemá významný vplyv na farmakokinetiku exenatidu.
Obezita
Populačná farmakokinetická analýza obéznych (BMI ¥ ‰ 30 kg / m2) a neobéznych pacientov naznačuje, že obezita nemá významný vplyv na farmakokinetiku exenatidu.
Liekové interakcie
digoxín
Súbežné podávanie opakovaných dávok Byetty (10 mcg BID) znížilo Cmax perorálneho digoxínu (0,25 mg QD) o 17% a oneskorenie Tmax približne o 2,5 hodiny; celková farmakokinetická expozícia v rovnovážnom stave (AUC) sa však nezmenila.
lovastatín
AUC lovastatínu a Cmax sa znížili približne o 40%, respektíve 28%, a Tmax sa oneskoril približne o 4 hodiny, keď bol liek Byetta (10 mcg BID) sa podával súbežne s jednou dávkou lovastatínu (40 mg) v porovnaní s podávaním lovastatínu sám. V 30-týždňových kontrolovaných klinických skúšaniach s liekom Byetta bolo použitie lieku Byetta u pacientov, ktorí už dostávali HMG Inhibítory CoA reduktázy neboli spojené s konzistentnými zmenami lipidových profilov v porovnaní s baseline.
lizinopril
U pacientov s miernou až stredne ťažkou hypertenziou stabilizovanou na lisinopril (5 až 20 mg / deň), Byetta (10 mcg BID) nezmenila Cmax v rovnovážnom stave alebo AUC lisinoprilu. Lisinopril v rovnovážnom stave Tmax bola oneskorená o 2 hodiny. Nezistili sa žiadne zmeny v priemernom systolickom a diastolickom krvnom tlaku trvajúcom 24 hodín.
acetaminofénu
Keď sa 1000 mg acetaminofén elixíru podalo s 10 mcg Byetta (0 h) a 1 h, 2 h a 4 h po injekcii Byetty, AUC acetaminofénu sa znížili o 21%, 23%, 24% a 14%; Cmax bola znížená o 37%, 56%, 54% a 41%; Tmax sa zvýšila z 0,6 hodiny v kontrolnom období na 0,9 hodiny, 4,2 hodiny, 3,3 hodiny, respektíve 1,6 hodiny. AUC, C. Acetaminofénumax a Tmax sa významne nezmenili, keď sa acetaminofén podal 1 hodinu pred injekciou Byetty.
warfarín
Súbežné podávanie opakovaných dávok Byetty (5 mcg BID v dňoch 1 - 2 a 10 mcg BID v dňoch 3 - 9) u zdravých dobrovoľníkov oneskorilo podávanie warfarínu (25 mg) Tmax približne o 2 hodiny. Neboli pozorované žiadne klinicky významné účinky S- a R-enantiomérov warfarínu na Cmax alebo AUC. Byetta nezmenil farmakodynamické vlastnosti warfarínu (hodnotené podľa odpovede INR).
farmakodynamika
Postprandiálna glukóza
U pacientov s cukrovkou 2. typu, Byetta znižuje postprandiálnu koncentráciu glukózy v plazme (obrázok 2).
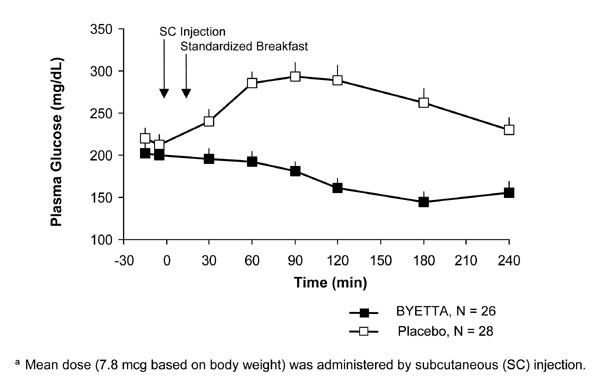
Obrázok 2: Priemerná (+ SEM) koncentrácia glukózy v plazme po jedle v 1. deň od Byetty Liečba pacientov s diabetom 2. typu liečených metformínom, sulfonylmočovinou alebo oboma (N = 54)
Glukóza nalačno
V jednorazovej skríženej štúdii u pacientov s cukrovkou 2. typu a hyperglykémiou nalačno nasledovalo po injekcii Byetty okamžité uvoľnenie inzulínu. Koncentrácie glukózy v plazme boli pri lieku Byetta v porovnaní s placebom významne znížené (obrázok 3).

Obrázok 3: Priemerné (+ SEM) koncentrácie inzulínu v sére a plazmatickej glukózy po jednorazovej injekcii Byetty alebo Placebo u pacientov nalačno s diabetom 2. typu (N = 12)
top
Klinické štúdie
Používajte spolu s metformínom a / alebo sulfonylmočovinou
Boli vykonané tri 30-týždňové, dvojito zaslepené, placebom kontrolované štúdie, aby sa vyhodnotila bezpečnosť a účinnosť lieku Byetta u pacientov s typom 2 cukrovka, ktorej glykemická kontrola nebola dostatočná pri použití samotného metformínu, samotnej sulfonylmočoviny alebo metformínu v kombinácii s sulfonylurea.
V týchto troch štúdiách bolo randomizovaných celkom 1446 pacientov: 991 (68,5%) bolo belošských, 224 (15,5%) bolo hispánskych a 174 (12,0%) bolo čiernych. Priemerné hodnoty HbA1c na začiatku štúdie sa pohybovali od 8,2% do 8,7%. Po štvortýždňovom úvodnom období placeba boli pacienti náhodne pridelení na užívanie lieku Byetta 5 mcg BID, Byetta 10 mcg BID alebo placebo BID pred ranným a večerným jedlom, navyše k ich existujúcim perorálnym antidiabetikám agenta. Všetci pacienti, ktorí boli zaradení do skupiny Byetta, začali s liečbou 5 mcg BID po dobu 4 týždňov. Po 4 týždňoch títo pacienti buď dostávali Byetta 5 mcg BID, alebo sa ich dávka zvýšila na 10 mcg BID. Pacienti zaradení do placeba dostávali placebo počas celej štúdie.
Primárnym cieľovým ukazovateľom v každej štúdii bola priemerná zmena oproti východiskovej hodnote HbA1c po 30 týždňoch. Výsledky tridsaťtýždňovej štúdie sú zhrnuté v tabuľke 1.
Tabuľka 1: Výsledky tridsaťtýždňových placebom kontrolovaných pokusov o byte u pacientov s nedostatočnou kontrolou glukózy napriek použitiu metformínu, sulfonylmočoviny alebo obidvoch
| placebo BID |
Byetta 5 mcg BID |
Byetta 10 mcg* BID |
|
|---|---|---|---|
| |||
| V kombinácii s metformínom | |||
| Obyvateľstvo, ktoré sa má liečiť (N) | 113 | 110 | 113 |
| HbA1c (%), Priemer | |||
| Baseline | 8.2 | 8.3 | 8.2 |
| Zmena v 30. týždni | +0.1 | −0.4†| −0.8C |
| Proportion Dosing HbA1c≤7% § | 13.0% | 31.6%†| 46.4%†|
| Telesná hmotnosť (kg), priemer | |||
| Baseline | 99.9 | 100.0 | 100.9 |
| Zmena v 30. týždni | −0.3 | −1.6†| −2.8C |
| V kombinácii so sulfonylmočovinou | |||
| Obyvateľstvo, ktoré sa má liečiť (N) | 123 | 125 | 129 |
| HbA1c (%), Priemer | |||
| Baseline | 8.7 | 8.5 | 8.6 |
| Zmena v 30. týždni | +0.1 | −0.5†| −0.9C |
| Proportion Dosing HbA1c≤7% § | 8.8% | 32.6%†| 41.3%C |
| Telesná hmotnosť (kg), priemer | |||
| Baseline | 99.1 | 94.9 | 95.2 |
| Zmena v 30. týždni | −0.6 | −0.9 | −1.6†|
| V kombinácii s metformínom a sulfonylmočovinou | |||
| Obyvateľstvo, ktoré sa má liečiť (N) | 247 | 245 | 241 |
| HbA1c (%), Priemer | |||
| Baseline | 8.5 | 8.5 | 8.5 |
| Zmena v 30. týždni | +0.2 | −0.6C | −0.8C |
| Proportion Dosing HbA1c≤7% § | 9.2% | 27.4%C | 33.5%C |
| Telesná hmotnosť (kg), priemer | |||
| Baseline | 99.1 | 96.9 | 98.4 |
| Zmena v 30. týždni | −0.9 | −1.6†| −1.6†|
HbA1c
Pridanie lieku Byetta do režimu metformínu, sulfonylmočoviny alebo obidvoch viedlo k štatisticky významnému zníženiu oproti východiskovej hodnote HbA.1c v 30. týždni v porovnaní s pacientmi, ktorí dostávali placebo, pridané k týmto látkam v troch kontrolovaných štúdiách (stôl 1). Okrem toho sa pozoroval štatisticky významný účinok dávky medzi 5-mcg a 10-mcg Byettovými skupinami pre zmenu oproti základnej hladine HbA.1c v 30. týždni v týchto troch štúdiách.
Glukóza nalačno a po jedle
Dlhodobé používanie lieku Byetta v kombinácii s metformínom, sulfonylmočovinou alebo oboma látkami znížilo pôst aj hlad postprandiálne koncentrácie glukózy v plazme štatisticky významným spôsobom závislým od dávky do týždňa 30. Štatisticky významné zníženie priemerných hladín glukózy nalačno a postprandiálnej glukózy od základnej hodnoty sa pozoroval v 30. týždni v oboch skupinách Byetty v porovnaní s placebom v údajoch kombinovaných od troch kontrolovaných štúdií. Zmena koncentrácie glukózy na lačno na 30. týždeň v porovnaní s východiskovou hodnotou bola 8 mg / dl pre dávku Byetta 5 mcg BID a 10 mg / dl pre dávku Byetta 10 mcg v porovnaní s +12 mg / dl pre placebo. Zmena v 2-h postprandiálnej koncentrácii glukózy po podaní Byetty v 30. týždni sa porovnala s východiskovou hodnotou bola ˆ63 mg / dl pre 5 mg BID a 71 7171 mg / dl pre 10 mg BID v porovnaní s +11 mg / dl pre placebo.
Pomer pacientov dosahujúcich HbA1c≤7%
Byetta v kombinácii s metformínom, sulfonylmočovinou alebo oboma viedla k väčšej, štatisticky významnej podiel pacientov dosahujúcich HbA1câ ± 7% v 30. týždni v porovnaní s pacientmi, ktorí dostávali placebo v kombinácii s títo agenti (stôl 1).
Telesná hmotnosť
V troch kontrolovaných štúdiách bolo zníženie telesnej hmotnosti na začiatku 30. týždňa spojené s BIDom Byetta 10 mcg v porovnaní s placebom BID u pacientov s cukrovkou 2. typu (stôl 1).
Jednoročné klinické výsledky
V kohorte 163 pacientov z 30-týždňových placebom kontrolovaných štúdií, ktorí dokončili celkom 52 týždňov liečby Byetou 10 mcg BID, došlo k zmenám HbA1c oproti východiskovým hodnotám .0 1,0% a .1 1,1,1% po 30 a 52 týždňoch liečby, so sprievodnými zmenami oproti východiskovým hodnotám glukózy v plazme nalačno 14,0 mg / dl a 25,3 mg / dl a zmeny telesnej hmotnosti 2,6 kg a 3,6 kg. Táto kohorta mala východiskové hodnoty podobné hodnotám celej populácie v kontrolovanom skúšaní.
Používajte s tiazolidíndiónom
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii trvajúcej 16 týždňov sa pridal Byetta (n = 121) alebo placebo (n = 112) k existujúcim liečba tiazolidíndiónom (pioglitazón alebo rosiglitazón), s metformínom alebo bez metformínu, u pacientov s diabetom 2. typu s nedostatočným glykemická kontrola. Randomizácia na Byettu alebo placebo bola stratifikovaná na základe toho, či pacienti dostávali metformín. Pacienti zaradení do placeba dostávali placebo počas celej štúdie. Byetta alebo placebo sa injikovali subkutánne pred ranným a večerným jedlom. Sedemdesiatdeväť pacientov užívalo tiazolidíndión a metformín a 21% užívalo samotný tiazolidíndión. Väčšina pacientov (84%) bola belošská, 8% hispánskych a 3% čiernych. Priemerné východiskové hodnoty HbA1c boli podobné pre Byetta a placebo (7,9%). Liečba Byetou sa začala dávkou 5 mcg BID počas 4 týždňov, potom sa zvýšila na 10 mcg BID počas ďalších 12 týždňov.
Výsledky štúdie za 16 týždňov sú zhrnuté v tabuľke 2. V porovnaní s placebom spôsobil Byetta v 16. týždni štatisticky významné zníženie HbA1c od základnej línie. Liečebné účinky HbA1c boli podobné v dvoch podskupinách definovaných základnou liečebnou vrstvou (samotné tiazolidíndióny verzus tiazolidíndióny plus metformín). Zmena koncentrácie glukózy v sére nalačno z východiskovej hodnoty na 16. týždeň bola štatisticky významná v porovnaní s placebom („21 mg / dl pre Byetta 10 mg BID v porovnaní s +4 mg / dl pre placebo).
Tabuľka 2: Výsledky 16-týždňového placebom kontrolovaného pokusu o byte u pacientov s nedostatočnou kontrolou glukózy napriek použitiu tiazolidíndiónu (TZD) alebo tiazolidíndiónu plus metformínu
| placebo BID |
Byetta 10 mcg* BID |
|
|---|---|---|
| ||
| V kombinácii s TZD alebo TZD plus MET | ||
| Obyvateľstvo, ktoré sa má liečiť (N) | 112 | 121 |
| HbA1c (%), Priemer | ||
| Baseline | 7.9 | 7.9 |
| Zmena v 16. týždni | +0.1 | −0.8†|
| Proportion Dosing HbA1c≤7%C | 16.2% | 62.3%†|
| Telesná hmotnosť (kg), priemer | ||
| Baseline | 96.9 | 97.5 |
| Zmena v 16. týždni | −0.2 | −1.5†|
top
Indikácie a použitie
Byetta je indikovaná ako prídavná terapia na zlepšenie kontroly glykémie u pacientov s diabetes mellitus 2. typu, ktorí užívajú metformín, sulfonylmočovinu, tiazolidíndión, kombinácia metformínu a sulfonylmočoviny alebo kombinácia metformínu a tiazolidíndiónu, nedosiahli však adekvátnu glykemickú ovládanie.
top
kontraindikácie
Byetta je kontraindikovaná u pacientov so známou precitlivenosťou na exenatid alebo na niektorú zo zložiek lieku.
top
Opatrenia
všeobecný
Byetta nie je náhradou inzulínu u pacientov vyžadujúcich inzulín. Liek Byetta by nemali užívať pacienti s cukrovkou 1. typu alebo na liečbu diabetickej ketoacidózy.
U pacientov sa môžu vyvinúť anti-exenatidové protilátky po liečbe liekom Byetta, čo je v súlade s potenciálne imunogénnymi vlastnosťami proteínových a peptidových liečiv. U pacientov užívajúcich liek Byetta by sa mali sledovať príznaky a príznaky reakcií z precitlivenosti.
U malej časti pacientov by tvorba anti-exenatidových protilátok pri vysokých titroch mohla viesť k zlyhaniu pri dosiahnutí adekvátneho zlepšenia glykemickej kontroly. Ak sa zhoršuje kontrola glykémie alebo sa nedosahuje cielená kontrola glykémie, má sa zvážiť alternatívna antidiabetická liečba.
Súbežné použitie lieku Byetta s inzulínom, derivátmi D-fenylalanínu, meglitinidmi alebo inhibítormi alfa-glukozidázy sa neskúmalo.
Liek Byetta sa neodporúča používať u pacientov s konečným ochorením obličiek alebo s ťažkým poškodením funkcie obličiek (klírens kreatinínu, farmakokinetika, osobitné skupiny pacientov). U pacientov s terminálnym ochorením obličiek, ktorí dostávali dialýzu, neboli jednotlivé dávky Byetty 5 mcg kvôli gastrointestinálnym vedľajším účinkom dobre tolerované.
Zriedkavo boli spontánne hlásené udalosti so zmenenou funkciou obličiek vrátane zvýšeného séra kreatinín, poškodenie obličiek, zhoršenie chronického zlyhania obličiek a akútne zlyhanie obličiek, ktoré si niekedy vyžaduje hemodialýza. Niektoré z týchto udalostí sa vyskytli u pacientov, ktorí dostávali jedno alebo viac farmakologických látok, o ktorých je známe, že ovplyvňujú obličky funkčný / hydratačný stav a / alebo u pacientov s nevoľnosťou, zvracaním a / alebo hnačkou, s alebo bez dehydratácia. Sprievodnými látkami boli inhibítory angiotenzín konvertujúceho enzýmu, nesteroidné protizápalové lieky a diuretiká. Reverzibilita zmenenej funkcie obličiek bola pozorovaná pri podpornej liečbe a vysadení potenciálne príčinných látok vrátane exenatidu. V predklinických alebo klinických štúdiách sa nezistilo, že by exenatid bol priamo nefrotoxický.
Liek Byetta sa neskúmal u pacientov so závažným gastrointestinálnym ochorením vrátane gastroparézy. Jeho použitie je bežne spojené s gastrointestinálnymi nepriaznivými účinkami vrátane nevoľnosti, vracania a hnačky. Preto sa použitie Byetty neodporúča u pacientov so závažným gastrointestinálnym ochorením. U pacientov liečených Byetou by sa mal vyšetriť vývoj silnej bolesti brucha, pretože to môže byť varovným signálom vážneho stavu.
hypoglykémie
V 30-týždňových kontrolovaných klinických skúšaniach s liekom Byetta bola epizóda hypoglykémie zaznamenaná ako nežiaduca udalosť, ak pacient hlásil príznaky spojené s hypoglykémiou so sprievodnou dávkou glukózy v krvi a SPRÁVA).
Tabuľka 3: Výskyt (%) hypoglykémie * pri súbežnej antidiabetickej terapii
| Byetta | Byetta | Byetta | |||||||
|---|---|---|---|---|---|---|---|---|---|
| placebo BID |
5 mcg BID |
10 mcg BID |
placebo BID |
5 mcg BID |
10 mcg BID |
placebo BID |
5 mcg BID |
10 mcg BID |
|
| S metformínom | So sulfonylmočovinou | S MET / SFU | |||||||
| Byetta a placebo boli podávané pred ranným a večerným jedlom. | |||||||||
| Skratky: BID, dvakrát denne; MET / SFU, metformín a sulfonylmočovina. | |||||||||
| |||||||||
| N | 113 | 110 | 113 | 123 | 125 | 129 | 247 | 245 | 241 |
| hypoglykémie | 5.3% | 4.5% | 5.3% | 3.3% | 14.4% | 35.7% | 12.6% | 19.2% | 27.8% |
Pri použití ako prídavok k tiazolidíndiónu s metformínom alebo bez metformínu bol výskyt symptomatickej miernej až stredne ťažkej hypoglykémie pri užívaní lieku Byetta 11% v porovnaní so 7% pri placebe.
V randomizovanej, dvojito zaslepenej, kontrolovanej štúdii u zdravých jedincov Byetta nezmenil protiregulačné hormonálne reakcie na inzulínom indukovanú hypoglykémiu.
Informácie pre pacientov
Pacienti majú byť informovaní o možných rizikách lieku Byetta. Pacienti by mali byť tiež plne informovaní o postupoch samosprávy vrátane dôležitosti správneho uchovávania injekcie Byetty technika, načasovanie dávkovania Byetty, ako aj sprievodné perorálne lieky, dodržiavanie plánovaného stravovania, pravidelná fyzická aktivita, pravidelné monitorovanie hladiny glukózy v krvi a testovanie HbA1c, rozpoznávanie a riadenie hypoglykémie a hyperglykémie a hodnotenie diabetu komplikácie.
Pacientky by mali byť poučené, aby informovali svojho lekára, ak sú tehotné alebo ak plánujú otehotnieť.
Každá dávka Byetty sa má podať ako SC injekcia do stehna, brucha alebo nadlaktia kedykoľvek v rámci 60 minút pred ranným a večerným jedlom (alebo pred dvoma hlavnými jedlami dňa, približne 6 hodín alebo viac) od seba). Byetta sa nemá podávať po jedle. Ak dôjde k vynechaniu dávky, liečebný režim sa má obnoviť podľa predpisu s nasledujúcou plánovanou dávkou.
Riziko hypoglykémie sa zvyšuje, keď sa Byetta používa v kombinácii s látkou, ktorá indukuje hypoglykémiu, ako je napríklad sulfonylmočovina. Pacientovi by sa mali vysvetliť príznaky, liečba a stavy, ktoré predisponujú k rozvoju hypoglykémie. Aj keď nie je potrebné meniť obvyklé pokyny pacienta na zvládnutie hypoglykémie, tieto pokyny by sa mali zmeniť preskúmané a zosilnené pri začatí liečby Byettou, najmä pri súčasnom podávaní so sulfonylmočovinou (pozri OPATRENIAHypoglykémia).
Pacientov treba upozorniť, že liečba Byetou môže viesť k zníženiu chuti do jedla, jedlu príjem a / alebo telesná hmotnosť a kvôli tomu nie je potrebné meniť dávkovací režim účinky. Liečba liekom Byetta môže tiež viesť k nevoľnosti, najmä na začiatku liečby (pozri NEŽIADUCE REAKCIE).
Pred začatím liečby Byetou by si mal pacient prečítať prílohu „Informácie pre pacienta“ a Používateľskú príručku pera a skontrolovať ich pri každom doplnení predpisu. Pacient by mal byť poučený o správnom používaní a skladovaní pera, zdôrazniť, ako a kedy nastaviť nové pero, a uvedomiť si, že pri prvom použití je potrebný iba jeden krok nastavenia. Pacientovi treba odporučiť, aby si pero a ihly nezdieľal.
Pacienti musia byť informovaní o tom, že ihly pera nie sú súčasťou pera, a preto sa musia kúpiť samostatne. Pacienti by mali byť poučení, akú dĺžku a veľkosť ihly majú použiť.
Liekové interakcie
Účinok lieku Byetta na spomalenie vyprázdňovania žalúdka môže znížiť rozsah a rýchlosť absorpcie perorálne podaných liekov. Byetta sa má používať opatrne u pacientov, ktorí dostávajú perorálne lieky, ktoré vyžadujú rýchlu gastrointestinálnu absorpciu. Pre perorálne lieky, ktoré závisia od prahových koncentrácií účinnosti, ako sú napr antikoncepcie a antibiotiká, pacienti by mali byť poučení, aby tieto lieky užívali najmenej 1 hodinu predtým Injekcia Byetta. Ak sa takéto lieky majú podávať s jedlom, pacientom by sa malo odporučiť, aby ich užívali s jedlom alebo občerstvením, keď sa Byetta nepodáva. Účinok lieku Byetta na absorpciu a účinnosť perorálnych kontraceptív nebol charakterizovaný.
warfarín
V kontrolovanej klinickej farmakologickej štúdii u zdravých dobrovoľníkov sa pozorovalo oneskorenie Tmax warfarínu asi 2 hodiny, keď sa warfarín podával 30 minút po podaní Byetty. Neboli pozorované žiadne klinicky relevantné účinky na Cmax alebo AUC. Od uvedenia na trh sa však spontánne hlásili prípady zvýšenej INR (International Normalized Ratio) so súčasným užívaním warfarínu a Byetty, niekedy spojené s krvácajúci.
Karcinogenéza, mutagenéza, poškodenie plodnosti
U samcov a samíc potkanov v dávkach 18, 70 alebo 250 mcg / kg / deň podaných bolusovou injekciou SC sa uskutočnila 104-týždňová štúdia karcinogenity. Benígne adenómy tyroidných C-buniek sa pozorovali u samíc potkanov pri všetkých dávkach exenatidu. Výskyt u samíc potkanov bol 8% a 5% v dvoch kontrolných skupinách a 14%, 11% a 23% v skupinách s nízkou, strednou a vysokou dávkou so systémovými expozíciami. 5, 22 a 130-krát, expozícia ľudí vyplývajúca z maximálnej odporúčanej dávky 20 mcg / deň, vztiahnuté na plochu plazmy pod krivkou (AUC).
V 104-týždňovej štúdii karcinogenity na myšiach v dávkach 18, 70 alebo 250 mcg / kg / deň podávaných bolusovou injekciou SC sa nepozoroval žiadny dôkaz nádorov. pri dávkach do 250 mcg / kg / deň, systémová expozícia do 95-násobku expozície u ľudí vyplývajúca z maximálnej odporúčanej dávky 20 mcg / deň, založená na AUC.
Exenatid nebol mutagénny ani klastogénny, s metabolickou aktiváciou alebo bez nej, v teste bakteriálnej mutagenity Ames alebo v teste chromozomálnej aberácie v bunkách vaječníkov čínskeho škrečka. Exenatid bol negatívny v in vivo teste na myších mikrojadrách.
V štúdiách fertility myší s dávkami SC 6, 68 alebo 760 mcg / kg / deň sa samci liečili 4 týždne pred do a počas párenia a samice boli liečené 2 týždne pred a počas párenia až do dňa gravidity 7. Pri 760 mcg / kg / deň, čo je systémová expozícia 390-násobok ľudskej expozície vyplývajúca z maximálnej odporúčanej dávky 20 mcg / deň, na základe AUC, nebol pozorovaný žiadny nepriaznivý účinok na fertilitu.
tehotenstvo
Tehotenstvo Kategória C
Ukázalo sa, že exenatid spôsobuje znížený fetálny a novorodenecký rast a účinky na kostru u myší systémové expozície 3-násobok expozície ľudí, ktorá je výsledkom maximálnej odporúčanej dávky 20 mcg / deň, na základe AUC. Ukázalo sa, že exenatid spôsobuje skeletálne účinky u králikov pri systémových expozíciách 12-krát vyšších ako je expozícia u ľudí v dôsledku maximálnej odporúčanej dávky 20 mcg / deň, založenej na AUC. Neexistujú dostatočné a dobre kontrolované štúdie u tehotných žien. Byetta sa má používať počas gravidity iba vtedy, ak potenciálny prínos odôvodňuje potenciálne riziko pre plod.
U samíc myší, ktorým boli podané dávky SC 6, 68 alebo 760 mcg / kg / deň, začínajúce 2 týždne pred a počas párenia do 7. dňa gravidity, nedošlo k žiadnemu nepriaznivému fetálnemu účinky pri dávkach do 760 mcg / kg / deň, systémové expozície až 390-násobok expozície ľudí, ktorá je výsledkom maximálnej odporúčanej dávky 20 mcg / deň, založené na AUC.
U gravidných myší, ktorým boli podané dávky SC 6, 68, 460 alebo 760 mcg / kg / deň od 6. až 15. dňa gravidity (organogenéza), rozštep podnebia (niektoré s otvormi) a nepravidelná kostra osifikácia kostí rebier a lebiek sa pozorovala pri 6 mcg / kg / deň, čo je systémová expozícia trikrát vyššia ako u ľudí, ktorá je výsledkom maximálnej odporúčanej dávky 20 mcg / kg / deň, na základe AUC.
U gravidných králikov, ktorým boli podané dávky SC 0,2, 2, 22, 156 alebo 260 mcg / kg / deň od 6. až 18. dňa gravidity (organogenéza), nepravidelná kostra osifikácie sa pozorovali pri 2 mcg / kg / deň, čo je systémová expozícia 12-krát väčšia ako expozícia u ľudí vyplývajúca z maximálnej odporúčanej dávky 20 mcg / deň, na základe AUC.
U gravidných myší, ktorým boli podávané dávky SC 6, 68 alebo 760 mcg / kg / deň od 6. dňa gravidity do 20. dňa laktácie (odstavenie), bol pozorovaný zvýšený počet úmrtí na novorodencov. v deň po pôrode 2-4 v hrádzach, ktorým bola podávaná dávka 6 mcg / kg / deň, predstavuje systémová expozícia trojnásobok expozície u ľudí, ktorá je výsledkom maximálnej odporúčanej dávky 20 mcg / deň, na základe AUC.
Dojčiace matky
Nie je známe, či sa exenatid vylučuje do materského mlieka. Mnoho liekov sa vylučuje do materského mlieka a kvôli klinicky významným nežiaducim reakciám u dojčiat z exenatidu je rozhodnutie malo by sa rozhodnúť, či prerušiť výrobu mlieka na spotrebu alebo prerušiť liečbu, pričom sa musí zohľadniť dôležitosť lieku pre laktáciu žena. Štúdie na laktujúcich myšiach preukázali, že exenatid je po subkutánnom podaní prítomný v mlieku v nízkych koncentráciách (menších alebo rovnajúcich sa 2,5% koncentrácie v materskej plazme). Pri podávaní Byetty dojčiacej žene je potrebná opatrnosť.
Pediatrické použitie
U pediatrických pacientov nebola stanovená bezpečnosť a účinnosť lieku Byetta.
Geriatrické použitie
Liek Byetta bol skúmaný u 282 pacientov vo veku 65 rokov a starších a u 16 pacientov vo veku 75 rokov a starších. Medzi týmito pacientmi a mladšími pacientmi neboli pozorované žiadne rozdiely v bezpečnosti alebo účinnosti.
top
Nežiaduce reakcie
Používajte spolu s metformínom a / alebo sulfonylmočovinou
V troch 30-týždňových kontrolovaných štúdiách doplnku Byetta o metformín a / alebo sulfonylmočovinu boli nežiaduce udalosti s incidenciou 5% (okrem hypoglykémie; vidieť Tabuľka 3), ktoré sa vyskytli častejšie u pacientov liečených Byetta v porovnaní s pacientmi liečenými placebom, sú zhrnuté v tabuľke 4.
Tabuľka 4: Časté nežiaduce účinky na liečbu (5% incidencia a vyššia incidencia pri liečbe byzetou) okrem hypoglykémie *
| Placebo BID N = 483 % |
Všetky ponuky Byetta N = 963 % |
|
|---|---|---|
| ||
| nevoľnosť | 18 | 44 |
| zvracanie | 4 | 13 |
| Hnačka | 6 | 13 |
| Pocit nervozity | 4 | 9 |
| závrat | 6 | 9 |
| bolesť hlavy | 6 | 9 |
| dyspepsia | 3 | 6 |
Nežiaduce účinky spojené s liekom Byetta boli vo všeobecnosti miernej až strednej intenzity. Najčastejšie hlásená nežiaduca udalosť, mierna až stredne ťažká nauzea, sa vyskytla v závislosti od dávky. Pri pokračujúcej liečbe sa frekvencia a závažnosť v priebehu času znížila u väčšiny pacientov, u ktorých sa pôvodne vyskytla nevoľnosť. Nežiaduce účinky hlásené u 1,0 až <5,0% pacientov užívajúcich liek Byetta a hlásené častejšie ako pri placebe vrátane asténie (väčšinou hlásené ako slabosť), znížená chuť do jedla, gastroezofageálna refluxná choroba a hyperhidróza. U pacientov v predĺžených štúdiách po 52 týždňoch sa vyskytli podobné typy nežiaducich udalostí pozorovaných v 30-týždňových kontrolovaných štúdiách.
Výskyt abstinenčných príznakov v dôsledku nežiaducich udalostí bol 7% u pacientov liečených Byettou a 3% u pacientov liečených placebom. Najčastejšie nežiaduce účinky vedúce k vysadeniu u pacientov liečených Byettou boli nauzea (3% pacientov) a vracanie (1%). U pacientov liečených placebom <1% ustúpilo kvôli nevoľnosti a 0% kvôli zvracaniu.
Používajte s tiazolidíndiónom
V 16-týždňovej placebom kontrolovanej štúdii doplnku Byetty k tiazolidíndiónu s metformínom alebo bez metformínu, výskyt a typ ďalšie pozorované nežiaduce účinky boli podobné tým, ktoré sa pozorovali v 30-týždňových kontrolovaných klinických skúšaniach s metformínom a / alebo a sulfonylurea. V skupine s placebom neboli hlásené žiadne závažné nežiaduce účinky. V ramene Byetta boli hlásené dva závažné nežiaduce účinky, a to bolesť na hrudníku (vedúca k abstinenčnému stavu) a chronická hypersenzitívna pneumonitída.
Výskyt abstinenčných príznakov v dôsledku nepriaznivých udalostí bol 16% (19/121) u pacientov liečených Byettou a 2% (2/112) u pacientov liečených placebom. Najčastejšie nežiaduce účinky vedúce k vysadeniu u pacientov liečených Byettou boli nauzea (9%) a vracanie (5%). U pacientov liečených placebom sa <1% stiahlo z dôvodu nevoľnosti. Chladenie (n = 4) a reakcie v mieste vpichu (n = 2) sa vyskytli iba u pacientov liečených Byettou. Dvaja pacienti, ktorí hlásili reakciu v mieste vpichu, mali vysoké titre anti-exenatidovej protilátky.
Spontánne údaje
Od uvedenia lieku Byetta na trh boli hlásené nasledujúce ďalšie nežiaduce reakcie. Pretože tieto udalosti sú hlásené dobrovoľne z populácie neistej veľkosti, nie je vždy možné spoľahlivo odhadnúť ich frekvenciu alebo zistiť príčinnú súvislosť s vystavením drogám.
Všeobecne: reakcie v mieste vpichu; dysgeúzia; ospalosť, INR sa zvýšila pri súčasnom použití warfarínu (niektoré správy sú spojené s krvácaním).
Alergia / precitlivenosť: generalizovaný svrbenie a / alebo žihľavka, makulárna alebo papulárna vyrážka, angioedém; zriedkavé správy o anafylaktickej reakcii.
Gastrointestinálne: nevoľnosť, zvracanie a / alebo hnačka spôsobujúca dehydratáciu; brušná distenzia, bolesť brucha, erukcia, zápcha, plynatosť, akútna pankreatitída.
Poruchy obličiek a močových ciest: zmenená funkcia obličiek, vrátane akútneho zlyhania obličiek, zhoršeného chronického zlyhania obličiek, poškodenia obličiek, zvýšeného kreatinínu v sére (pozri pozri časť 4.4). OPATRENIA).
imunogenicita
V súlade s potenciálne imunogénnymi vlastnosťami proteínových a peptidových liečiv sa u pacientov po liečbe Byetou môžu vyvinúť anti-exenatidové protilátky. U väčšiny pacientov, u ktorých sa vyvinú protilátky, sa titre protilátok v priebehu času znižujú.
V 30-týždňových kontrolovaných štúdiách s prídavkom Byetty k metformínu a / alebo sulfonylmočovine malo 38% pacientov po 30 týždňoch protilátky proti exenatidu s nízkym titrom. V tejto skupine bola hladina glykemickej kontroly (HbA1c) všeobecne porovnateľná s hladinou pozorovanou u hladín bez titrov protilátok. Ďalších 6% pacientov malo vyššie titerové protilátky po 30 týždňoch. U približne polovice z týchto 6% (3% z celkového počtu pacientov, ktorým sa podávala Byetta v 30-týždňových kontrolovaných štúdiách) bola glykemická odpoveď na Byettu oslabená; zvyšok mal glykemickú reakciu porovnateľnú s reakciou pacientov bez protilátok.
V 16-týždňovej štúdii s prídavkom Byetty k tiazolidíndiónom s metformínom alebo bez metformínu malo 9% pacientov po 16 týždňoch vyššie titerové protilátky. V porovnaní s pacientmi, u ktorých sa nevyvinuli protilátky proti Byette, bola v priemere oslabená glykemická odpoveď u pacientov s protilátkami s vyšším titrom.
Je potrebné sledovať glykemickú odpoveď pacienta na Byettu. Ak sa zhoršuje kontrola glykémie alebo sa nedosahuje cielená kontrola glykémie, má sa zvážiť alternatívna antidiabetická liečba.
top
predávkovania
V klinickej štúdii s liekom Byetta sa u troch pacientov s cukrovkou 2. typu vyskytlo jednorazové predávkovanie 100 mcg SC (10-násobok maximálnej odporúčanej dávky). Účinky predávkovania zahŕňali ťažkú nevoľnosť, silné zvracanie a rýchlo klesajúce koncentrácie glukózy v krvi. U jedného z troch pacientov sa vyskytla závažná hypoglykémia vyžadujúca parenterálne podanie glukózy. Traja pacienti sa zotavili bez komplikácií. V prípade predávkovania sa má začať vhodná podporná liečba podľa klinických príznakov a symptómov pacienta.
top
Dávkovanie a spôsob podávania
Terapia Byetta by sa mala začať dávkou 5 mcg na dávku podanou dvakrát denne kedykoľvek v priebehu 60 minút obdobie pred ranným a večerným jedlom (alebo pred dvoma hlavnými jedlami dňa, približne 6 hodín alebo viac) od seba). Byetta sa nemá podávať po jedle. Na základe klinickej odpovede sa môže dávka Byetty zvýšiť na 10 mcg dvakrát denne po 1 mesiaci liečby. Každá dávka sa má podať ako injekcia SC do stehna, brucha alebo nadlaktia.
Byetta sa odporúča používať u pacientov s diabetes mellitus 2. typu, ktorí už dostávajú metformín, sulfonylmočovinu, tiazolidíndión, kombinácia metformínu a sulfonylmočoviny alebo kombinácia metformínu a tiazolidíndiónu a majú suboptimálny glykemická kontrola. Ak sa Byetta pridá k liečbe metformínom alebo tiazolidíndiónom, súčasná dávka metformínu alebo tiazolidíndiónu môže pokračovať keďže je nepravdepodobné, že pri použití s Byettou bude potrebné upraviť dávku metformínu alebo tiazolidíndiónu kvôli hypoglykémii. Ak sa Byetta pridá k liečbe sulfonylmočovinou, môže sa zvážiť zníženie dávky sulfonylmočoviny, aby sa znížilo riziko hypoglykémie (pozri pozri časť 4.8). OPATRENIAHypoglykémia).
Byetta je číra a bezfarebná tekutina a nemá sa používať, ak sa objavia častice alebo ak je roztok zakalený alebo sfarbený. Byetta sa nemá používať po dátume exspirácie. Nie sú dostupné údaje o bezpečnosti a účinnosti intravenóznej alebo intramuskulárnej injekcie Byetty.
top
skladovanie
Pred prvým použitím sa Byetta musí uchovávať v chlade pri teplote 2 ° C až 8 ° C. Po prvom použití sa Byetta môže uchovávať pri teplote neprevyšujúcej 25 ° C. Neuchovávajte v mrazničke. Nepoužívajte Byettu, ak bola zmrazená. Byetta by mala byť chránená pred svetlom. Pero by sa malo zlikvidovať 30 dní po prvom použití, aj keď v pere zostáva nejaký liek.
top
Ako sa dodáva
Byetta sa dodáva ako sterilný roztok na subkutánnu injekciu obsahujúci exenatid 250 mcg / ml. K dispozícii sú tieto balíčky:
5 mcg na dávku, 60 dávok, 1,2 ml naplnené pero NDC 66780-210-07
10 mcg na dávku, 60 dávok, 2,4 ml predplneného pera NDC 66780-210-08
Rx LEN
Vyrobené pre Amylin Pharmaceuticals, Inc., San Diego, CA 92121
Predáva spoločnosť Amylin Pharmaceuticals, Inc. a Eli Lilly a spoločnosť
1-800-868-1190
http://www.Byetta.com
Byetta je registrovaná ochranná známka spoločnosti Amylin Pharmaceuticals, Inc.
© 2007 Amylin Pharmaceuticals, Inc. Všetky práva vyhradené.
naposledy aktualizované 09/2007
Informácie o pacientovi Byetta (exenatide) (v jednoduchej angličtine)
Podrobné informácie o príznakoch, príznakoch, príčinách, liečbe cukrovky
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
späť k: Prejdite si všetky lieky na diabetes



