Onglyza na liečbu cukrovky
Názov značky: Onglyza
Generický názov: Saxagliptin
Dávkovacia forma: tableta, filmom obalená
obsah:
Indikácie a použitie
Dávkovanie a spôsob podávania
Dávkové formy a sily
kontraindikácie
Varovania a bezpečnostné opatrenia
Nežiaduce reakcie
Liekové interakcie
Použitie v špecifických populáciách
predávkovania
popis
farmakológia
Neklinická toxikológia
Klinické štúdie
Ako dodávané
Informácie o pacientovi Onglyza (v jednoduchej angličtine)
Indikácie a použitie
Monoterapia a kombinovaná terapia
Onglyza je indikovaný ako doplnok k diéte a cvičeniu na zlepšenie kontroly glykémie u dospelých s diabetes mellitus 2. typu. [See Klinické štúdie].
Dôležité obmedzenia použitia
Onglyza sa nemá používať na liečbu diabetes mellitus 1. typu alebo diabetickej ketoacidózy, pretože by v týchto podmienkach nebolo účinné.
Onglyza sa neskúmal v kombinácii s inzulínom.
top
Dávkovanie a spôsob podávania
Odporúčané dávkovanie
Odporúčaná dávka Onglyzy je 2,5 mg alebo 5 mg jedenkrát denne, bez ohľadu na jedlo.
Pacienti s poruchou funkcie obličiek
U pacientov s miernym poškodením obličiek (klírens kreatinínu [CrCl]> 50 ml / min) sa neodporúča úprava dávkovania Onglyzy.
Dávka Onglyzy je 2,5 mg jedenkrát denne u pacientov so stredne ťažkou alebo ťažkou poruchou funkcie obličiek alebo s terminálnym ochorením obličiek (ESRD) vyžadujúcim hemodialýzu (klírens kreatinínu [CrCl] ¤ ‰ ‰ 50 ml / min). Onglyza sa má podávať po hemodialýze. Onglyza sa neskúmal u pacientov podstupujúcich peritoneálnu dialýzu.
Pretože dávka Onglyzy by sa mala obmedziť na 2,5 mg na základe funkcie obličiek, odporúča sa vyhodnotiť funkciu obličiek pred začatím liečby Onglyzou a potom pravidelne. Funkcia obličiek sa dá odhadnúť zo sérového kreatinínu pomocou vzorca Cockcroft-Gault alebo modifikácie výživy podľa vzorca pre ochorenie obličiek. [See Klinická farmakológia, Farmakokinetika.]
Silné inhibítory CYP3A4 / 5
Dávka Onglyzy je 2,5 mg jedenkrát denne, keď sa podáva súbežne so silnými inhibítormi cytochrómu P450 3A4 / 5 (CYP3A4 / 5) (napr. ketokonazol, atazanavir, klaritromycín, indinavir, itrakonazol, nefazodón, nelfinavir, ritonavir, saquinavir a telitromycín). [See Liekové interakcie, Inhibítory enzýmov CYP3A4 / 5 a Klinická farmakológia, Farmakokinetika.]
top
Dávkové formy a sily
- Onglyza (saxagliptín) 5 mg tablety sú ružové, bikonvexné, okrúhle, filmom obalené tablety s vytlačeným „5“ na jednej strane a „4215“ na zadnej strane, modrým atramentom.
- Onglyza (saxagliptín) 2,5 mg tablety sú svetlo žlté až svetlo žlté, bikonvexné, okrúhle, filmom obalené tablety s „2,5“ vytlačeným na jednej strane a „4214“ vytlačeným na zadnej strane, modrým atramentom.
top
kontraindikácie
Žiadny.
top
Varovania a bezpečnostné opatrenia
Používajte s liekmi, o ktorých je známe, že spôsobujú hypoglykémiu
Inzulínové sekretagogy, ako napríklad sulfonylmočoviny, spôsobujú hypoglykémiu. Preto sa môže požadovať nižšia dávka sekretagogu inzulínu, aby sa znížilo riziko hypoglykémie, keď sa používa v kombinácii s Onglyzou. [See Nežiaduce reakcie, Skúsenosti s klinickými testami.]
Makrovaskulárne výsledky
Neuskutočnili sa žiadne klinické štúdie, ktoré by preukázali presvedčivý dôkaz o znížení makrovaskulárneho rizika pri použití Onglyzy alebo akýchkoľvek iných antidiabetík.
top
Nežiaduce reakcie
Skúsenosti s klinickými testami
Pretože klinické skúšky sa vykonávajú za veľmi premenlivých podmienok, miera nežiaducich reakcií pozorovaná v klinických skúškach podľa a liek sa nedá priamo porovnávať s mierami v klinických skúškach s iným liekom a nemusí odrážať hodnoty pozorované v roku 2006 cvičiť.
Monoterapia a prídavná kombinovaná terapia
V dvoch placebom kontrolovaných štúdiách monoterapie trvajúcich 24 týždňov boli pacienti liečení Onglyza 2,5 mg denne, Onglyza 5 mg denne a placebo. Uskutočnili sa aj tri 24-týždňové, placebom kontrolované štúdie doplnkovej liečby kombinovanej liečby: jedna s metformínom, druhá s tiazolidíndiónom (pioglitazón alebo rosiglitazón) a druhá s glyburidom. V týchto troch štúdiách boli pacienti randomizovaní na doplnkovú liečbu Onglyzou 2,5 mg denne, Onglyzou 5 mg denne alebo placebom. Liečebné rameno saxagliptínu v dávke 10 mg bolo zahrnuté do jednej z monoterapeutických štúdií a do doplnkovej kombinovanej štúdie s metformínom.
Vo vopred určenej súhrnnej analýze údajov za 24 týždňov (bez ohľadu na záchranu glykémie) z dvoch pokusov s monoterapiou, pokusu o prídavok k metformínu, pokusu o prídavok k tiazolidíndiónu (TZD), a doplnkom k pokusu o glyburid bol celkový výskyt nežiaducich udalostí u pacientov liečených Onglyzou 2,5 mg a Onglyzou 5 mg podobný placebu (72,0% a 72,2% oproti 70,6%, v tomto poradí). K prerušeniu liečby z dôvodu nežiaducich účinkov došlo u 2,2%, 3,3% a 1,8% pacientov, ktorí dostávali Onglyza 2,5 mg, Onglyza 5 mg a placebo. Najčastejšie nežiaduce účinky (hlásené najmenej u 2 pacientov liečených Onglyzou 2,5 mg alebo najmenej 2 pacientov liečených Onglyzou 5 mg) spojené s predčasným prerušením liečby zahŕňali lymfopéniu (0,1%, respektíve 0,5% oproti 0%), vyrážku (0,2% a 5%) 0,3% oproti 0,3%), kreatinín v krvi sa zvýšil (0,3% a 0% oproti 0%) a kreatínfosfokináza v krvi sa zvýšila (0,1% a 0,2% oproti 0%). Nežiaduce reakcie v tejto súhrnnej analýze boli hlásené (bez ohľadu na kauzalitu hodnotiteľa) v roku 2006 â ‰ ¥ 5% pacientov liečených Onglyzou 5 mg a častejšie ako u pacientov liečených placebom je uvedených na Stôl 1.
Tabuľka 1: Nežiaduce reakcie (bez ohľadu na hodnotenie kauzality skúšajúcim) v pokusoch s placebom * Hlásené u 5% pacientov liečených Onglyzou 5 mg a častejšie ako u pacientov liečených placebo
| Počet (%) pacientov | ||
|---|---|---|
| Onglyza 5 mg N = 882 |
placebo N = 799 |
|
| * Päť placebom kontrolovaných štúdií zahŕňa dve štúdie zamerané na monoterapiu a jednu štúdiu doplnkovej kombinačnej liečby, pričom každá z týchto štúdií: metformín, tiazolidíndión alebo glyburid. V tabuľke sú uvedené údaje za 24 týždňov bez ohľadu na záchranu glykémie. | ||
| Infekcia horných dýchacích ciest | 68 (7.7) | 61 (7.6) |
| Infekcie močových ciest | 60 (6.8) | 49 (6.1) |
| bolesť hlavy | 57 (6.5) | 47 (5.9) |
U pacientov liečených liekom Onglyza 2,5 mg bola bolesť hlavy (6,5%) jediná nežiaduca reakcia hlásená v pomere 5% a častejšie ako u pacientov liečených placebom.
V tejto súhrnnej analýze boli nežiaduce reakcie hlásené u 2% pacientov liečených Onglyzou 2,5 mg alebo Onglyzou 5 mg a 1% častejšie v porovnaní s placebom: sinusitída (2,9% a 2,6% oproti 1,6%), bolesť brucha (2,4% a 1,7% oproti 0,5%), gastroenteritída (1,9% a 2,3% oproti 0,9%) a zvracanie (2,2% a 2,3% oproti 1,3%) ).
V doplnku k štúdii TZD bol výskyt periférneho edému vyšší pri Onglyze 5 mg oproti placebu (8,1%, respektíve 4,3%). Výskyt periférneho edému pre Onglyzu 2,5 mg bol 3,1%. Žiadna z hlásených nežiaducich reakcií periférneho edému neviedla k prerušeniu liečby študovaným liekom. Miera periférneho edému pre Onglyza 2,5 mg a Onglyza 5 mg oproti placebu bola 3,6% a 2% oproti 3% pri monoterapii, 2,1% a 2,1% oproti 2,2% podaných ako prídavná terapia metformínu a 2,4% a 1,2% oproti 2,2% podaných ako prídavná terapia glyburidu.
Miera výskytu zlomenín bola 1,0 a 0,6 na 100 pacientorokov, v prípade Onglyzy (súhrnná analýza 2,5 mg, 5 mg a 10 mg) a placeba. Miera výskytu zlomenín u pacientov, ktorí dostávali Onglyzu, sa v priebehu času nezvýšila. Kauzalita nebola stanovená a neklinické štúdie nepreukázali nepriaznivé účinky saxagliptínu na kosť.
V klinickom programe sa pozorovala udalosť trombocytopénie, ktorá je v súlade s diagnózou idiopatickej trombocytopenickej purpury. Vzťah tejto udalosti k Onglyze nie je známy.
Nežiaduce reakcie spojené s liekom Onglyza spolu s metformínom u pacientov bez predchádzajúcej liečby s diabetom 2. typu
Tabuľka 2 ukazuje hlásené nežiaduce účinky (bez ohľadu na hodnotenie kauzality skúšajúcim) u 5% pacientov účasť na ďalšej 24-týždňovej, aktívne kontrolovanej štúdii súbežne podávaného Onglyzy a metformínu pri liečbe naivnej pacienti.
Tabuľka 2: Počiatočná terapia kombináciou Onglyzy a metformínu u pacientov bez predchádzajúcej liečby: Hlásené nežiaduce reakcie (bez ohľadu na hodnotenie skúšajúcim) príčinných súvislostí) u 5% pacientov liečených kombinovanou terapiou Onglyza 5 mg plus metformín (a častejšie ako u pacientov liečených metformínom alone)
| Počet (%) pacientov | ||
|---|---|---|
| Onglyza 5 mg + metformín * N = 320 |
metformín * N = 328 |
|
| * Metformín sa začal s úvodnou dávkou 500 mg denne a titroval sa až do maximálnej hodnoty 2 000 mg denne. | ||
| bolesť hlavy | 24 (7.5) | 17 (5.2) |
| zápal nosohltana | 22 (6.9) | 13 (4.0) |
hypoglykémie
Nežiaduce reakcie hypoglykémie boli založené na všetkých správach o hypoglykémii; nebolo potrebné súčasné meranie glukózy. V štúdii s prídavkom k glyburidu bola celková incidencia hlásenej hypoglykémie vyššia u Onglyzy 2,5 mg a Onglyzy 5 mg (13,3% a 14,6%) oproti placebu (10,1%). Výskyt potvrdenej hypoglykémie v tejto štúdii, definovanej ako príznaky hypoglykémie sprevádzanej a Hodnota glukózy z prstu - 50 mg / dl, bola 2,4% a 0,8% pre Onglyza 2,5 mg a Onglyza 5 mg a 0,7% pre placebo. Výskyt hlásenej hypoglykémie pre Onglyza 2,5 mg a Onglyza 5 mg oproti placebu podávanému ako monoterapia bol 4,0% a 5,6% oproti 4,1%, respektíve 7,8% a 5,8% oproti 5% podaných ako prídavná terapia metformínu a 4,1% a 2,7% oproti 3,8% podaných ako prídavná terapia k metformínu TZD. Výskyt hlásenej hypoglykémie bol 3,4% u pacientov bez predchádzajúcej liečby, ktorí dostávali Onglyza 5 mg plus metformín, a 4,0% u pacientov, ktorí dostávali samotný metformín.
Reakcie z precitlivenosti
Udalosti súvisiace s precitlivenosťou, ako je žihľavka a opuch tváre v súhrnnej analýze 5 štúdií do 24. týždňa boli hlásené u 1,5%, 1,5% a 0,4% pacientov, ktorí dostávali Onglyza 2,5 mg, Onglyza 5 mg a placebo, resp. Žiadna z týchto udalostí u pacientov, ktorí dostávali Onglyzu, si nevyžadovala hospitalizáciu alebo vyšetrovatelia hlásili, že ohrozujú život. Jeden pacient liečený saxagliptínom v tejto súhrnnej analýze bol prerušený kvôli generalizovanej žihľavke a opuchu tváre.
Vital Signs
U pacientov liečených Onglyzou neboli pozorované žiadne klinicky významné zmeny životných funkcií.
Laboratórne testy
Počty absolútnych lymfocytov
Pri Onglyze sa pozoroval priemerný pokles absolútneho počtu lymfocytov v závislosti od dávky. Z východiskového priemeru absolútneho počtu lymfocytov približne 2200 buniek / mikroL, priemerný pokles približne o 100 a 120 buniek / mikroL s Onglyza 5 mg a 10 mg v porovnaní s placebom sa pozorovali po 24 týždňoch v súhrnnej analýze piatich placebom kontrolovaných klinických štúdií. štúdií. Podobné účinky boli pozorované, keď bol Onglyza 5 mg podaný v počiatočnej kombinácii s metformínom v porovnaní so samotným metformínom. Nepozoroval sa žiadny rozdiel pre Onglyzu 2,5 mg v porovnaní s placebom. Pomer pacientov, u ktorých sa zistilo, že majú počet lymfocytov ± 750 buniek / mikroL, bol 0,5%, 1,5%, 1,4% a 0,4% v skupine saxagliptínu 2,5 mg, 5 mg, 10 mg a placeba. U väčšiny pacientov sa recidíva nepozorovala pri opakovanej expozícii Onglyze, hoci u niektorých pacientov došlo k opakujúcim sa poklesom po opakovanej výzve, ktorá viedla k prerušeniu liečby Onglyzou. Zníženie počtu lymfocytov nebolo spojené s klinicky relevantnými nežiaducimi účinkami.
Klinický význam tohto zníženia počtu lymfocytov v porovnaní s placebom nie je známy. Ak je to klinicky indikované, napríklad v podmienkach nezvyčajnej alebo dlhodobej infekcie, mal by sa zmerať počet lymfocytov. Účinok Onglyzy na počet lymfocytov u pacientov s abnormalitami lymfocytov (napr. Vírus ľudskej imunodeficiencie) nie je známy.
krvné doštičky
V šiestich dvojito slepých kontrolovaných klinických skúšaniach o bezpečnosti a účinnosti nepreukázal liek Onglyza klinicky významný alebo konzistentný účinok na počet krvných doštičiek.
top
Liekové interakcie
Induktory enzýmov CYP3A4 / 5
Rifampín významne znížil expozíciu saxagliptínu bez zmeny v oblasti pod krivkou závislosti koncentrácie od času (AUC) jeho aktívneho metabolitu, 5-hydroxy saxagliptínu. Inhibícia aktivity plazmatickej dipeptidylpeptidázy-4 (DPP4) počas 24-hodinového dávkovacieho intervalu nebola rifampínom ovplyvnená. Preto sa úprava dávky Onglyzy neodporúča. [See Klinická farmakológia, Farmakokinetika.]
Inhibítory enzýmov CYP3A4 / 5
Mierne inhibítory CYP3A4 / 5
Diltiazem zvýšil expozíciu saxagliptínu. Podobné zvýšenie plazmatických koncentrácií saxagliptínu sa predpokladá v prítomnosti iného mierneho CYP3A4 / 5 inhibítory (napr. amprenavir, aprepitant, erytromycín, flukonazol, fosamprenavir, grapefruitový džús a verapamil); úprava dávky Onglyzy sa však neodporúča. [See Klinická farmakológia, Farmakokinetika.]
Silné inhibítory CYP3A4 / 5
Ketokonazol významne zvýšil expozíciu saxagliptínu. Podobné významné zvýšenie plazmatických koncentrácií saxagliptínu sa očakáva u iných silných inhibítorov CYP3A4 / 5 (napr. atazanavir, klaritromycín, indinavir, itrakonazol, nefazodón, nelfinavir, ritonavir, saquinavir a telitromycín). Pri súčasnom podávaní so silným inhibítorom CYP3A4 / 5 by sa dávka Onglyzy mala obmedziť na 2,5 mg. [See Dávkovanie a spôsob podávania, Silné inhibítory CYP3A4 / 5 a Klinická farmakológia, Farmakokinetika.]
top
Použitie v špecifických populáciách
tehotenstvo
Tehotenstvo Kategória B
Neexistujú dostatočné a dobre kontrolované štúdie u tehotných žien. Pretože reprodukčné štúdie na zvieratách nie vždy predpovedajú ľudskú odpoveď, Onglyza sa, rovnako ako iné antidiabetické lieky, má používať počas gravidity iba v nevyhnutných prípadoch.
Saxagliptín nebol teratogénny pri žiadnej testovanej dávke, keď sa podával gravidným potkanom a králikom počas období organogenézy. U potkanov sa pri dávke 240 mg / kg, alebo približne 1503, vyskytla neúplná osifikácia panvy, čo je forma vývojového oneskorenia. a 66-násobok expozície človeka saxagliptínu a aktívneho metabolitu pri maximálnej odporúčanej dávke u ľudí (MRHD) 5 mg. Maternálna toxicita a znížená telesná hmotnosť plodu sa pozorovali pri 7986 a 328-násobku expozície ľudí saxagliptínu u aktívneho metabolitu u MRHD. Drobné zmeny kostry králikov sa vyskytli pri dávke toxickej pre matku 200 mg / kg alebo približne 1432 a 992-násobku MRHD. Keď sa saxagliptín podával potkanom v kombinácii s metformínom, nebol teratogénny ani embryoletálny pri expozíciách 21krát vyšších ako saxagliptín MRHD. Kombinované podávanie metformínu s vyššou dávkou saxagliptínu (109-krát saxagliptín MRHD) bolo spojené s craniorachischisis (zriedkavý defekt neurálnej trubice charakterizovaný neúplným uzavretím lebky a miechy) u dvoch plodov jedna priehrada. Expozícia metformínu v každej kombinácii bola 4-násobkom expozície u ľudí 2 000 mg denne.
Saxagliptín podávaný samiciam potkanov od 6. dňa gravidity do 20. dňa laktácie mal za následok zníženie telesnej hmotnosti u samcov a potomstvo samíc iba v dávkach toxických pre matku (vystavuje sa 29 1629 a 53-násobku saxagliptínu a jeho aktívneho metabolitu na MRHD). U potomkov potkanov, ktorým sa podával saxagliptín v akejkoľvek dávke, sa nepozorovala žiadna funkčná alebo behaviorálna toxicita.
Saxagliptín prechádza placentou do plodu po podaní dávky gravidným potkanom.
Dojčiace matky
Saxagliptín sa vylučuje do mlieka dojčiacich potkanov v pomere približne 1: 1 s plazmatickými koncentráciami liečiva. Nie je známe, či sa saxagliptín vylučuje do materského mlieka. Pretože sa v materskom mlieku vylučuje veľa liekov, pri podávaní Onglyzy dojčiacej žene by sa mala postupovať opatrne.
Pediatrické použitie
Bezpečnosť a účinnosť Onglyzy u pediatrických pacientov nebola stanovená.
Geriatrické použitie
V šiestich dvojito zaslepených, kontrolovaných klinických skúškach bezpečnosti a účinnosti lieku Onglyza bolo 634 (15,3%) zo 4148 randomizovaných pacientov 65 rokov a viac a 59 (1,4%) pacientov bolo 75 a viac rokov. Medzi pacientmi vo veku 65 rokov a mladšími neboli pozorované žiadne celkové rozdiely v bezpečnosti alebo účinnosti. Aj keď táto klinická skúsenosť nezistila rozdiely v reakciách medzi staršími a mladšími pacientmi, nie je možné vylúčiť vyššiu citlivosť niektorých starších jedincov.
Saxagliptín a jeho aktívny metabolit sa čiastočne vylučujú obličkami. Pretože u starších pacientov je väčšia pravdepodobnosť, že majú zníženú funkciu obličiek, je potrebné pri výbere dávky u starších pacientov postupovať opatrne na základe funkcie obličiek. [See Dávkovanie a spôsob podávaniaPacienti s poruchou funkcie obličiek a Klinická farmakológia, Farmakokinetika.]
top
predávkovania
V kontrolovanej klinickej štúdii Onglyza podávaná perorálne jedenkrát denne zdravým osobám v dávkach do 400 mg denne po dobu 2 týždňov. (80-násobok MRHD) nemali žiadne klinicky nepriaznivé reakcie súvisiace s dávkou a klinicky významný účinok na QTc interval alebo srdce Rýchlosť.
V prípade predávkovania sa má začať vhodná podporná liečba, ktorá je daná klinickým stavom pacienta. Saxagliptín a jeho aktívny metabolit sa odstraňujú hemodialýzou (23% dávky počas 4 hodín).
top
popis
Saxagliptín je perorálne aktívny inhibítor enzýmu DPP4.
Monohydrát Saxagliptínu je chemicky opísaný ako (1S, 3S, 5S) -2 - [(2S) -2-amino-2- (3-hydroxytricyklo [3.3.1.1]3,7] dec-1-yl) acetyl] -2-azabicyklo [3.1.0] hexán-3-karbonitril, monohydrát alebo (1S, 3S, 5S) - 2 - [(2S) - 2 - Amino - 2- (3-hydroxyadamantan - 1 - yl) acetyl] -2 - azabicyklo [3.1.0] hexán - 3 - karbonitril hydrát. Empirickým vzorcom je C18H25N3O2-H2O a molekulová hmotnosť je 333,43. Štrukturálny vzorec je:
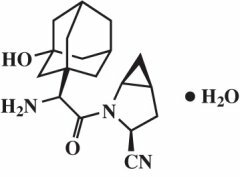
Saxagliptín monohydrát je biely až svetlo žltý alebo svetlo hnedý, nehygroskopický kryštalický prášok. Je ťažko rozpustný vo vode pri 24 ° C ± 3 ° C, mierne rozpustný v etylacetáte a rozpustný v metanole, etanole, izopropylalkohole, acetonitrile, acetóne a polyetylénglykole 400 (PEG 400).
Každá filmom obalená tableta Onglyzy na perorálne použitie obsahuje buď 2,79 mg saxagliptín hydrochloridu (bezvodého), čo zodpovedá 2,5 mg saxagliptínu alebo 5,58 mg saxagliptínu. hydrochlorid (bezvodý) ekvivalentný 5 mg saxagliptínu a tieto neaktívne zložky: monohydrát laktózy, mikrokryštalická celulóza, sodná soľ kroskarmelózy a stearát horečnatý. Ďalej filmový povlak obsahuje nasledujúce neaktívne zložky: polyvinylalkohol, polyetylénglykol, oxid titaničitý, mastenec a oxidy železa.
top
Klinická farmakológia
Mechanizmus akcie
Zvýšené koncentrácie inkretínových hormónov, ako je glukagónu podobný peptid-1 (GLP-1) a na glukóze závislé inzulínotropný polypeptid (GIP) sa uvoľňuje do krvi z tenkého čreva v reakcii na jedlá. Tieto hormóny spôsobujú uvoľňovanie inzulínu z pankreatických beta buniek glukózovo závislým spôsobom, ale sú inaktivované enzýmom dipeptidylpeptidáza-4 (DPP4) v priebehu niekoľkých minút. GLP-1 tiež znižuje sekréciu glukagónu z alfa buniek pankreasu, čím sa znižuje tvorba glukózy v pečeni. U pacientov s cukrovkou 2. typu sú koncentrácie GLP-1 znížené, ale inzulínová odpoveď na GLP-1 je zachovaná. Saxagliptín je konkurenčný inhibítor DPP4, ktorý spomaľuje inaktiváciu inkretínových hormónov, čím zvyšuje ich krvný obeh. koncentrácie a znižujú koncentrácie glukózy nalačno a postprandiálnej glukózy spôsobom závislým od glukózy u pacientov s cukrovkou 2. typu mellitus.
farmakodynamika
U pacientov s diabetes mellitus 2. typu podávanie Onglyza inhibuje aktivitu enzýmu DPP4 počas 24 hodín. Po perorálnom podaní glukózy alebo jedla viedla táto inhibícia DPP4 k 2- až 3-násobnému zvýšeniu hladín aktívnej látky v obehu. GLP-1 a GIP, znížené koncentrácie glukagónu a zvýšená sekrécia inzulínu závislá od glukózy z beta buniek pankreasu. Zvýšenie inzulínu a zníženie glukagónu boli spojené s nižšími koncentráciami glukózy na lačno a zníženým výkyvom glukózy po perorálnom podaní glukózy alebo po jedle.
Srdcová elektrofyziológia
V randomizovanej, dvojito zaslepenej, placebom kontrolovanej, štvorsmernej skríženej štúdii s aktívnym porovnávacím testom s moxifloxacínom u 40 zdravých osôb, Onglyza nebol spojený s klinicky významným predĺžením QTc intervalu alebo srdcového rytmu pri denných dávkach do 40 mg (8-násobok MRHD).
farmakokinetika
Farmakokinetika saxagliptínu a jeho aktívneho metabolitu, 5-hydroxy saxagliptínu, bola podobná u zdravých jedincov au pacientov s diabetes mellitus 2. typu. Cmax a hodnoty AUC saxagliptínu a jeho aktívneho metabolitu sa zvyšovali úmerne v rozmedzí dávok 2,5 až 400 mg. Po 5 mg jednorazovej perorálnej dávke saxagliptínu zdravým jedincom boli priemerné plazmatické hodnoty AUC saxagliptínu a jeho aktívneho metabolitu 78 ng-h / ml a 214 ng-h / ml. Zodpovedajúca plazma Cmax hodnoty boli 24 ng / ml, respektíve 47 ng / ml. Priemerná variabilita (% CV) pre AUC a Cmax pre saxagliptín a jeho aktívny metabolit bolo menej ako 25%.
Pri opakovanom dávkovaní raz denne pri akejkoľvek hladine dávky sa nepozorovala významná akumulácia saxagliptínu alebo jeho aktívneho metabolitu. Počas klírens saxagliptínu a jeho aktívneho metabolitu počas 14 dní po podaní saxagliptínu jedenkrát denne v dávkach od 2,5 do 400 mg sa nepozorovala žiadna závislosť od dávky a času.
vstrebávanie
Stredný čas do maximálnej koncentrácie (Tmax) po dávke 5 mg jedenkrát denne boli 2 hodiny pre saxagliptín a 4 hodiny pre jeho aktívny metabolit. Podávanie s jedlom s vysokým obsahom tukov viedlo k zvýšeniu Tmax saxagliptínu približne o 20 minút v porovnaní s podmienkami nalačno. Pri podaní s jedlom došlo k zvýšeniu AUC saxagliptínu o 27% v porovnaní s podmienkami nalačno. Onglyza sa môže podávať s jedlom alebo bez jedla.
distribúcia
Väzba saxagliptínu a jeho aktívneho metabolitu na bielkoviny in vitro v ľudskom sére je zanedbateľná. Preto sa neočakáva, že zmeny v hladinách bielkovín v krvi pri rôznych chorobných stavoch (napr. Pri poškodení obličiek alebo pečene) zmení dispozíciu saxagliptínu.
metabolizmus
Metabolizmus saxagliptínu je primárne sprostredkovaný cytochrómom P450 3A4 / 5 (CYP3A4 / 5). Hlavným metabolitom saxagliptínu je tiež inhibítor DPP4, ktorý je o polovicu účinnejší ako saxagliptín. Preto silné inhibítory a induktory CYP3A4 / 5 zmenia farmakokinetiku saxagliptínu a jeho aktívneho metabolitu. [See Liekové interakcie.]
vylučovanie
Saxagliptín sa vylučuje obličkami aj pečeňou. Po jednorazovej dávke 50 mg 14C-saxagliptín, 24%, 36% a 75% dávky sa vylúčil močom ako saxagliptín, jeho aktívny metabolit a celková rádioaktivita. Priemerný renálny klírens saxagliptínu (~ 230 ml / min) bol vyšší ako priemerná odhadovaná rýchlosť glomerulárnej filtrácie (~ 120 ml / min), čo naznačuje určité aktívne vylučovanie obličkami. Celkom 22% podanej rádioaktivity sa získalo v stolici predstavujúcej frakciu dávky saxagliptínu vylúčenej žlčou a / alebo neabsorbovaným liekom z gastrointestinálneho traktu. Po jednorazovej perorálnej dávke Onglyzy 5 mg zdravým jedincom bol priemerný plazmatický terminálny polčas (t1/2) pre saxagliptín a jeho aktívny metabolit bol 2,5 a 3,1 hodiny.
Špecifické populácie
Porucha funkcie obličiek
Uskutočnila sa jednorazová otvorená štúdia na vyhodnotenie farmakokinetiky saxagliptínu (dávka 10 mg) u subjekty s rôznym stupňom chronického poškodenia obličiek (N = 8 na skupinu) v porovnaní s jedincami s normálnym obličkami Funkcie. Štúdia zahŕňala pacientov s poškodením obličiek klasifikovaných na základe klírensu kreatinínu ako mierneho (> 50 až â ‰ ¤80). ml / min), stredne ťažkých (30 až 50 ml / min.) a závažných (<30 ml / min.), ako aj pacientov s ochorením obličiek v konečnom štádiu hemodialýza. Klírens kreatinínu bol odhadnutý zo sérového kreatinínu na základe vzorca Cockcroft-Gault:
CrCl = [140 age ’vek (roky)] × hmotnosť (kg) {à - 0,85 pre pacientky}
[72 A - kreatinín v sére (mg / dl)]
Stupeň poškodenia obličiek neovplyvnil Cmax saxagliptínu alebo jeho aktívneho metabolitu. U jedincov s miernym poškodením obličiek boli hodnoty AUC saxagliptínu a jeho aktívneho metabolitu o 20% a 70% vyššie ako hodnoty AUC u jedincov s normálnou funkciou obličiek. Pretože zvýšenie tejto hodnoty sa nepovažuje za klinicky relevantné, úprava dávky u pacientov s miernym poškodením obličiek sa neodporúča. U jedincov so stredne ťažkou alebo ťažkou poruchou funkcie obličiek sú hodnoty AUC saxagliptínu a jeho aktívnej látky Metabolit bol až 2,1- a 4,5-násobne vyšší ako hodnoty AUC u jedincov s normálnou obličkou Funkcie. Na dosiahnutie plazmatickej expozície saxagliptínu a jeho aktívneho metabolitu podobnej expozícii u pacientov s normálnou funkciou obličiek sa odporúča odporúčaná dávka. je 2,5 mg jedenkrát denne u pacientov so stredne ťažkou a ťažkou poruchou funkcie obličiek, ako aj u pacientov s terminálnym ochorením obličiek, ktorí to potrebujú hemodialýza. Saxagliptín sa odstraňuje hemodialýzou.
Hepatálne poškodenie
U jedincov s poruchou funkcie pečene (trieda A, B a C podľa Childa-Pugha) priemerná Cmax a AUC saxagliptínu boli až o 8% a 77% vyššie v porovnaní so zdravými kontrolnými kontrolami po podaní jednej dávky 10 mg saxagliptínu. Zodpovedajúci Cmax a AUC aktívneho metabolitu boli až o 59% a 33% nižšie v porovnaní so zdravými zhodnými kontrolami. Tieto rozdiely sa nepovažujú za klinicky významné. U pacientov s poškodením funkcie pečene sa neodporúča úprava dávkovania.
Index telesnej hmotnosti
Neodporúča sa úprava dávkovania na základe indexu telesnej hmotnosti (BMI), ktorý nebol identifikovaný ako významný spolu so zdanlivým klírensom saxagliptínu alebo jeho aktívneho metabolitu v populačnej farmakokinetike Analýza.
rod
Neodporúča sa úprava dávkovania podľa pohlavia. Vo farmakokinetike saxagliptínu sa nepozorovali žiadne rozdiely medzi mužmi a ženami. V porovnaní s mužmi mali ženy približne o 25% vyššie hodnoty expozície pre aktívny metabolit ako muži, tento rozdiel však nebude mať klinický význam. Pri farmakokinetickej analýze populácie nebolo pohlavie identifikované ako významný kovariant pri zdanlivom klírense saxagliptínu a jeho aktívneho metabolitu.
geriatrickej
Neodporúča sa úprava dávkovania len na základe veku. Starší pacienti (65 - 80 rokov) mali o 23% a 59% vyšší geometrický priemer Cmax a geometrické stredné hodnoty AUC pre saxagliptín v porovnaní s mladými jedincami (18 - 40 rokov). Rozdiely vo farmakokinetike aktívneho metabolitu medzi staršími a mladými jedincami vo všeobecnosti odrážali rozdiely pozorované vo farmakokinetike saxagliptínu. Rozdiel medzi farmakokinetikou saxagliptínu a aktívnym metabolitom u mladých a starších pacientov subjekty sú pravdepodobne spôsobené mnohými faktormi vrátane poklesu funkcie obličiek a metabolickej kapacity s stúpajúci vek. Vek nebol pri populačnej farmakokinetickej analýze identifikovaný ako významný kovariant pri zdanlivom klírense saxagliptínu a jeho aktívneho metabolitu.
Pediatric
Štúdie charakterizujúce farmakokinetiku saxagliptínu u pediatrických pacientov sa nevykonali.
Rasa a etnicita
Na základe rasy sa neodporúča úprava dávkovania. Populačná farmakokinetická analýza porovnávala farmakokinetiku saxagliptínu a jeho aktívneho lieku metabolit u 309 kaukazských jedincov s 105 nepaukazskými jedincami (pozostávajúcich zo šiestich rasových skupiny). Medzi týmito dvoma populáciami nebol zistený žiadny významný rozdiel vo farmakokinetike saxagliptínu a jeho aktívneho metabolitu.
Interakcie liečivo-liečivo
Hodnotenie liekových interakcií in vitro
Metabolizmus saxagliptínu je primárne sprostredkovaný CYP3A4 / 5.
V štúdiách in vitro saxagliptín a jeho aktívny metabolit neinhibovali CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 alebo 3A4 ani neindukovali CYP1A2, 2B6, 2C9 alebo 3A4. Preto sa neočakáva, že saxagliptín zmení metabolický klírens súčasne podávaných liekov, ktoré sú metabolizované týmito enzýmami. Saxagliptín je substrát P-glykoproteínu (P-gp), ale nie je významným inhibítorom alebo induktorom P-gp.
Väzba saxagliptínu a jeho aktívneho metabolitu na bielkoviny in vitro v ľudskom sére je zanedbateľná. Väzba na proteíny by teda nemala významný vplyv na farmakokinetiku saxagliptínu alebo iných liekov.
In vivo hodnotenie liekových interakcií
Účinky Saxagliptínu na iné lieky
V štúdiách uskutočňovaných na zdravých subjektoch, ako je opísané nižšie, saxagliptín významne nezmenil farmakokinetika metformínu, glyburidu, pioglitazónu, digoxínu, simvastatínu, diltiazemu alebo ketokonazolu.
Metformín: Súčasné podanie jednej dávky saxagliptínu (100 mg) a metformínu (1 000 mg), substrátu hOCT-2, nezmenilo farmakokinetiku metformínu u zdravých jedincov. Preto Onglyza nie je inhibítorom transportu sprostredkovaného hOCT-2.
Glyburid: Súbežné podanie jednej dávky saxagliptínu (10 mg) a glyburidu (5 mg), substrátu CYP2C9, zvýšilo plazmatickú hladinu Cmax glyburidu o 16%; AUC glyburidu sa však nezmenila. Preto Onglyza významne neinhibuje metabolizmus sprostredkovaný CYP2C9.
Pioglitazón: Súbežné podávanie viacnásobných dávok saxagliptínu (10 mg) a pioglitazónu (45 mg), substrátu CYP2C8 jedenkrát denne, zvyšuje plazmatickú hladinu Cmax pioglitazónu o 14%; AUC pioglitazónu sa však nezmenila.
Digoxín: Súbežné podávanie viacnásobných dávok saxagliptínu (10 mg) a digoxínu (0,25 mg), substrátu P-gp, jedenkrát denne, nemení farmakokinetiku digoxínu. Preto Onglyza nie je inhibítorom alebo induktorom transportu sprostredkovaného P-gp.
Simvastatín: Súbežné podávanie viacnásobných dávok saxagliptínu (10 mg) a simvastatínu (40 mg) jedenkrát denne, substrátu CYP3A4 / 5, nemení farmakokinetiku simvastatínu. Preto Onglyza nie je inhibítorom alebo induktorom metabolizmu sprostredkovaného CYP3A4 / 5.
Diltiazem: Súbežné podávanie viacerých dávok saxagliptínu (10 mg) jedenkrát denne a diltiazemu (360 mg dlhodobo pôsobiaca formulácia v rovnovážnom stave), stredne silného inhibítora CYP3A4 / 5, zvýšilo plazmatickú hladinu Cmax diltiazemu o 16%; AUC diltiazemu sa však nezmenila.
Ketokonazol: Súbežné podanie jednej dávky saxagliptínu (100 mg) a opakovaných dávok ketokonazolu (200 mg každých 12 hodín pri v rovnovážnom stave), silný inhibítor CYP3A4 / 5 a P-gp, znížil plazmatickú Cmax a AUC ketokonazolu o 16% a 13%, resp.
Účinky iných liekov na Saxagliptín
Metformín: Súbežné podanie jednej dávky saxagliptínu (100 mg) a metformínu (1000 mg), substrátu hOCT-2, znížilo Cmax saxagliptínu o 21%; AUC sa však nezmenila.
Glyburid: Súbežné podanie jednej dávky saxagliptínu (10 mg) a glyburidu (5 mg), substrátu CYP2C9, zvýšilo Cmax saxagliptínu o 8%; AUC saxagliptínu sa však nezmenila.
Pioglitazón: Súbežné podávanie viacerých dávok saxagliptínu (10 mg) a pioglitazónu jedenkrát denne. (45 mg), substrát CYP2C8 (majoritný) a substrát CYP3A4 (menší), nemenili farmakokinetiku saxagliptín.
Digoxín: Súbežné podávanie viacerých dávok saxagliptínu (10 mg) raz denne a digoxínu (0,25 mg), substrátu P-gp, nemení farmakokinetiku saxagliptínu.
Simvastatín: Súbežné podávanie viacerých dávok saxagliptínu (10 mg) a simvastatínu (40 mg) jedenkrát denne, substrátu CYP3A4 / 5, zvýšilo Cmax saxagliptínu o 21%; AUC saxagliptínu sa však nezmenila.
Diltiazem: Súbežné podanie jednej dávky saxagliptínu (10 mg) a diltiazemu (360 mg dlhodobo pôsobiaca formulácia v rovnovážnom stave), stredne silného inhibítora CYP3A4 / 5, zvýšilo Cmax saxagliptínu o 63% a AUC 2,1-násobne. Toto bolo spojené so zodpovedajúcim poklesom Cmax a AUC aktívneho metabolitu o 44%, respektíve 36%.
Ketokonazol: Súbežné podanie jednej dávky saxagliptínu (100 mg) a ketokonazolu (200 mg každých 12 hodín v rovnovážnom stave), silného inhibítora CYP3A4 / 5 a P-gp, zvýšilo Cmax pre saxagliptín o 62% a AUC 2,5-krát. Toto bolo spojené so zodpovedajúcim poklesom Cmax a AUC aktívneho metabolitu o 95%, respektíve 91%.
V inej štúdii súčasné podávanie jednej dávky saxagliptínu (20 mg) a ketokonazolu (200 mg každých 12 hodín v rovnovážnom stave) zvýšilo Cmax a AUC saxagliptínu 2,4-krát a 3,7-násobku. Toto bolo spojené so zodpovedajúcim poklesom Cmax a AUC aktívneho metabolitu o 96%, respektíve 90%.
Rifampín: Súbežné podanie jednej dávky saxagliptínu (5 mg) a rifampínu (600 mg QD v rovnovážnom stave) znížilo Cmax a AUC saxagliptínu o 53%, respektíve 76%, so zodpovedajúcim zvýšením Cmax (39%), ale žiadna významná zmena plazmatickej AUC aktívneho metabolitu.
Omeprazol: Súbežné podávanie viacerých dávok saxagliptínu (10 mg) a omeprazolu (40 mg) jedenkrát denne, CYP2C19 (majoritný) a substrát CYP3A4, inhibítor CYP2C19 a induktor MRP-3, nezmenili farmakokinetiku saxagliptín.
Hydroxid hlinitý + hydroxid horečnatý + simetikón: Súbežné podanie jednej dávky saxagliptínu (10 mg) a kvapalina obsahujúca hydroxid hlinitý (2400 mg), hydroxid horečnatý (2400 mg) a simetikón (240 mg) znížili Cmax saxagliptínu o 26%; AUC saxagliptínu sa však nezmenila.
Famotidín: Podanie jednej dávky saxagliptínu (10 mg) 3 hodiny po jednej dávke famotidínu (40 mg), inhibítor hOCT-1, hOCT-2 a hOCT-3, zvýšilo Cmax saxagliptínu o 14%; AUC saxagliptínu sa však nezmenila.
top
Neklinická toxikológia
Karcinogenéza, mutagenéza, poškodenie plodnosti
Saxagliptín pri najvyšších hodnotených dávkach neindukoval nádory u myší (50, 250 a 600 mg / kg) ani u potkanov (25, 75, 150 a 300 mg / kg). Najvyššie dávky hodnotené u myší boli ekvivalentné približne 870 (muži) a 1165 (ženy) násobkom ľudskej expozície pri MRHD 5 mg / deň. U potkanov boli expozície približne 355 (samce) a 2217 (samice) krát MRHD.
Saxagliptín nebol mutagénny ani klastogénny s metabolickou aktiváciou alebo bez metabolickej aktivácie v in vitro bakteriálnom teste Ames, cytogenetickom teste in vitro u primárnych ľudí. lymfocyty, in vivo orálny mikronukleový test na potkanoch, in vivo orálna štúdia opravy DNA u potkanov a orálna in vivo / in vitro cytogenetická štúdia v periférnej krvi potkanov lymfocyty. Aktívny metabolit nebol mutagénny v in vitro bakteriálnom teste Ames.
V štúdii fertility na potkanoch boli samce liečené perorálnymi dávkami žalúdočnej sondy 2 týždne pred párením, počas párenia a podľa plánu. ukončenie (celkom približne 4 týždne) a samice boli liečené perorálnymi dávkami žalúdočnej sondy 2 týždne pred párením v tehotenstve deň 7. Pri expozíciách približne 603 (muži) a 776 (ženy) krát vyšších ako MRHD sa nepozorovali žiadne nepriaznivé účinky na fertilitu. Vyššie dávky, ktoré vyvolali materskú toxicitu, tiež zvýšili resorpciu plodu (približne 2069 a 6138-násobok MRHD). Ďalšie účinky na estrálnu cyklovanie, fertilitu, ovuláciu a implantáciu sa pozorovali približne pri 6138-násobku MRHD.
Toxikológia zvierat
Saxagliptín spôsoboval nepriaznivé kožné zmeny na končatinách opíc cynomolgus (chrasty a / alebo ulcerácia chvosta, číslic, mieška a / alebo nosa). Kožné lézie boli reverzibilné pri 20-násobku MRHD, ale v niektorých prípadoch boli pri vyšších expozíciách ireverzibilné a nekrotizujúce. Nežiaduce zmeny na koži sa nepozorovali pri expozíciách podobných (1 až 3-krát) MRHD 5 mg. Klinické korelácie s kožnými léziami u opíc neboli pozorované v klinických skúšaniach saxagliptínu u ľudí.
top
Klinické štúdie
Liek Onglyza sa skúmal v monoterapii av kombinácii s liecbou metformínom, glyburidom a tiazolidíndiónom (pioglitazón a rosiglitazón). Onglyza sa neskúmal v kombinácii s inzulínom.
Celkom 4148 pacientov s diabetes mellitus 2. typu bolo randomizovaných do šiestich dvojito slepých kontrolovaných klinických štúdií, ktoré sa uskutočnili s cieľom vyhodnotiť bezpečnosť a glykemickú účinnosť Onglyzy. Celkom 3021 pacientov bolo v týchto štúdiách liečených Onglyzou. V týchto štúdiách bol priemerný vek 54 rokov a 71% pacientov bolo kaukazských, 16% bolo ázijských, 4% čiernych a 9% iných rasových skupín. Ďalších 423 pacientov vrátane 315 pacientov, ktorí dostávali Onglyzu, sa zúčastnilo na placebom kontrolovanej štúdii zameranej na dávkovanie v trvaní 6 až 12 týždňov.
V týchto šiestich dvojito zaslepených štúdiách sa liek Onglyza hodnotil v dávkach 2,5 mg a 5 mg jedenkrát denne. V troch z týchto štúdií sa hodnotila dávka saxagliptínu 10 mg denne. Denná dávka 10 mg saxagliptínu neposkytovala vyššiu účinnosť ako denná dávka 5 mg. Liečba Onglyzou vo všetkých dávkach viedla ku klinicky relevantným a štatisticky významným zlepšeniam hemoglobínu A1c (A1C), plazmatická glukóza nalačno (FPG) a 2-hodinová postprandiálna glukóza (PPG) po štandardnom orálnom glukózovom tolerančnom teste (OGTT) v porovnaní s ovládanie. Zníženia A1C sa pozorovali v rámci podskupín vrátane pohlavia, veku, rasy a základnej hodnoty BMI.
Onglyza nebol v porovnaní s placebom spojený so signifikantnými zmenami v sére oproti východiskovým hodnotám telesnej hmotnosti alebo sérových lipidov nalačno.
monoterapia
Celkom 766 pacientov s diabetom 2. typu nedostatočne kontrolovaných stravou a cvičením (A1C â ‰ ¥ 7% až â ‰ ¤ 10%) sa zúčastnili na dvoch 24-týždňových, dvojito zaslepených, placebom kontrolovaných štúdiách hodnotiacich účinnosť a bezpečnosť Onglyzy monoterapia.
V prvej štúdii bolo po dvojtýždňovej jedno-slepej diéte, záťaži a úvodnom období placeba randomizovaných 401 pacientov na 2,5 mg, 5 mg alebo 10 mg Onglyzy alebo placeba. Pacienti, ktorí v priebehu štúdie nespĺňali konkrétne glykemické ciele, boli liečení záchrannou terapiou metformínom, ktorí boli pridaní k placebu alebo Onglyze. Účinnosť bola vyhodnotená pri poslednom meraní pred záchrannou terapiou u pacientov, ktorí potrebujú záchranu. Titrácia dávky Onglyzy nebola povolená.
Liečba liekom Onglyza 2,5 mg a 5 mg denne poskytla významné zlepšenia A1C, FPG a PPG v porovnaní s placebom (tabuľka 3). Percentuálny podiel pacientov, ktorí prerušili liečbu kvôli nedostatočnej glykemickej kontrole alebo ktorí boli zachránení kvôli splneniu predpísaného cieľa glykemické kritériá boli 16% v liečebnej skupine Onglyza 2,5 mg, 20% v liečebnej skupine Onglyza 5 mg a 26% v liečebnej skupine Onglyza placebo skupina.
Tabuľka 3: Glykemické parametre v 24. týždni v placebom kontrolovanej štúdii monoterapie Onglyza u pacientov s diabetom 2. typu *
| Parameter účinnosti | Onglyza 2,5 mg N = 102 |
Onglyza 5 mg N = 106 |
placebo N = 95 |
|---|---|---|---|
| * Populácia, ktorá sa má liečiť pomocou posledného pozorovania v štúdii alebo posledného pozorovania pred záchrannou terapiou metformínom u pacientov, ktorí potrebujú záchranu. | |||
| †Priemer najmenších štvorcov upravený o základnú hodnotu. | |||
| C p-hodnota <0,0001 v porovnaní s placebom | |||
| § p-hodnota <0,05 v porovnaní s placebom | |||
| ¶ Význam nebol testovaný na 2-hodinové PPG pre dávku 2,5 mg Onglyzy. | |||
| Hemoglobín A1C (%) | N = 100 | N = 103 | N = 92 |
| Základná hodnota (stredná hodnota) | 7.9 | 8.0 | 7.9 |
| Zmena zo základnej línie (upravený priemer†) | −0.4 | −0.5 | +0.2 |
| Rozdiel oproti placebu (upravený priemer†) | −0.6C | −0.6C | |
| 95% interval spoľahlivosti | (−0.9, −0.3) | (−0.9, −0.4) | |
| Percento pacientov dosahujúcich A1C <7% | 35% (35/100) | 38% §(39/103) | 24% (22/92) |
| Plazmatická glukóza nalačno (mg / dl) | N = 101 | N = 105 | N = 92 |
| Základná hodnota (stredná hodnota) | 178 | 171 | 172 |
| Zmena zo základnej línie (upravený priemer†) | −15 | −9 | +6 |
| Rozdiel oproti placebu (upravený priemer†) | −21 § | −15 § | |
| 95% interval spoľahlivosti | (−31, −10) | (−25, −4) | |
| 2-hodinová postprandiálna glukóza (mg / dl) | N = 78 | N = 84 | N = 71 |
| Základná hodnota (stredná hodnota) | 279 | 278 | 283 |
| Zmena zo základnej línie (upravený priemer†) | −45 | −43 | −6 |
| Rozdiel oproti placebu (upravený priemer†) | −39 ¶ | −37 § | |
| 95% interval spoľahlivosti | (−61, −16) | (−59, −15) |
Uskutočnila sa druhá 24-týždňová štúdia monoterapie s cieľom vyhodnotiť rozsah dávkovacích režimov pre Onglyzu. Pacienti bez predchádzajúcej liečby s nedostatočne kontrolovaným diabetom (A1C 7% až 10%) podstúpili dvojtýždňovú jednostupňovú diétu, cvičenie a úvodné obdobie placeba. Celkom 365 pacientov bolo randomizovaných na 2,5 mg každé ráno, 5 mg každé ráno, 2,5 mg s možnou titráciou na 5 mg každé ráno alebo 5 mg každý večer Onglyzy alebo placeba. Pacienti, ktorí v priebehu štúdie nespĺňali konkrétne glykemické ciele, boli liečení záchrannou terapiou metformínom pridanou k placebu alebo Onglyze; počet randomizovaných pacientov na liečebnú skupinu sa pohyboval od 71 do 74.
Liečba Onglyzou 5 mg každé ráno alebo 5 mg každý večer poskytla významné zlepšenie v A1C v porovnaní s placebom (priemerné zníženie korigované placebom o 0,4%, respektíve o 0,3%). Liečba Onglyzou 2,5 mg každé ráno tiež poskytla významné zlepšenie v A1C v porovnaní s placebom (priemerné zníženie korigované placebom o 0,4%).
Kombinovaná terapia
Prídavná kombinovaná terapia s metformínom
Na tejto 24-týždňovej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii sa zúčastnilo 743 pacientov s diabetom 2. typu na vyhodnotenie účinnosť a bezpečnosť Onglyzy v kombinácii s metformínom u pacientov s nedostatočnou kontrolou glykémie (A1C ¥ ‰ 7% a â ‰ ¤ 10%) metformínu sám. Na to, aby boli pacienti zaradení do štúdie, sa od nich vyžadovalo stabilné dávkovanie metformínu (1 500 - 2550 mg denne) po dobu najmenej 8 týždňov.
Pacienti, ktorí splnili kritériá oprávnenosti, boli zaradení do slepého, dvojtýždňového, diétneho a cvičebného úvodného placeba. obdobie, počas ktorého pacienti dostávali metformín v ich pred-študijnej dávke, až do 2500 mg denne, počas trvania liečby študovať. Po úvodnom období boli vhodní pacienti náhodne rozdelení na 2,5 mg, 5 mg alebo 10 mg Onglyzy alebo placeba okrem ich súčasnej dávky otvoreného metformínu. Pacienti, ktorí počas štúdie nespĺňali konkrétne glykemické ciele, boli liečení záchrannou terapiou pioglitazónom, ktorá bola pridaná k existujúcim študijným liekom. Titrácie dávky Onglyzy a metformínu neboli povolené.
Onglyza 2,5 mg a 5 mg prídavok k meformínu poskytol významné zlepšenie v A1C, FPG a PPG v porovnaní s prídavkom metformínu k placebu (tabuľka 4). Priemerné zmeny od základnej hodnoty pre A1C v priebehu času a v koncovom bode sú znázornené na obrázku 1. Podiel pacientov, ktorí prerušili liečbu kvôli nedostatočnej glykemickej kontrole alebo ktorí boli zachránení kvôli splneniu stanovených glykemických kritérií, bol 15% v skupine Onglyza 2,5 mg s prídavkom k metformínu, 13% v skupine Onglyza s 5 mg v skupine s metformínom a 27% v skupine s placebom k metformínu skupina.
Tabuľka 4: Glykemické parametre v 24. týždni v placebom kontrolovanej štúdii Onglyzy ako doplnkovej kombinovanej terapie s metformínom *
| Parameter účinnosti | Onglyza 2,5 mg + metformín N = 192 |
Onglyza 5 mg + metformín N = 191 |
placebo + metformín N = 179 |
|---|---|---|---|
| * Populácia, ktorá sa má liečiť pomocou posledného pozorovania v štúdii alebo posledného pozorovania pred záchrannou terapiou pioglitazónom u pacientov, ktorí potrebujú záchranu. | |||
| †Priemer najmenších štvorcov upravený o základnú hodnotu. | |||
| C p-hodnota <0,0001 v porovnaní s placebom + metformínom | |||
| § p-hodnota <0,05 v porovnaní s placebom + metformínom | |||
| Hemoglobín A1C (%) | N = 186 | N = 186 | N = 175 |
| Základná hodnota (stredná hodnota) | 8.1 | 8.1 | 8.1 |
| Zmena zo základnej línie (upravený priemer†) | −0.6 | −0.7 | +0.1 |
| Rozdiel oproti placebu (upravený priemer†) | −0.7C | −0.8C | |
| 95% interval spoľahlivosti | (−0.9, −0.5) | (−1.0, −0.6) | |
| Percento pacientov dosahujúcich A1C <7% | 37% §(69/186) | 44% §(81/186) | 17% (29/175) |
| Plazmatická glukóza nalačno (mg / dl) | N = 188 | N = 187 | N = 176 |
| Základná hodnota (stredná hodnota) | 174 | 179 | 175 |
| Zmena zo základnej línie (upravený priemer†) | −14 | −22 | +1 |
| Rozdiel oproti placebu (upravený priemer†) | −16 § | −23 § | |
| 95% interval spoľahlivosti | (−23, −9) | (−30, −16) | |
| 2-hodinová postprandiálna glukóza (mg / dl) | N = 155 | N = 155 | N = 135 |
| Základná hodnota (stredná hodnota) | 294 | 296 | 295 |
| Zmena zo základnej línie (upravený priemer†) | −62 | −58 | −18 |
| Rozdiel oproti placebu (upravený priemer†) | −44 § | −40 § | |
| 95% interval spoľahlivosti | (−60, −27) | (−56, −24) |
Obrázok 1: Priemerná zmena oproti základnej hodnote v A1C v placebom kontrolovanom teste Onglyza ako doplnková kombinovaná terapia s metformínom *
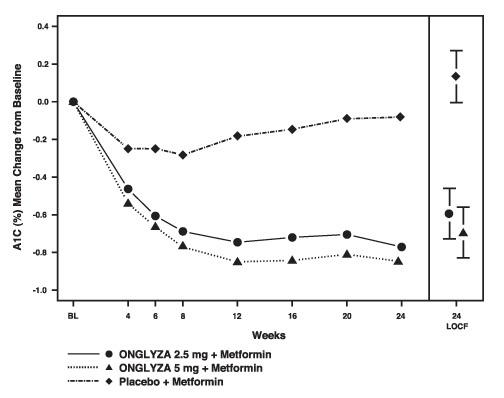
* Zahŕňa pacientov so základnou hodnotou a hodnotou 24 týždňov.
24. týždeň (LOCF) zahŕňa populáciu zameranú na liečbu pomocou posledného pozorovania štúdie pred záchrannou terapiou pioglitazónom u pacientov, ktorí potrebujú záchranu. Priemerná zmena oproti základnej hodnote sa upraví o základnú hodnotu.
Prídavná kombinovaná terapia s tiazolidíndiónom
Na tejto 24-týždňovej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii sa zúčastnilo 565 pacientov s diabetom 2. typu na vyhodnotenie účinnosť a bezpečnosť Onglyzy v kombinácii s tiazolidíndiónom (TZD) u pacientov s nedostatočnou glykemickou kontrolou (A1C C ‰ 7% až â 10,5%) pri Samotný TZD. Na to, aby boli pacienti zaradení do štúdie, sa vyžadovalo stabilné dávkovanie pioglitazónu (30 - 45 mg jedenkrát denne). alebo rosiglitazón (4 mg jedenkrát denne alebo 8 mg jedenkrát denne alebo v dvoch rozdelených dávkach po 4 mg) po dobu najmenej 12 týždňov.
Pacienti, ktorí splnili kritériá oprávnenosti, boli zaradení do slepých, dvojtýždňových diét a cvičení úvodné obdobie placeba, počas ktorého pacienti dostávali TZD v dávke pred začiatkom štúdie počas trvania liečby študovať. Po úvodnom období boli vhodní pacienti náhodne rozdelení na 2,5 mg alebo 5 mg Onglyzy alebo placeba okrem ich súčasnej dávky TZD. Pacienti, ktorí v priebehu štúdie nespĺňali konkrétne glykemické ciele, boli liečení záchranou metformínu a boli pridaní k existujúcim študijným liekom. Počas štúdie nebola povolená titrácia dávky Onglyzy alebo TZD. Zmena režimu TZD z rosiglitazónu na pioglitazón pri špecifikovaných ekvivalentných terapeutických dávkach bola podľa uváženia výskumného pracovníka povolená, ak sa to považuje za lekársky vhodné.
Onglyza 2,5 mg a 5 mg prídavok k TZD poskytol významné zlepšenia A1C, FPG a PPG v porovnaní s prídavkom placeba k TZD (tabuľka 5). Podiel pacientov, ktorí prerušili liečbu kvôli nedostatočnej glykemickej kontrole alebo ktorí boli zachránení kvôli splneniu stanovených glykemických kritérií bola 10% v skupine Onglyza 2,5 mg v skupine s TZD, 6% v skupine s liekom Onglyza 5 mg v skupine s TZD a 10% v skupine s placebom v skupine TZD skupina.
Tabuľka 5: Glykemické parametre v 24. týždni v placebom kontrolovanej štúdii Onglyza ako doplnková kombinovaná terapia s tiazolidíndiónom *
| Parameter účinnosti | Onglyza 2,5 mg + TZD N = 195 |
Onglyza 5 mg + TZD N = 186 |
placebo + TZD N = 184 |
|---|---|---|---|
| * Populácia, ktorá sa má liečiť pomocou posledného pozorovania v štúdii alebo posledného pozorovania pred záchrannou terapiou metformínom u pacientov, ktorí potrebujú záchranu. | |||
| †Priemer najmenších štvorcov upravený o základnú hodnotu. | |||
| C p-hodnota <0,0001 v porovnaní s placebom + TZD | |||
| § p-hodnota <0,05 v porovnaní s placebom + TZD | |||
| Hemoglobín A1C (%) | N = 192 | N = 183 | N = 180 |
| Základná hodnota (stredná hodnota) | 8.3 | 8.4 | 8.2 |
| Zmena zo základnej línie (upravený priemer†) | −0.7 | −0.9 | −0.3 |
| Rozdiel oproti placebu (upravený priemer†) | −0.4 § | −0.6C | |
| 95% interval spoľahlivosti | (−0.6, −0.2) | (−0.8, −0.4) | |
| Percento pacientov dosahujúcich A1C <7% | 42% §(81/192) | 42% §(77/184) | 26% (46/180) |
| Plazmatická glukóza nalačno (mg / dl) | N = 193 | N = 185 | N = 181 |
| Základná hodnota (stredná hodnota) | 163 | 160 | 162 |
| Zmena zo základnej línie (upravený priemer†) | −14 | −17 | −3 |
| Rozdiel oproti placebu (upravený priemer†) | −12 § | −15 § | |
| 95% interval spoľahlivosti | (−20, −3) | (−23, −6) | |
| 2-hodinová postprandiálna glukóza (mg / dl) | N = 156 | N = 134 | N = 127 |
| Základná hodnota (stredná hodnota) | 296 | 303 | 291 |
| Zmena zo základnej línie (upravený priemer†) | −55 | −65 | −15 |
| Rozdiel oproti placebu (upravený priemer†) | −40 § | −50 § | |
| 95% interval spoľahlivosti | (−56, −24) | (−66, −34) |
Doplnková kombinovaná terapia s glyburidom
Na tejto 24-týždňovej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii sa zúčastnilo 768 pacientov s diabetom 2. typu s cieľom vyhodnotiť účinnosť a bezpečnosť. Onglyzy v kombinácii so sulfonylmočovinou (SU) u pacientov s nedostatočnou glykemickou kontrolou pri zaradení (A1C C ‰ 7,5% do â ‰ ¤ 10%) na submaximálnej dávke SU sám. Na to, aby boli pacienti zaradení do štúdie, sa od nich vyžadovala submaximálna dávka SU po dobu 2 mesiacov alebo viac. V tejto štúdii sa liek Onglyza v kombinácii s fixnou strednou dávkou SU porovnával s titráciou s vyššou dávkou SU.
Pacienti, ktorí splnili kritériá oprávnenosti, boli zaradení do jednorázovo slepého, štvortýždňového, diétneho a cvičebného úvodného obdobia a boli umiestení na glyburid 7,5 mg raz denne. Po úvodnom období boli vhodní pacienti s A1C â ‰ ¥ 7% až â ‰ ¤ 10% náhodne rozdelení na 2,5 mg alebo 5 mg doplnku Onglyza k 7,5 mg glyburidu alebo k placebu plus celková denná dávka 10 mg glyburidu. Pacienti, ktorí dostávali placebo, mali nárok na zvýšenú titráciu glyburidu na celkovú dennú dávku 15 mg. Zvýšenie titrácie glyburidu nebolo povolené u pacientov, ktorí dostávali Onglyzu 2,5 mg alebo 5 mg. Glyburid sa mohol v ktorejkoľvek liečebnej skupine titrovať jedenkrát počas 24-týždňového obdobia štúdie v dôsledku hypoglykémie, ako to vyšetrovateľ považoval za potrebné. Približne 92% pacientov v skupine s placebom plus glyburidom bolo titrované na celkovú konečnú dennú dávku 15 mg počas prvých 4 týždňov obdobia štúdie. Pacienti, ktorí počas štúdie nespĺňali konkrétne glykemické ciele, boli liečení záchranou metformínu a boli pridaní k existujúcim študijným liekom. Počas štúdie nebola povolená titrácia dávky Onglyzy.
V kombinácii s glyburidom poskytol Onglyza 2,5 mg a 5 mg významné zlepšenie v A1C, FPG a PPG v porovnaní so skupinou s placebom plus zvýšenou titráciou glyburidu (tabuľka 6). Podiel pacientov, ktorí prerušili liečbu kvôli nedostatočnej glykemickej kontrole alebo ktorí boli zachránení kvôli splneniu stanovených glykemických kritérií, bol 18% Onglyza 2,5 mg prídavok k glyburidovej skupine, 17% v Onglyza 5 mg prídavok k glyburidovej skupine a 30% v placebe plus zvýšený titrovaný glyburid skupina.
Tabuľka 6: Glykemické parametre v 24. týždni v placebom kontrolovanej štúdii Onglyza ako doplnková kombinovaná terapia s glyburidom *
| Parameter účinnosti | Onglyza 2,5 mg + glyburidu 7,5 mg N = 248 |
Onglyza 5 mg + glyburidu 7,5 mg N = 253 |
placebo + Glyburid s titrovaným titrom N = 267 |
|---|---|---|---|
| * Populácia, ktorá sa má liečiť pomocou posledného pozorovania v štúdii alebo posledného pozorovania pred záchrannou terapiou metformínom u pacientov, ktorí potrebujú záchranu. | |||
| †Priemer najmenších štvorcov upravený o základnú hodnotu. | |||
| C p-hodnota <0,0001 v porovnaní s placebom + zvýšeným titrom glyburidu | |||
| § p-hodnota <0,05 v porovnaní s placebom + zvýšeným titrom glyburidu | |||
| Hemoglobín A1C (%) | N = 246 | N = 250 | N = 264 |
| Základná hodnota (stredná hodnota) | 8.4 | 8.5 | 8.4 |
| Zmena zo základnej línie (upravený priemer†) | −0.5 | −0.6 | +0.1 |
| Rozdiel od glykémidu titrovaného na vyššiu titráciu (upravený priemer†) | −0.6C | −0.7C | |
| 95% interval spoľahlivosti | (−0.8, −0.5) | (−0.9, −0.6) | |
| Percento pacientov dosahujúcich A1C <7% | 22% §(55/246) | 23% §(57/250) | 9% (24/264) |
| Plazmatická glukóza nalačno (mg / dl) | N = 247 | N = 252 | N = 265 |
| Základná hodnota (stredná hodnota) | 170 | 175 | 174 |
| Zmena zo základnej línie (upravený priemer†) | −7 | −10 | +1 |
| Rozdiel od glykémidu titrovaného na vyššiu titráciu (upravený priemer†) | −8 § | −10 § | |
| 95% interval spoľahlivosti | (−14, −1) | (−17, −4) | |
| 2-hodinová postprandiálna glukóza (mg / dl) | N = 195 | N = 202 | N = 206 |
| Základná hodnota (stredná hodnota) | 309 | 315 | 323 |
| Zmena zo základnej línie (upravený priemer†) | −31 | −34 | +8 |
| Rozdiel od glykémidu titrovaného na vyššiu titráciu (upravený priemer†) | −38 § | −42 § | |
| 95% interval spoľahlivosti | (−50, −27) | (−53, −31) |
Súbežné podávanie s metformínom u pacientov bez predchádzajúcej liečby
Na tejto 24-týždňovej, randomizovanej, dvojito zaslepenej, placebom kontrolovanej štúdii sa zúčastnilo celkom 1306 pacientov bez liečby s diabetes mellitus 2. typu. vyhodnotiť účinnosť a bezpečnosť Onglyzy užívanej spolu s metformínom u pacientov s nedostatočnou kontrolou glykémie (A1C ‰% 8% až â ‰ ¤12%) na diétu a cvičenie sám. Na to, aby boli pacienti zaradení do tejto štúdie, sa vyžadovalo, aby boli liečení.
Pacienti, ktorí splnili kritériá oprávnenosti, boli zaradení do jednorazovo slepého, týždenného, diétneho a cvičebného obdobia úvodného placeba. Pacienti boli randomizovaní do jedného zo štyroch liečebných ramien: Onglyza 5 mg + metformín 500 mg, saxagliptín 10 mg + metformín 500 mg, saxagliptín 10 mg + placebo alebo metformín 500 mg + placebo. Onglyza sa podávala raz denne. V 3 liečebných skupinách používajúcich metformín sa dávka metformínu zvyšovala titrovaná týždenne v prírastkoch 500 mg za deň, ako je tolerované, na maximum 2 000 mg za deň na základe FPG. Pacienti, ktorí nesplnili špecifické glykemické ciele v priebehu štúdií, boli liečení pioglitazónovou záchranou ako doplnková terapia.
Súbežné podávanie Onglyzy 5 mg plus metformínu prinieslo významné zlepšenie A1C, FPG a PPG v porovnaní s placebom plus metformínom (tabuľka 7).
Tabuľka 7: Glykemické parametre v 24. týždni v placebom kontrolovanom pokuse onglyzového súbežného podávania s metformínom u pacientov bez predchádzajúcej liečby
| Parameter účinnosti | Onglyza 5 mg + metformín N = 320 |
placebo + metformín N = 328 |
|---|---|---|
| * Populácia, ktorá sa má liečiť pomocou posledného pozorovania v štúdii alebo posledného pozorovania pred záchrannou terapiou pioglitazónom u pacientov, ktorí potrebujú záchranu. | ||
| †Priemer najmenších štvorcov upravený o základnú hodnotu. | ||
| C p-hodnota <0,0001 v porovnaní s placebom + metformínom | ||
| § p-hodnota <0,05 v porovnaní s placebom + metformínom | ||
| Hemoglobín A1C (%) | N = 306 | N = 313 |
| Základná hodnota (stredná hodnota) | 9.4 | 9.4 |
| Zmena zo základnej línie (upravený priemer†) | −2.5 | −2.0 |
| Rozdiel od placeba + metformínu (upravený priemer†) | −0.5C | |
| 95% interval spoľahlivosti | (−0.7, −0.4) | |
| Percento pacientov dosahujúcich A1C <7% | 60% §(185/307) | 41% (129/314) |
| Plazmatická glukóza nalačno (mg / dl) | N = 315 | N = 320 |
| Základná hodnota (stredná hodnota) | 199 | 199 |
| Zmena zo základnej línie (upravený priemer†) | −60 | −47 |
| Rozdiel od placeba + metformínu (upravený priemer†) | −13 § | |
| 95% interval spoľahlivosti | (−19, −6) | |
| 2-hodinová postprandiálna glukóza (mg / dl) | N = 146 | N = 141 |
| Základná hodnota (stredná hodnota) | 340 | 355 |
| Zmena zo základnej línie (upravený priemer†) | −138 | −97 |
| Rozdiel od placeba + metformínu (upravený priemer†) | −41 § | |
| 95% interval spoľahlivosti | (−57, −25) |
top
Ako dodávané
Tablety Onglyza ™ (saxagliptín) majú na oboch stranách označenie a sú dostupné v silách a obaloch uvedených v tabuľke 8.
| tableta pevnosť |
Filmom obalené tablety Farba / Tvar |
tableta značenie |
veľkosť balíka | Kód NDC |
|---|---|---|---|---|
| 5 mg | Ružová bikonvexné, okrúhle |
„5“ na jednej strane a „4215“ na zadnej strane, modrým atramentom | Fľaše po 30 Fľaše 90 Fľaše po 500 Blister 100 |
0003-4215-11 0003-4215-21 0003-4215-31 0003-4215-41 |
| 2,5 mg | svetlo žltá až svetlo žltá bikonvexné, okrúhle |
„2,5“ na jednej strane a „4214“ na zadnej strane, modrým atramentom | Fľaše po 30 Fľaše 90 |
0003-4214-11 0003-4214-21 |
Skladovanie a manipulácia
Uchovávajte pri 20 ° -25 ° C (68 ° -77 ° F); odchýlky povolené pri teplote 15 ° - 30 ° C (pozri regulovanú izbovú teplotu USP).
top
Posledná aktualizácia: 07/09
E.R. Squibb & Sons, L.L.C.
Informácie o pacientovi Onglyza
Podrobné informácie o príznakoch, príznakoch, príčinách, liečbe cukrovky
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
späť k: Prejdite si všetky lieky na diabetes



