Avandia na liečbu cukrovky
Názov značky: AVANDIA
Všeobecné meno: rosiglitazón maleát
obsah:
Indikácie a použitie
Dávkovanie a spôsob podávania
Dávkové formy a sily
kontraindikácie
Varovania a bezpečnostné opatrenia
Nežiaduce reakcie
Liekové interakcie
Použitie v špecifických populáciách
predávkovania
popis
Klinická farmakológia
Neklinická toxikológia
Klinické štúdie
Ako dodávané
Avandia, rosiglitazón maleát, informácie o pacientovi (v jednoduchej angličtine)
VÝSTRAHA
Zlyhanie srdcového srdca a myokardiálna ISCHémia
- Tiazolidíndióny vrátane rosiglitazónu spôsobujú alebo zhoršujú kongestívne zlyhanie srdca u niektorých pacientov [pozri UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA]. Po začatí liečby AVANDIA a po zvýšení dávky pozorne sledujte pacientov, či nevykazujú príznaky a príznaky srdcového zlyhania (vrátane nadmerného, rýchleho prírastku na hmotnosti, dýchavičnosti a / alebo edému). Ak sa tieto príznaky a príznaky objavia, zlyhanie srdca sa má liečiť podľa súčasných štandardov starostlivosti. Ďalej sa musí zvážiť vysadenie alebo zníženie dávky AVANDIA.
- AVANDIA sa neodporúča pacientom so symptomatickým srdcovým zlyhaním. Začatie liečby AVANDIA u pacientov so zisteným srdcovým zlyhaním triedy NYHA III alebo IV je kontraindikované. [See Kontraindikácie a UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA.]
- Metaanalýza 42 klinických štúdií (priemerné trvanie 6 mesiacov; 14 237 pacientov), z ktorých väčšina porovnávala AVANDIA s placebom, preukázala, že AVANDIA je spojená so zvýšeným rizikom ischemických príhod myokardu, ako je angína pectoris alebo infarkt myokardu. Tri ďalšie štúdie (priemerné trvanie 41 mesiacov; 14 067 pacientov), pri porovnaní lieku AVANDIA s niektorými inými schválenými perorálnymi antidiabetikami alebo placebom, toto riziko nepotvrdilo ani nevylúčilo. Celkovo sú dostupné údaje o riziku ischémie myokardu nepresvedčivé. [See UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA.]
top
Indikácie a použitie
Monoterapia a kombinovaná terapia
AVANDIA je indikovaná ako doplnok k diéte a cvičeniu na zlepšenie kontroly glykémie u dospelých s diabetes mellitus 2. typu.
Dôležité obmedzenia použitia
- AVANDIA je vďaka svojmu mechanizmu účinku aktívna iba v prítomnosti endogénneho inzulínu. Preto sa AVANDIA nemá používať u pacientov s diabetes mellitus 1. typu alebo na liečbu diabetickej ketoacidózy.
- Súbežné podávanie AVANDIE a inzulínu sa neodporúča.
- Použitie AVANDIA s dusičnanmi sa neodporúča.
top
Dávkovanie a spôsob podávania
Liečba antidiabetickej liečby by mala byť individualizovaná. Všetci pacienti by mali začať s AVANDIA najnižšou odporúčanou dávkou. Ďalšie zvýšenie dávky AVANDIE by malo byť sprevádzané starostlivým monitorovaním nežiaducich udalostí súvisiacich s retenciou tekutín [pozri Varovanie v rámčeku a UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA].
AVANDIA sa môže podávať v počiatočnej dávke 4 mg buď ako jedna denná dávka alebo v dvoch rozdelených dávkach. U pacientov, ktorí neodpovedajú adekvátne po 8 až 12 týždňoch liečby, čo sa zistí znížením plazmatickej glukózy nalačno (FPG) sa dávka môže zvýšiť na 8 mg denne ako monoterapia alebo v kombinácii s metformínom, sulfonylmočovinou alebo sulfonylmočovinou plus metformín. Zníženie glykemických parametrov podľa dávky a režimu je opísané v časti Klinické štúdie. AVANDIA sa môže užívať s jedlom alebo bez jedla.
Celková denná dávka AVANDIE by nemala prekročiť 8 mg.
monoterapia
Zvyčajná počiatočná dávka AVANDIA je 4 mg podávaná buď ako jedna dávka raz denne alebo v rozdelených dávkach dvakrát denne. V klinických skúškach režim 4 mg dvakrát denne spôsobil najväčšie zníženie FPG a hemoglobínu A1c (HbA1c).
Kombinácia so sulfonylmočovinou alebo metformínom
Ak sa AVANDIA pridá k existujúcej terapii, súčasná dávka (dávky) činidla (látok) môže pokračovať na začiatku liečby AVANDIA.
sulfonylmočovinu: Pri použití v kombinácii so sulfonylmočovinou je zvyčajná počiatočná dávka AVANDIA 4 mg podávaná buď ako jedna dávka jedenkrát denne, alebo ako rozdelená dávka dvakrát denne. Ak pacienti hlásia hypoglykémiu, dávka sulfonylmočoviny sa má znížiť.
metformín: Zvyčajná počiatočná dávka AVANDIA v kombinácii s metformínom je 4 mg podávaná buď v jednej dávke jedenkrát denne alebo v rozdelených dávkach dvakrát denne. Je nepravdepodobné, že by dávka metformínu vyžadovala úpravu kvôli hypoglykémii počas kombinovanej liečby s AVANDIA.
Kombinácia so sulfonylmočovinou plus metformínom
Zvyčajná počiatočná dávka AVANDIA v kombinácii so sulfonylmočovinou plus metformínom je 4 mg podávaná buď ako jedna dávka jedenkrát denne, alebo ako rozdelená dávka dvakrát denne. Ak pacienti hlásia hypoglykémiu, dávka sulfonylmočoviny sa má znížiť.
Špecifické populácie pacientov
Porucha funkcie obličiek: Ak sa AVANDIA používa ako monoterapia u pacientov s poškodením obličiek, nie je potrebná úprava dávkovania. Keďže u týchto pacientov je metformín kontraindikovaný, je súčasné podávanie metformínu a AVANDIA kontraindikované aj u pacientov s poškodením obličiek.
Hepatálne poškodenie: Pred začatím liečby AVANDIA by sa mali merať pečeňové enzýmy. Terapia AVANDIA sa nemá začať, ak pacient vykazuje klinické dôkazy o aktívnej látke ochorenie pečene alebo zvýšené hladiny sérových transamináz (ALT> 2,5-násobok hornej hranice normy na začiatku roku 2006) terapia). Po začatí liečby AVANDIA by sa mali pečeňové enzýmy pravidelne monitorovať podľa klinického úsudku lekára. [See UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA a KLINICKÁ FARMAKOLÓGIA.]
deti: Údaje na odporúčanie pediatrického použitia AVANDIA nie sú dostatočné [pozri POUŽITIE V ŠPECIFICKÝCH POPULÁCIÁCH].
top
Dávkové formy a sily
Pentagonálna filmom obalená tableta TILTAB obsahuje rosiglitazón vo forme maleátu takto:
- 2 mg - ružová, s vyrazeným SB na jednej strane a 2 na druhej strane
- 4 mg - oranžová, s vyrazeným SB na jednej strane a 4 na druhej strane
- 8 mg - červenohnedé, s vyrazeným SB na jednej strane a 8 na druhej strane
top
kontraindikácie
Začatie liečby AVANDIA u pacientov so založeným srdcovým zlyhaním New York Heart Association (NYHA) triedy III alebo IV je kontraindikované [pozri VAROVANIE BOXED].
top
Varovania a bezpečnostné opatrenia
Srdcové zlyhanie
AVANDIA, rovnako ako iné tiazolidíndióny, samotné alebo v kombinácii s inými antidiabetikami, môže spôsobiť zadržiavanie tekutín, ktoré môže zhoršiť alebo viesť k zlyhaniu srdca. U pacientov by sa mali sledovať príznaky a príznaky srdcového zlyhania. Ak sa tieto príznaky a príznaky objavia, zlyhanie srdca sa má liečiť podľa súčasných štandardov starostlivosti. Ďalej sa musí zvážiť prerušenie alebo zníženie dávky rosiglitazónu [pozri VAROVANIE BOXED].
Pacienti s kongestívnym zlyhaním srdca (CHF) NYHA triedy I a II liečení AVANDIA majú zvýšené riziko kardiovaskulárnych príhod. 52-týždňová, dvojito zaslepená, placebom kontrolovaná echokardiografická štúdia sa uskutočnila u 224 pacientov s typom 2 diabetes mellitus a NYHA triedy I alebo II CHF (ejekčná frakcia 45%) na pozadí antidiabetík a CHF terapie. Nezávislý výbor vykonal slepé hodnotenie udalostí týkajúcich sa tekutín (vrátane kongestívne zlyhanie srdca) a kardiovaskulárne hospitalizácie podľa vopred definovaných kritérií (Adjudication). Odhliadnuc od súdneho rozhodnutia, vyšetrovatelia hlásili ďalšie kardiovaskulárne nežiaduce účinky. Aj keď nebol pozorovaný žiadny rozdiel v liečbe v porovnaní s východiskovou hodnotou ejekčných frakcií, viac kardiovaskulárne nežiaduce účinky boli pozorované po liečbe AVANDIA v porovnaní s placebom počas IPA 52-týždňové štúdium. (Pozri tabuľku 1.)
Stôl 1. Naléhavé kardiovaskulárne nežiaduce účinky u pacientov s kongestívnym zlyhaním srdca (NYHA triedy I a II) liečených AVANDIA alebo Placebo (okrem základnej antidiabetickej liečby a liečby KF)
| Diania | AVANDIA N = 110 n (%) |
placebo N = 114 n (%) |
| posudzoval | ||
| Kardiovaskulárne úmrtia | 5 (5%) | 4 (4%) |
| Zhoršenie CHF | 7 (6%) | 4 (4%) |
| - s hospitalizáciou cez noc | 5 (5%) | 4 (4%) |
| - bez hospitalizácie cez noc | 2 (2%) | 0 (0%) |
| Nové alebo zhoršujúce sa opuchy | 28 (25%) | 10 (9%) |
| Nová alebo zhoršujúca sa dušnosť | 29 (26%) | 19 (17%) |
| Zvýšenie liekov na CHF | 36 (33%) | 20 (18%) |
| Kardiovaskulárna hospitalizácia * | 21 (19%) | 15 (13%) |
| Vyšetrovateľ hlásený, nerozhodnutý | ||
| Ischemické nežiaduce udalosti | 10 (9%) | 5 (4%) |
| - Infarkt myokardu | 5 (5%) | 2 (2%) |
| - Angina | 6 (5%) | 3 (3%) |
| * Zahŕňa hospitalizáciu z akéhokoľvek kardiovaskulárneho dôvodu. |
Začatie liečby AVANDIA u pacientov so zisteným srdcovým zlyhaním triedy NYHA III alebo IV je kontraindikované. AVANDIA sa neodporúča pacientom so symptomatickým srdcovým zlyhaním. [See VAROVANIE BOXED.]
Pacienti, u ktorých sa vyskytli akútne koronárne syndrómy, sa v kontrolovaných klinických štúdiách neskúmali. Vzhľadom na potenciál rozvoja srdcového zlyhania u pacientov s akútnou koronárnou príhodou nie je zahájená liečba AVANDIA odporúčané pre pacientov, u ktorých došlo k akútnej koronárnej príhode, a vysadenie AVANDIE v tejto akútnej fáze by malo byť potrebné zamyslel.
Pacienti so srdcovým stavom triedy NYHA III a IV (s CHF alebo bez CHF) sa v kontrolovaných klinických štúdiách neskúmali. AVANDIA sa neodporúča pacientom so srdcovým stavom triedy NYHA III a IV.
Ischémia myokardu
Metaanalýza ischémie myokardu v skupine 42 klinických pokusov
Retrospektívne sa vykonala metaanalýza na zhodnotenie kardiovaskulárnych nežiaducich udalostí hlásených v 42 dvojito slepých, randomizovaných, kontrolovaných klinických štúdiách (priemerné trvanie 6 mesiacov).1
Tieto štúdie sa uskutočňovali s cieľom posúdiť účinnosť znižovania glukózy pri cukrovke 2. typu a v týchto štúdiách sa nevyskytlo prospektívne plánované posúdenie kardiovaskulárnych príhod. Niektoré štúdie boli kontrolované placebom a iné používali ako orálne antidiabetické lieky účinné látky. Placebo-kontrolované štúdie zahŕňali štúdie monoterapie (monoterapia AVANDIA verzus placebo monoterapia) a doplnkové štúdie (AVANDIA alebo placebo, pridávané k sulfonylmočovine, metformínu alebo inzulínu). Štúdie aktívnej kontroly zahŕňali štúdie monoterapie (monoterapia AVANDIA verzus sulfonylmočovina alebo metformín monoterapia) a doplnkové štúdie (AVANDIA plus sulfonylmočovina alebo AVANDIA plus metformín verzus sulfonylmočovina plus metformín). Celkovo bolo zahrnutých 14 237 pacientov (8 604 v liečebných skupinách obsahujúcich AVANDIA, 5 633 v porovnávacie skupiny), s expozíciou AVANDIA 4 143 pacientorokov a 2 000 pacientorokov expozície komparátor. Ischemické príhody myokardu zahŕňali angínu pektoris, zhoršenú angínu pectoris, nestabilnú angínu pectoris, zástavu srdca, bolesť na hrudníku, koronárnu oklúzia tepny, dýchavičnosť, infarkt myokardu, koronárna trombóza, ischémia myokardu, choroba koronárnych artérií a koronárna artéria porucha. V tejto analýze zvýšené riziko ischémie myokardu s AVANDIA verzus združené komparátory bola pozorovaná (2% AVANDIA verzus 1,5% komparátory, pravdepodobnostný pomer 1,4, 95% interval spoľahlivosti [CI] 1.1, 1.8). V placebom kontrolovaných štúdiách sa pozorovalo zvýšené riziko ischemických príhod myokardu s AVANDIA, ale nie v štúdiách s kontrolovanou účinnou látkou. (Pozri obrázok 1.)
V štúdiách, kde bol pridaný AVANDIA, sa pozorovalo zvýšené riziko ischemických príhod myokardu na inzulín (2,8% pre AVANDIA plus inzulín verzus 1,4% pre placebo plus inzulín, [ALEBO 2,1, 95% CI 0,9, 5.1]). Toto zvýšené riziko odráža rozdiel 3 udalostí na 100 pacientorokov (95% CI-0,1, 6,3) medzi liečenými skupinami. [See UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA.]
Postava 1. Pomery lesných plôch (95% intervaly spoľahlivosti) pre ischemické príhody myokardu pri metaanalýze 42 klinických pokusov

Zvýšené riziko ischémie myokardu bolo tiež pozorované u pacientov, ktorí dostávali liečbu AVANDIA a dusičnanmi pozadia. Pre používateľov AVANDIA (N = 361) verzus kontrola (N = 244) u používateľov dusičnanov bol pomer šancí 2,9 (95% CI 1,4, 5,9), zatiaľ čo u nitrusových užívateľov (celkovo okolo 14 000 pacientov) bol pomer šancí 1,3 (95% CI 0,9, 1.7). Toto zvýšené riziko predstavuje rozdiel 12 ischemických príhod myokardu na 100 pacientorokov (95% CI 3,3, 21,4). Väčšina používateľov dusičnanov mala koronárne srdcové choroby. U pacientov so známym koronárnym ochorením srdca, ktorí neboli liečení dusičnanmi, nebolo preukázané zvýšené riziko ischemických príhod pre myokard v prípade AVANDIA oproti komparátoru.
Ischemické príhody myokardu vo veľkých dlhodobých perspektívnych randomizovaných kontrolovaných pokusoch AVANDIA
Údaje z 3 ďalších veľkých, dlhodobých, perspektívnych, randomizovaných, kontrolovaných klinických štúdií s AVANDIA sa hodnotili oddelene od metaanalýzy. Tieto 3 štúdie zahŕňajú celkom 14 067 pacientov (liečebné skupiny obsahujúce AVANDIA N = 6 311, porovnávací) skupiny N = 7 756), s expozíciou pacientovi za rok 21 803 pacientorokov pre AVANDIA a 25 998 pacientorokov pre komparátor. V každej štúdii trvanie sledovania prekročilo 3 roky. ADOPT (A Progression Trials Progression Trial) bola 4- až 6-ročná randomizovaná, aktívne kontrolovaná štúdia u nedávno diagnostikovaných pacientov s diabetes mellitus 2. typu, ktorí neboli liečení liekmi.
Bola to skúška účinnosti a všeobecnej bezpečnosti, ktorá bola navrhnutá na preskúmanie trvanlivosti
AVANDIA ako monoterapia (N = 1 456) na kontrolu glykémie pri cukrovke typu 2, s porovnávacími ramenami monoterapie sulfonylmočovinou (N = 1 441) a monoterapiou metformínom (N = 1 454). DREAM (hodnotenie redukcie cukrovky s rosiglitazónom a liečbou ramiprilom, zverejnená správa2) bolo 3 až 3 5-ročná randomizovaná, placebom kontrolovaná štúdia s pacientmi s poruchou glukózovej tolerancie a / alebo s poruchou pôstu glukózu. Má 2x2 faktorový dizajn, určený na vyhodnotenie účinku AVANDIA a osobitne ramiprilu (inhibítor enzýmu konvertujúceho angiotenzín [ACEI]) na progresiu k zjavnej cukrovke. V DREAM bolo 2 635 pacientov v liečebných skupinách obsahujúcich AVANDIA a 2 634 pacientov v liečebných skupinách neobsahujúcich AVANDIA.Zverejnili sa priebežné výsledky 3 pre RECORD (Rosiglitazón vyhodnotený pre kardiologické výsledky a reguláciu glykémie v Diabetes), prebiehajúca otvorená 6-ročná štúdia kardiovaskulárnych výsledkov u pacientov s diabetom 2. typu s priemernou liečbou trvanie 3,75 roka. RECORD zahŕňa pacientov, u ktorých zlyhala monoterapia metformínom alebo sulfonylmočovinou; tí, ktorí nevyhoveli metformínu, sú náhodne vybraní, aby dostali buď doplnok AVANDIA alebo doplnkový sulfonylmočovinu, a tí, ktorým zlyhala sulfonylmočovina, sú náhodne vybraní na príjem doplnku AVANDIA alebo doplnku metformín. V RECORD dostáva celkom 2 220 pacientov doplnok AVANDIA a 2 227 pacientov je jedným z doplnkových režimov, ktoré neobsahujú AVANDIA.
V týchto troch štúdiách sa analýzy uskutočňovali s použitím súboru závažných nepriaznivých kardiovaskulárnych príhod (infarkt myokardu, kardiovaskulárna smrť alebo mozgová príhoda), ďalej označovaná ako MACE. Tento koncový bod sa líšil od širokého koncového bodu metaanalýzy ischemických príhod myokardu, pričom viac ako polovica z nich bola angína pectoris. Infarkt myokardu zahŕňal odsúdený fatálny a nefatálny infarkt myokardu plus náhlu smrť. Ako je znázornené na obrázku 2, výsledky pre 3 sledované parametre (MACE, MI a celková úmrtnosť) sa medzi AVANDIA a porovnávacími štatisticky významne nelíšili.

V predbežných analýzach štúdie DREAM bol výskyt kardiovaskulárnych príhod vyšší u jedincov, ktorí dostal AVANDIA v kombinácii s ramiprilom ako medzi subjektmi, ktoré dostávali ramipril samotný, ako je znázornené na obrázku Obrázok 2. Toto zistenie sa nepotvrdilo v ADOPT a RECORD (aktívne kontrolované štúdie u pacientov s cukrovkou), v ktorých 30% a 40% pacientov uviedlo použitie ACE inhibítorov na začiatku štúdie.
Celkovo sú dostupné údaje o riziku ischémie myokardu nepresvedčivé. Definitívne závery týkajúce sa tohto rizika čakajú na dokončenie primerane navrhnutej štúdie kardiovaskulárnych výsledkov.
Neuskutočnili sa žiadne klinické štúdie, ktoré by preukázali presvedčivý dôkaz o znížení makrovaskulárneho rizika s AVANDIA alebo inými perorálnymi antidiabetikami.
Kongestívne zlyhanie srdca a ischémia myokardu počas súbežného podávania AVANDIE s inzulínom
V štúdiách, v ktorých sa AVANDIA pridávala k inzulínu, AVANDIA zvýšila riziko kongestívneho zlyhania srdca a ischémie myokardu. (Pozri tabuľku 2.)
Súbežné podávanie AVANDIE a inzulínu sa neodporúča. [See Indikácie a použitie a UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA.]
V piatich, 26-týždňových, kontrolovaných, randomizovaných, dvojito zaslepených štúdiách, ktoré boli zahrnuté do metaanalýzy [pozri UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA], boli pacienti s diabetes mellitus 2. typu randomizovaní na súčasné podávanie AVANDIA a inzulínu (N = 867) alebo inzulínu (N = 663). V týchto 5 štúdiách sa do inzulínu pridal AVANDIA. Tieto štúdie zahŕňali pacientov s dlhodobým diabetom (stredná doba trvania 12 rokov) a vysokou prevalenciou už existujúceho ochorenia zdravotné stavy vrátane periférnej neuropatie, retinopatie, ischemickej choroby srdca, cievneho ochorenia a kongestívneho srdca zlyhanie. Celkový počet pacientov so vznikajúcim kongestívnym zlyhaním srdca bol 21 (2,4%) a 7 (1,1%) v skupine AVANDIA plus inzulín a inzulín. Celkový počet pacientov so vznikajúcou ischémiou myokardu bol 24 (2,8%) a 9 (1,4%) v skupine AVANDIA plus inzulín a inzulín (OR 2,1 [95% CI 0,9, 5,1]). Miera výskytu srdcového zlyhania a ischémie myokardu bola však v štúdii nízka Populácia bola pri súčasnom podávaní lieku AVANDIA a inzulín. Tieto kardiovaskulárne príhody boli zaznamenané pri denných dávkach AVANDIA 4 mg aj 8 mg. (Pozri tabuľku 2.)
Tabuľka 2. Výskyt kardiovaskulárnych príhod v 5 kontrolovaných pokusoch o pridanie AVANDIA k zavedenej liečbe inzulínom
| event * | AVANDIA + inzulín (n = 867) n (%) |
inzulín (n = 663) n (%) |
| Kongestívne srdcové zlyhanie | 21 (2.4%) | 7 (1.1%) |
| Ischémia myokardu | 24 (2.8%) | 9 (1.4%) |
| Zložené z kardiovaskulárnej smrti, infarktu myokardu alebo mozgovej príhody | 10 (1.2%) | 5 (0.8%) |
| Mŕtvica | 5 (0.6%) | 4 (0.6%) |
| Infarkt myokardu | 4 (0.5%) | 1 (0.2%) |
| Kardiovaskulárna smrť | 4 (0.5%) | 1 (0.2%) |
| Všetky úmrtia | 6 (0.7%) | 1 (0.2%) |
| * Udalosti nie sú exkluzívne; t. j. pacient s kardiovaskulárnou smrťou v dôsledku infarktu myokardu by sa započítal do 4 kategórií udalostí (ischémia myokardu; kardiovaskulárna smrť, infarkt myokardu alebo mŕtvica; infarkt myokardu; kardiovaskulárna smrť). |
V šiestej, 24-týždňovej, kontrolovanej, randomizovanej, dvojito zaslepenej štúdii AVANDIA a súbežnom podávaní inzulínu bol inzulín pridaný do AVANDAMET®. (rosiglitazónmaleát a metformín HCl) (n = 161) a v porovnaní s inzulínom plus placebom (n = 158) po jednorazovom osemtýždňovom zábehu s AVANDAMET. Pacienti s edémom vyžadujúcim farmakologickú liečbu a pacienti s kongestívnym zlyhaním srdca boli vylúčení na začiatku a počas obdobia zábehu.
V skupine, ktorá dostávala AVANDAMET plus inzulín, sa vyskytla jedna ischemická príhoda myokardu a jedna náhla smrť. V inzulínovej skupine sa nepozorovala žiadna ischémia myokardu a ani v jednej liečenej skupine nebolo hlásené kongestívne zlyhanie srdca.
opuch
AVANDIA sa má používať opatrne u pacientov s opuchom. V klinickej štúdii so zdravými dobrovoľníkmi, ktorí dostávali 8 mg AVANDIA jedenkrát denne počas 8 týždňov, došlo k štatisticky významnému zvýšeniu mediánu v plazme v porovnaní s placebom.
Pretože tiazolidíndióny, vrátane rosiglitazónu, môžu spôsobiť zadržiavanie tekutín, ktoré môžu zhoršovať alebo viesť k kongestívnemu zlyhaniu srdca, AVANDIA sa má používať opatrne u pacientov s rizikom srdca zlyhanie. U pacientov sa majú sledovať príznaky a príznaky srdcového zlyhania [pozri VAROVANIE BOXED, UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA ].
V kontrolovaných klinických skúšaniach s pacientmi s cukrovkou 2. typu bol u pacientov liečených AVANDIA hlásený mierny až stredný edém a môže súvisieť s dávkou. U pacientov s pokračujúcim opuchom boli častejšie nežiaduce účinky spojené s opuchom, ak sa začali s kombinovanou liečbou inzulínom a AVANDIA [pozri NEŽIADUCE REAKCIE].
Nabrať váhu
Prírastok hmotnosti súvisiaci s dávkou sa pozoroval iba pri AVANDIA a v kombinácii s inými hypoglykemickými látkami (tabuľka 3). Mechanizmus nárastu hmotnosti je nejasný, ale pravdepodobne zahŕňa kombináciu zadržiavania tekutín a hromadenia tuku.
Podľa postmarketingových skúseností sa zaznamenali nezvyčajne rýchle zvýšenia hmotnosti a zvýšenie nad rámec toho, čo sa zvyčajne pozorovalo v klinických skúšaniach. U pacientov, u ktorých dochádza k takémuto zvýšeniu, je potrebné vyhodnotiť akumuláciu tekutín a udalosti súvisiace s objemom, ako je nadmerný edém a kongestívne zlyhanie srdca [pozri časť VAROVANIE BOXED].
Tabuľka 3. Zmeny hmotnosti (kg) od základnej línie v koncovom bode počas klinických skúšok
| monoterapia | trvanie | Kontrolná skupina | AVANDIA 4 mg medián (25., 75 percentil) |
AVANDIA 8 mg medián (25., 75 percentil) |
|
| medián (25., 75 percentil) | |||||
| 26 týždňov | placebo | -0.9 (-2.8, 0.9) n = 210 |
1.0 (-0.9, 3.6) n = 436 |
3.1 (1.1, 5.8) n = 439 |
|
| 52 týždňov | sulfonylurea | 2.0 (0, 4.0) n = 173 |
2.0 (-0.6, 4.0) n = 150 |
2.6 (0, 5.3) n = 157 |
|
| Kombinovaná terapia | |||||
| sulfonylmočovina | 24-26 týždňov | sulfonylurea | 0 (-1.0, 1.3) n = 1 155 |
2.2 (0.5, 4.0) n = 613 |
3.5 (1.4, 5.9) n = 841 |
| metformín | 26 týždňov | metformín | -1.4 (-3.2, 0.2) n = 175 |
0.8 (-1.0, 2.6) n = 100 |
2.1 (0, 4.3) n = 184 |
| inzulín | 26 týždňov | inzulín | 0.9 (-0.5, 2.7) n = 162 |
4.1 (1.4, 6.3) n = 164 |
5.4 (3.4, 7.3) n = 150 |
| Sulfonylmočovina + metformín | 26 týždňov | sulfonylmočovina + metformín | 0.2 (-1.2, 1.6) n = 272 |
2.5 (0.8, 4.6) n = 275 |
4.5 (2.4, 7.3) n = 276 |
V 4- až 6-ročnej monoterapii v komparatívnej štúdii (ADOPT) u pacientov, u ktorých sa nedávno diagnostikovala cukrovka typu 2, ktorí predtým neboli liečení antidiabetikami [pozri Klinická štúdias], priemerná zmena hmotnosti (25%)th, 75th percentily) od základnej línie po 4 rokoch bola 3,5 kg (0,0, 8,1) pre AVANDIA, 2,0 kg (-1,0, 4,8) pre glyburid a -2,4 kg (-5,4, 0,5) pre metformín.
V 24-týždňovej štúdii u pediatrických pacientov vo veku 10 až 17 rokov liečených AVANDIA 4 až 8 mg denne bol priemerný prírastok hmotnosti 2,8 kg (25th, 75th percentily: 0,0, 5,8).
Pečeňové účinky
Enzymy pečene by sa mali merať pred začatím liečby AVANDIA u všetkých pacientov a potom pravidelne podľa klinického úsudku lekára. Terapia AVANDIA sa nemá začať u pacientov so zvýšenou východiskovou hladinou pečeňových enzýmov (ALT> 2,5-násobok hornej hranice normy). Pacienti s mierne zvýšenými pečeňovými enzýmami (hladina ALT - 2,5-násobok hornej hranice normy) na začiatku liečby alebo počas liečby AVANDIA sa má vyhodnotiť, aby sa určila príčina pečeňového enzýmu nadmorská výška. Začatie alebo pokračovanie v liečbe AVANDIA u pacientov s miernym zvýšením pečeňových enzýmov by sa malo postupovať opatrne a zahŕňajú dôkladné klinické sledovanie, vrátane monitorovania pečeňových enzýmov, aby sa určilo, či sa zvýšia alebo zvýšia hladiny pečeňových enzýmov zhoršuje. Ak kedykoľvek dôjde k zvýšeniu hladín ALT na> 3-násobok hornej hranice normy u pacientov liečených AVANDIA, mali by sa čo najskôr skontrolovať hladiny pečeňových enzýmov. Ak hladina ALT zostane> 3-násobok hornej hranice normy, liečba AVANDIA by sa mala prerušiť.
Ak sa u ktoréhokoľvek pacienta objavia príznaky naznačujúce dysfunkciu pečene, ktoré môžu zahŕňať nevysvetlenú nevoľnosť, vracanie, bolesť brucha, únavu, anorexiu a / alebo tmavý moč, mali by sa skontrolovať pečeňové enzýmy. Rozhodnutie, či pokračovať v liečbe liekom AVANDIA, sa má riadiť klinickým úsudkom čakajúcim na laboratórne vyšetrenia. Ak je pozorovaná žltačka, lieková terapia by sa mala prerušiť. [See NEŽIADUCE REAKCIE.]
Makulárny edém
Po uvedení lieku na trh bol hlásený makulárny edém u niektorých diabetických pacientov, ktorí užívali AVANDIA alebo iný tiazolidíndión. Niektorí pacienti mali rozmazané videnie alebo zníženú zrakovú ostrosť, ale zdá sa, že u niektorých pacientov bola diagnostikovaná rutinná oftalmologická prehliadka. Väčšina pacientov mala periférny edém v čase diagnostikovania makulárneho edému. U niektorých pacientov sa po vysadení tiazolidíndiónu zlepšil ich makulárny edém. Pacienti s diabetom by mali mať pravidelné očné vyšetrenie oftalmológom podľa štandardov starostlivosti Americkej asociácie pre cukrovku. Okrem toho by mal byť každý diabetik, ktorý hlási akýkoľvek vizuálny príznak, okamžite odoslaný k oftalmológovi bez ohľadu na základné lieky alebo iné fyzické nálezy pacienta. [See NEŽIADUCE REAKCIE.]
zlomeniny
V 4- až 6-ročnej porovnávacej štúdii (ADOPT) kontroly glykémie s monoterapiou u pacientov bez predchádzajúcej liečby diagnostikovaná s diabetes mellitus 2. typu, bola u žien užívajúcich ženy zaznamenaná zvýšená fraktúra kostí AVANDIA. Počas 4- až 6-ročného obdobia bol výskyt zlomenín kostí u žien 9,3% (60/645) u AVANDIA oproti 3,5% (21/605) pre glyburid a 5,1% (30/590) pre metformín. Tento zvýšený výskyt bol zaznamenaný po prvom roku liečby a pretrvával v priebehu štúdie. Väčšina zlomenín u žien, ktoré dostali AVANDIA, sa vyskytla v hornej časti paže, ruky a nohy. Tieto miesta zlomenín sa líšia od miest obvykle spojených s postmenopauzálnou osteoporózou (napr. Bedra alebo chrbtice). U mužov liečených AVANDIA sa nepozorovalo žiadne zvýšenie počtu zlomenín. Pri liečbe pacientov, najmä pacientiek, ktoré sa liečia, by sa malo vziať do úvahy riziko zlomenín AVANDIA a pozornosť venovaná hodnoteniu a udržiavaniu zdravotného stavu kostí v súlade so súčasnými normami starostlivosť.
Hematologické účinky
U dospelých pacientov liečených AVANDIA sa vyskytlo zníženie priemerného hemoglobínu a hematokritu v závislosti od dávky. NEŽIADUCE REAKCIE]. Pozorované zmeny môžu súvisieť so zvýšeným objemom plazmy pozorovaným pri liečbe AVANDIA.
Kontrola cukrovky a glukózy v krvi
U pacientov, ktorí dostávajú AVANDIA v kombinácii s inými hypoglykemickými látkami, môže byť riziko hypoglykémie ohrozené a môže byť potrebné zníženie dávky súbežného lieku.
Na monitorovanie terapeutickej odpovede sa majú vykonávať pravidelné merania hladiny glukózy v krvi a HbA1c nalačno.
ovulácie
Terapia AVANDIA, podobne ako iné tiazolidíndióny, môže u niektorých premenopauzálnych anovulačných žien viesť k ovulácii. V dôsledku toho môžu byť u týchto pacientov počas užívania AVANDIE zvýšené riziko otehotnenia [pozri Použitie v špecifických populáciách]. Preto by sa mala u premenopauzálnych žien odporučiť primeraná antikoncepcia. Tento možný účinok nebol špecificky skúmaný v klinických štúdiách; preto frekvencia tohto výskytu nie je známa.
Aj keď v predklinických štúdiách bola pozorovaná hormonálna nerovnováha [pozri Neklinická toxikológia], klinický význam tohto nálezu nie je známy. Ak sa vyskytne neočakávaná menštruačná dysfunkcia, mali by sa zhodnotiť výhody pokračovania v liečbe AVANDIA.
top
Nežiaduce reakcie
Klinické skúšobné skúsenosti
dospelý
V klinických skúškach bolo AVANDIA liečených približne 9 900 pacientov s diabetom 2. typu.
Krátkodobé pokusy AVANDIA v monoterapii av kombinácii s inými hypoglykemickými látkami
Výskyt a typy nežiaducich udalostí hlásených v krátkodobých klinických štúdiách AVANDIA ako monoterapie sú uvedené v tabuľke 4.
Tabuľka 4. Nežiaduce účinky (â ‰ Treatment 5% v akejkoľvek liečenej skupine) hlásené pacientmi v krátkodobých * dvojito slepých klinických pokusoch s AVANDIA ako monoterapiou
| Preferovaný termín | AVANDIA monoterapia N = 2 526 % |
placebo N = 601 % |
metformín N = 225 % |
Sulfonylureasâ € N = 626 % |
| Infekcia horných dýchacích ciest | 9.9 | 8.7 | 8.9 | 7.3 |
| zranenia | 7.6 | 4.3 | 7.6 | 6.1 |
| bolesť hlavy | 5.9 | 5.0 | 8.9 | 5.4 |
| Bolesť chrbta | 4.0 | 3.8 | 4.0 | 5.0 |
| hyperglykémia | 3.9 | 5.7 | 4.4 | 8.1 |
| únava | 3.6 | 5.0 | 4.0 | 1.9 |
| zápal dutín | 3.2 | 4.5 | 5.3 | 3.0 |
| Hnačka | 2.3 | 3.3 | 15.6 | 3.0 |
| hypoglykémie | 0.6 | 0.2 | 1.3 | 5.9 |
|
* Krátkodobé štúdie sa pohybovali od 8 týždňov do 1 roka. †Zahŕňa pacientov, ktorí dostávajú glyburid (N = 514), gliklazid (N = 91) alebo glipizid (N = 21). |
Celkovo sa pri používaní AVANDIA hlásili typy nežiaducich reakcií bez ohľadu na príčinnú súvislosť v kombinácii so sulfonylmočovinou alebo metformínom boli podobné ako pri monoterapii AVANDIA.
Prípady anémie a edémov boli hlásené častejšie pri vyšších dávkach a boli vo všeobecnosti mierne až stredne závažné a zvyčajne nevyžadovali prerušenie liečby AVANDIA.
V dvojito zaslepených štúdiách bola anémia hlásená u 1,9% pacientov, ktorí dostávali AVANDIA v monoterapii, v porovnaní s 0,7% pri placebe, 0,6% pri sulfonylmočovinách a 2,2% pri metformíne. Hlásenia anémie boli väčšie u pacientov liečených kombináciou AVANDIA a metformínu (7,1%) a kombináciou AVANDIA a sulfonylmočovina plus metformín (6,7%) v porovnaní s monoterapiou AVANDIA alebo v kombinácii so sulfonylmočovinou (2.3%). Nižšie hladiny hemoglobínu / hematokritu pred liečbou u pacientov zaradených do kombinovaných klinických štúdií s metformínom mohli v týchto štúdiách prispieť k vyššej miere hlásenia anémie [pozri NEŽIADUCE REAKCIE].
V klinických štúdiách bol opuch hlásený u 4,8% pacientov, ktorí dostávali AVANDIA v monoterapii, v porovnaní s 1,3% pri placebe, 1,0% pri sulfonylmočovinách a 2,2% pri metformíne. Miera hlásenia edému bola vyššia v prípade AVANDIA 8 mg v kombináciách sulfonylmočoviny (12,4%) v porovnaní s inými kombináciami, s výnimkou inzulínu. Edém bol hlásený u 14,7% pacientov, ktorí dostávali AVANDIA v štúdiách s inzulínovou kombináciou v porovnaní s 5,4% u samotného inzulínu. Hlásenia nového nástupu alebo exacerbácie kongestívneho srdcového zlyhania sa vyskytli pri dávkach 1% pre samotný inzulín a 2% (4 mg) a 3% (8 mg) pre inzulín v kombinácii s AVANDIA [pozri VAROVANIE BOXED a UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA].
V kontrolovaných kombinovaných terapeutických štúdiách so sulfonylmočovinami boli hlásené mierne až stredne ťažké hypoglykemické príznaky, ktoré sa zdajú byť závislé od dávky. Len málo pacientov bolo stiahnutých z dôvodu hypoglykémie (<1%) a niekoľko epizód hypoglykémie bolo považovaných za závažné (<1%). Hypoglykémia bola najčastejšie hláseným nežiaducim účinkom v štúdiách s kombináciou inzulínu s fixnou dávkou, hoci málo pacientov odišlo na hypoglykémiu (4 zo 408 pre AVANDIA plus inzulín a 1 z 203 pre inzulín) sám). Miera hypoglykémie, potvrdená koncentráciou kapilárnej krvnej glukózy 50 mg / dl, bola 6% pre samotný inzulín a 12% (4 mg) a 14% (8 mg) pre inzulín v kombinácii s AVANDIA. [See UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA.]
Dlhodobá skúška AVANDIA ako monoterapie
Štvrtá až šesťročná štúdia (ADOPT) porovnávala použitie AVANDIA (n = 1 456), glyburidu (n = 1 441) a metformínu (n = 1 454) ako monoterapia u pacientov s diagnózou diabetu 2. typu, ktorí neboli predtým liečení antidiabetikami lieky. Tabuľka 5 predstavuje nežiaduce reakcie bez ohľadu na príčinnú súvislosť; hodnoty sú vyjadrené na 100 pacientorokov (PY), aby sa zohľadnili rozdiely v expozícii študovaným liekom v 3 liečebných skupinách.
Pri ADOPT boli zlomeniny hlásené u väčšieho počtu žien liečených AVANDIA (9,3%, 2,7 / 100) pacient-roky) v porovnaní s glyburidom (3,5%, 1,3 / 100 pacient-rokov) alebo metformínom (5,1%, 1,5 / 100 pacient-rokov).
Väčšina zlomenín u žien, ktoré dostali rosiglitazón, bola hlásená v hornej časti paže, ruky a nohy. [See UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIAPozorovaný výskyt zlomenín u pacientov mužského pohlavia bol medzi 3 liečenými skupinami podobný.
Tabuľka 5. Nežiaduce účinky pri liečbe (â ‰ ¥ 5 udalostí / 100 pacientskych rokov [PY]) v akejkoľvek liečebnej skupine hlásené v 4- až 6-ročnej klinickej štúdii AVANDIA ako monoterapia (ADOPT)
| AVANDIA N = 1 456 PY = 4 954 |
glyburidu N = 1 441 PY = 4,244 |
metformín N = 1 454 PY = 4 906 |
|
| zápal nosohltana | 6.3 | 6.9 | 6.6 |
| Bolesť chrbta | 5.1 | 4.9 | 5.3 |
| bolesti kĺbov | 5.0 | 4.8 | 4.2 |
| vysoký tlak | 4.4 | 6.0 | 6.1 |
| Infekcia horných dýchacích ciest | 4.3 | 5.0 | 4.7 |
| hypoglykémie | 2.9 | 13.0 | 3.4 |
| Hnačka | 2.5 | 3.2 | 6.8 |
Pediatric
Bezpečnosť Avandie bola hodnotená v jedinej, aktívne kontrolovanej štúdii s pediatrickými pacientmi s diabetom 2. typu, v ktorých 99 bolo liečených Avandiou a 101 bolo liečených metformínom. Najčastejšie nežiaduce reakcie (> 10%) bez ohľadu na príčinu Avandie alebo metformínu boli bolesť hlavy (17% oproti 14%), nauzea (4% oproti 11%), nazofaryngitída (3% oproti 12%) a hnačka (1% oproti 13%). V tejto štúdii bol hlásený jeden prípad diabetickej ketoacidózy v skupine s metformínom. Okrem toho boli v skupine rosiglitazónu 3 pacienti, ktorí mali FPG 300 mg / dl, 2+ ketonúrie a zvýšenú aniónovú medzeru.
Laboratórne abnormality
hematologickej
U liečených dospelých pacientov došlo k zníženiu priemerného hemoglobínu a hematokritu v závislosti od dávky s Avandiou (priemerný pokles v jednotlivých štúdiách až o 1,0 g / dl hemoglobínu a až o 3,3% hematokritu). Zmeny sa vyskytli primárne počas prvých 3 mesiacov po začatí liečby Avandiou alebo po zvýšení dávky v Avandii. Časový priebeh a rozsah poklesov boli podobné u pacientov liečených kombináciou Avandie a iných hypoglykemických látok alebo monoterapie Avandiou. Hladiny hemoglobínu a hematokritu pred liečbou boli u pacientov v kombinovaných štúdiách s metformínom nižšie a mohli prispieť k vyššej miere hlásenia anémie. V jednej štúdii u pediatrických pacientov sa zaznamenal pokles hemoglobínu a hematokritu (priemerný pokles o 0,29 g / dl a 0,95%). U detských pacientov liečených Avandiou bolo hlásené aj malé zníženie hemoglobínu a hematokritu. Počet bielych krviniek sa tiež mierne znížil u dospelých pacientov liečených Avandiou. Zníženie hematologických parametrov môže súvisieť so zvýšeným objemom plazmy pozorovaným pri liečbe Avandiou.
lipidy
Po liečbe liekom Avandia sa u dospelých pozorovali zmeny v sérových lipidoch [pozri Klinická farmakológia ]. U detí liečených Avandiou počas 24 týždňov boli hlásené malé zmeny parametrov lipidov v sére.
Hladiny sérovej transaminázy
V predbežných schvaľovacích klinických štúdiách u 4 598 pacientov liečených Avandiou (3 600 pacientorokov expozície) a dlhodobo 4- až V 6-ročnej štúdii s 1 456 pacientmi liečenými Avandiou (4 954 pacientorokov) nebola preukázaná prítomnosť liekov vyvolaných liekmi hepatotoxicita.
V predbežne schválených kontrolovaných štúdiách malo 0,2% pacientov liečených Avandiou zvýšenie ALT> 3-násobok hornej hranice normy v porovnaní s 0,2% pri placebe a 0,5% pri aktívnych komparátoroch. Zvýšenie ALT u pacientov liečených Avandiou bolo reverzibilné. Hyperbilirubinémia bola zistená u 0,3% pacientov liečených Avandiou v porovnaní s 0,9% liečených placebom a 1% pacientov liečených aktívnymi komparátormi. V predbežných schvaľovacích klinických štúdiách sa nevyskytli žiadne prípady idiosynkratických reakcií na lieky, ktoré by viedli k zlyhaniu pečene. [See Varovania a bezpečnostné opatrenia]
V 4- až 6-ročnej ADOPT štúdii pacienti liečení Avandiou (4 954 pacientorokov), glyburidom (4 244 pacientorokov) alebo metformín (4 906 pacientorokov), ako monoterapia, mal rovnakú mieru zvýšenia ALT na> 3-násobok hornej hranice normy (0,3 na 100 pacientorokov) expozície).
Postmarketingové skúsenosti
Okrem nežiaducich reakcií hlásených z klinických skúšok boli počas používania lieku Avandia identifikované aj nižšie uvedené udalosti. Pretože tieto udalosti sú hlásené dobrovoľne z populácie neznámej veľkosti, nie je možné spoľahlivo odhadnúť ich frekvenciu alebo vždy stanoviť príčinnú súvislosť s vystavením drogám.
U pacientov, ktorí dostávajú terapiu tiazolidíndiónom, potenciálne závažné nežiaduce udalosti s fatálnym následkom alebo bez neho súvisiace s expanziou objemu (napr. kongestívne zlyhanie srdca, pľúcny edém a pleurálne výpotky). [pozri Varovanie v rámčeku a Varovania a bezpečnostné opatrenia].
Existujú postmarketingové správy s Avandiou o hepatitíde, zvýšením pečeňových enzýmov na 3 alebo viackrát vyššie horná hranica normálnej hodnoty a zlyhanie pečene s fatálnymi následkami a bez nich, hoci kauzalita nebola stanovené.
Zriedkavo boli hlásené vyrážky, svrbenie, žihľavka, angioedém, anafylaktická reakcia a Stevensov-Johnsonov syndróm.
Boli tiež hlásené prípady nového nástupu alebo zhoršenia diabetického makulárneho edému so zníženou ostrosťou zraku [pozri Varovania a bezpečnostné opatrenia].
top
Liekové interakcie
Inhibítory a induktory CYP2C8
Inhibítor CYP2C8 (napr. Gemfibrozil) môže zvýšiť AUC rosiglitazónu a induktor CYP2C8 (napr. Rifampín) môže znížiť AUC rosiglitazónu. Preto, ak sa inhibítor alebo induktor CYP2C8 začne alebo zastaví počas liečby rosiglitazónom, môžu byť potrebné zmeny v liečbe cukrovky na základe klinickej odpovede. [See KLINICKÁ FARMAKOLÓGIA.]
top
Použitie v špecifických populáciách
tehotenstvo
Tehotenstvo kategória C.
Všetky tehotenstvá majú základné riziko vrodených chýb, straty alebo iného nepriaznivého výsledku bez ohľadu na expozíciu lieku. Toto základné riziko sa zvyšuje u tehotenstiev komplikovaných hyperglykémiou a pri dobrej metabolickej kontrole sa môže znížiť. Pre pacientky s cukrovkou alebo anamnézou gestačného diabetu je nevyhnutné udržiavať dobrú metabolickú kontrolu pred počatím a počas tehotenstva. U týchto pacientov je nevyhnutné starostlivo monitorovať kontrolu glukózy. Väčšina odborníkov odporúča, aby sa monoterapia inzulínom používala počas tehotenstva, aby sa hladina glukózy v krvi udržiavala čo najbližšie k normálu.
Ľudské údaje: Uvádza sa, že rosiglitazón prechádza cez ľudskú placentu a dá sa zistiť vo fetálnom tkanive. Klinický význam týchto nálezov nie je známy. Neexistujú dostatočné a dobre kontrolované štúdie u tehotných žien. AVANDIA sa nemá používať počas tehotenstva.
Štúdie na zvieratách: Pri liečbe rosiglitazónom počas skorého tehotenstva u potkanov nemal žiadny vplyv na implantáciu ani na embryo, ale liečba počas neskorého tehotenstva bola u potkanov a králikov spojená so smrťou plodu a spomalením rastu. Teratogenita sa nepozorovala pri dávkach do 3 mg / kg u potkanov a 100 mg / kg u králikov (približne 20 a 75-násobok ľudskej AUC pri maximálnej odporúčanej ľudskej dennej dávke). Rosiglitazón spôsobil u potkanov placentárnu patológiu (3 mg / kg / deň). Ošetrenie potkanov počas gravidity prostredníctvom laktácie znížilo veľkosť vrhu, životaschopnosť novorodencov a postnatálny rast, so spomalením rastu reverzibilným po puberte. Pokiaľ ide o účinky na placentu, embryo / plod a potomstvo, dávka bez účinku bola u potkanov 0,2 mg / kg / deň a u králikov 15 mg / kg / deň. Tieto hladiny bez účinku sú približne 4-násobok ľudskej AUC pri maximálnej odporúčanej dennej dávke pre človeka. Rosiglitazón znížil počet implantácií maternice a živých potomkov, keď sa mláďatá samíc potkanov liečili pri 40 mg / kg / deň od 27 dní do sexuálnej zrelosti (približne 68-násobok ľudskej AUC pri maximálnej odporúčanej dennej dávke) dávka). Hladina bez účinku bola 2 mg / kg / deň (približne 4-násobok ľudskej AUC pri maximálnej odporúčanej dennej dávke). Neexistoval žiadny vplyv na pre-alebo postnatálne prežitie alebo rast.
Práca a dodávka
Účinok rosiglitazónu na pôrod a pôrod u ľudí nie je známy.
Dojčiace matky
V mlieku od laktujúcich potkanov sa zistil materiál súvisiaci s liekom. Nie je známe, či sa AVANDIA vylučuje do materského mlieka. Pretože sa veľa liekov vylučuje do materského mlieka, AVANDIA sa nemá podávať dojčiacej žene.
Pediatrické použitie
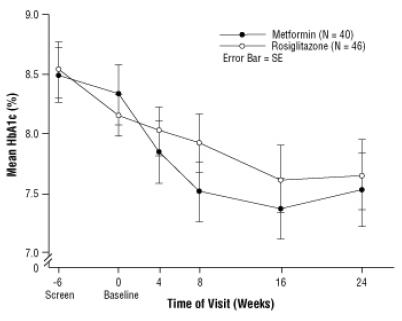
Po zavedení placeba vrátane poradenstva pri diéte, deti s diabetes mellitus 2. typu, vo veku 10 až 17 rokov a so stredným indexom telesnej hmotnosti (BMI) 33 kg / m, boli randomizované do liečby 2 mg dvakrát denne AVANDIA (n = 99) alebo 500 mg dvakrát denne metformínu (n = 101) v 24-týždňovej, dvojito zaslepenej klinickej štúdii trial. Podľa očakávania sa FPG znížil u pacientov bez predchádzajúcej liečby cukrovkou (n = 104) a zvýšil sa u pacientov, ktorí boli vyradení z predchádzajúcej liečby (zvyčajne metformín) (n = 90) počas obdobia zábehu. Po najmenej 8 týždňoch liečby malo 49% pacientov liečených AVANDIA a 55% pacientov liečených metformínom dvojnásobnú dávku, ak FPG> 126 mg / dl. Pre celkovú populáciu, ktorá sa mala liečiť, bola v 24. týždni priemerná zmena HbA1c oproti východiskovej hodnote -0,14% pri AVANDIA a -0,49% pri metformíne. V tejto štúdii nebol dostatočný počet pacientov na štatistické zistenie, či sú títo
pozorované priemerné účinky liečby boli podobné alebo rôzne. Účinky liečby sa líšili u pacientov, ktorí predtým neužívali liečbu antidiabetikami, a u pacientov predtým liečených antidiabetikami (tabuľka 6).
Tabuľka 6. 24. týždeň sa zmena FPG a HbA1c mení od základnej línie, ktorá bola v poslednom období pozorovaná, u detí s východiskovou hodnotou HbA1c> 6,5%
| Pacienti bez predchádzajúcej liečby | Pacienti, ktorí sa predtým liečili | |||
|
metformín N = 40 |
rosiglitazón N = 45 |
metformín N = 43 |
rosiglitazón N = 32 |
|
| FPG (mg / dl) | ||||
| Základná hodnota (stredná hodnota) | 170 | 165 | 221 | 205 |
| Zmena oproti základnej hodnote (priemer) | -21 | -11 | -33 | -5 |
| Upravený rozdiel v liečbe * (rosiglitazón-metformín) - (95% CI) | 8 (-15, 30) |
21 (-9, 51) |
||
| % pacientov s 30 mg / dl klesá oproti východiskovým hodnotám | 43% | 27% | 44% | 28% |
| HbA1c (%) | ||||
| Základná hodnota (stredná hodnota) | 8.3 | 8.2 | 8.8 | 8.5 |
| Zmena oproti základnej hodnote (priemer) | -0.7 | -0.5 | -0.4 | 0.1 |
| Upravený rozdiel v liečbe * (rosiglitazón-metformín) - (95% CI) | 0.2 (-0.6, 0.9) |
0.5 (-0.2, 1.3) |
||
| % pacientov s â ‰ ¥ 0,7% poklesom oproti východiskovým hodnotám | 63% | 52% | 54% | 31% |
|
* Zmena z východiskových prostriedkov je najmenších štvorcov, čo znamená prispôsobenie východiskovej hodnote HbA1c, pohlavia a regiónu. †Pozitívne hodnoty pre rozdiel uprednostňujú metformín. |
Rozdiely v liečbe záviseli od základnej hodnoty BMI alebo od hmotnosti, takže účinky AVANDIA a metformínu sa zdali byť porovnateľnejšie u ťažších pacientov. Priemerný prírastok na hmotnosti bol 2,8 kg pri rosiglitazóne a 0,2 kg pri metformíne [pozri UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA]. 52% pacientov liečených rosiglitazónom a 32% pacientov liečených metformínom získalo ¥ ‰ 2 kg a 33% pacientov liečených rosiglitazónom a 7% pacientov liečených metformínom získalo 5 kg na študovať.
Nežiaduce účinky pozorované v tejto štúdii sú opísané v časti Nežiaduce reakcie).
Obrázok 3. Priemerný HbA1c v priebehu 24-týždňovej štúdie AVANDIA a metformínu u detských pacientov - podskupina liečiv bez predchádzajúcej liečby
Geriatrické použitie
Výsledky farmakokinetickej analýzy populácie ukázali, že vek nemá významný vplyv na farmakokinetiku rosiglitazónu [pozri KLINICKÁ FARMAKOLÓGIA]. Preto nie sú potrebné žiadne úpravy dávkovania pre starších ľudí. V kontrolovaných klinických štúdiách sa nepozorovali žiadne celkové rozdiely v bezpečnosti a účinnosti medzi staršími (¥ 65 rokov) a mladšími (<65 rokov) pacientmi.
top
predávkovania
Pokiaľ ide o predávkovanie u ľudí, sú k dispozícii obmedzené údaje. V klinických štúdiách u dobrovoľníkov sa AVANDIA podávala v jednej perorálnej dávke do 20 mg a bola dobre tolerovaná. V prípade predávkovania sa má začať vhodná podporná liečba, ktorá je daná klinickým stavom pacienta.
top
popis
AVANDIA (rosiglitazón maleát) je perorálne antidiabetikum, ktoré účinkuje predovšetkým zvyšovaním citlivosti na inzulín. AVANDIA zlepšuje kontrolu glykémie a súčasne znižuje hladiny cirkulujúceho inzulínu.
Rosiglitazónmaleát nie je chemicky ani funkčne príbuzný so sulfonylmočovinami, biguanidmi alebo inhibítormi alfa-glukozidázy.
Chemicky je rosiglitazónmaleát (±) -5 - [[4- [2- (metyl-2-pyridinylamino) etoxy] fenyl] metyl] -2,4-tiazolidíndión, (Z) -2-buténdioát (1: 1) s molekulovou hmotnosťou 473,52 (357,44 voľná báza). Molekula má jedno chirálne centrum a je prítomná ako racemát. Vďaka rýchlej vzájomnej premene sú enantioméry funkčne nerozoznateľné. Štruktúrny vzorec rosiglitazón maleátu je:
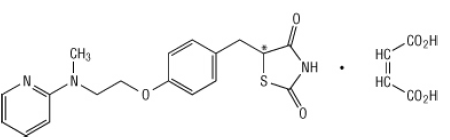
Molekulový vzorec je C18H19N303S-C4H4O4. Rosiglitazón maleát je biela až takmer biela tuhá látka s teplotou topenia 122 až 123 ° C. Hodnoty pKa rosiglitazón maleátu sú 6,8 a 6,1. Je ľahko rozpustný v etanole a pufrovaný vodný roztok s pH 2,3; rozpustnosť klesá so zvyšujúcim sa pH vo fyziologickom roztoku Rozsah.
Každá päťuholníková filmom obalená tableta TILTAB obsahuje rosiglitazónmaleát ekvivalentný rosiglitazónu, 2 mg, 4 mg alebo 8 mg, na perorálne podanie. Neaktívne zložky sú: Hypromelóza 2910, monohydrát laktózy, stearát horečnatý, mikrokryštalická celulóza, polyetylénglykol 3000, sodná soľ karboxymetylškrobu, oxid titaničitý, triacetín a 1 alebo viac z nasledujúcich látok: Syntetické červené a žlté oxidy železa a mastenec.
top
Klinická farmakológia
Mechanizmus akcie
Rosiglitazón, člen triedy tiazolidíndiónov antidiabetík, zlepšuje kontrolu glykémie zlepšením citlivosti na inzulín. Rosiglitazón je vysoko selektívny a silný agonista receptora gama aktivovaného proliferátorom peroxizómov (PPARγ). U ľudí sa receptory PPAR nachádzajú v kľúčových cieľových tkanivách pre pôsobenie inzulínu, ako je napríklad tukové tkanivo, kostrové svalstvo a pečeň. Aktivácia jadrových receptorov PPAR® reguluje transkripciu génov reagujúcich na inzulín zapojených do kontroly produkcie glukózy, transportu a jej využitia. Okrem toho sa na regulácii metabolizmu mastných kyselín podieľajú aj gény reagujúce na PPARÎ.
Inzulínová rezistencia je bežný znak charakterizujúci patogenézu diabetu typu 2. Antiabiabetická aktivita rosiglitazónu bola preukázaná na zvieracích modeloch cukrovky typu 2 v roku 2007 ktorá hyperglykémia a / alebo zhoršená tolerancia glukózy je dôsledkom inzulínovej rezistencie v cieli tkaniva. Rosiglitazón znižuje koncentrácie glukózy v krvi a znižuje hyperinzulinémiu u ob / obéznych myší, diabetických myší db / db a mastných potkanov Zucker.
Na zvieracích modeloch sa ukázalo, že antidiabetická aktivita rosiglitazónu je sprostredkovaná zvýšenou citlivosťou na pôsobenie inzulínu v pečeni, svale a tukovom tkanive. Farmakologické štúdie na zvieracích modeloch naznačujú, že rosiglitazón inhibuje pečeňovú glukoneogenézu. Expresia glukózového transportéra glukózy regulovaného inzulínom bola zvýšená v tukovom tkanive. Rosiglitazón nevyvolával hypoglykémiu na zvieracích modeloch cukrovky typu 2 a / alebo zhoršenej glukózovej tolerancie.
farmakodynamika
Pacienti s abnormalitami lipidov neboli vylúčení z klinických štúdií s AVANDIA.
Vo všetkých 26 týždňových kontrolovaných štúdiách, v odporúčanom rozmedzí dávok, bola AVANDIA ako monoterapia spojená so zvýšením celkového cholesterolu, LDL a HDL a znížením voľných mastných kyselín. Tieto zmeny boli štatisticky významne odlišné od placebových alebo glyburidových kontrol (tabuľka 7).
K zvýšeniu LDL došlo predovšetkým počas prvých 1 až 2 mesiacov liečby AVANDIA a hladiny LDL zostali počas skúšok zvýšené nad východiskovú hodnotu. Naopak, HDL v priebehu času stále rástol. Výsledkom bolo, že pomer LDL / HDL dosiahol vrchol po 2 mesiacoch liečby a potom sa zdalo, že v priebehu času klesá. Vzhľadom na časovú povahu zmien lipidov je 52-týždňová štúdia kontrolovaná glyburidom najvhodnejšia na vyhodnotenie dlhodobých účinkov na lipidy. Na začiatku, 26. a 52. týždeň, boli priemerné pomery LDL / HDL 3,1, 3,2 a 3,0 pre AVANDIA 4 mg dvakrát denne. Zodpovedajúce hodnoty pre glyburid boli 3,2, 3,1 a 2,9. Rozdiely v zmene východiskovej hodnoty medzi AVANDIA a glyburidom v 52. týždni boli štatisticky významné.
Vzorec zmien LDL a HDL po liečbe AVANDIA v kombinácii s inými hypoglykemickými látkami bol vo všeobecnosti podobný ako pri AVANDIA pri monoterapii.
Zmeny triglyceridov počas liečby AVANDIA boli variabilné a vo všeobecnosti sa štatisticky nelíšili od placebových alebo glyburidových kontrol.
Tabuľka 7. Súhrn priemerných zmien lipidov v 26-týždňových placebom kontrolovaných a 52-týždňových štúdiách kontrolovaných glyburidom v monoterapii
| Štúdia placebom kontrolovaných 26. týždeň | Štúdia kontrolovaná glyburidom 26. a 26. týždeň | ||||||
| placebo | AVANDIA | Titrácia glyburidu | AVANDIA 8 mg | ||||
| 4 mg denne * | 8 mg denne * | Wk 26 | Wk 52 | Wk 26 | Wk 52 | ||
| Voľné mastné kyseliny | |||||||
| N | 207 | 428 | 436 | 181 | 168 | 166 | 145 |
| Základná hodnota (priemer)% | 18.1 | 17.5 | 17.9 | 26.4 | 26.4 | 26.9 | 26.6 |
| Zmena oproti základnej hodnote (priemer) | +0.2% | -7.8% | -14.7% | -2.4% | -4.7% | -20.8% | -21.5% |
| LDL | |||||||
| N | 190 | 400 | 374 | 175 | 160 | 161 | 133 |
| Základná hodnota (priemer)% | 123.7 | 126.8 | 125.3 | 142.7 | 141.9 | 142.1 | 142.1 |
| Zmena oproti základnej hodnote (priemer) | +4.8% | +14.1% | +18.6% | -0.9% | -0.5% | +11.9% | +12.1% |
| HDL | |||||||
| N | 208 | 429 | 436 | 184 | 170 | 170 | 145 |
| Základná hodnota (priemer)% | 44.1 | 44.4 | 43.0 | 47.2 | 47.7 | 48.4 | 48.3 |
| Zmena oproti základnej hodnote (priemer) | +8.0% | +11.4% | +14.2% | +4.3% | +8.7% | +14.0% | +18.5% |
| * Kombinovali sa dávkovacie skupiny raz denne a dvakrát denne. |
farmakokinetika
Maximálna plazmatická koncentrácia (Cmax) a plocha pod krivkou (AUC) rosiglitazónu sa zvyšujú úmerne k dávke v terapeutickom rozmedzí dávok (tabuľka 8). Eliminačný polčas je 3 až 4 hodiny a je nezávislý od dávky.
Tabuľka 8. Priemerné (SD) farmakokinetické parametre pre rosiglitazón po jednorazových perorálnych dávkach (N = 32)
| parameter | 1 mg pôstu | 2 mg pôstu | 8 mg pôstu | 8 mg Fed |
| AUC0-inf [Ng-h / ml] |
358 (112) |
733 (184) |
2,971 (730) |
2,890 (795) |
| Cmax [Ng / ml] |
76 (13) |
156 (42) |
598 (117) |
432 (92) |
| Polovičný život [H] |
3.16 (0.72) |
3.15 (0.39) |
3.37 (0.63) |
3.59 (0.70) |
| CL / F * [L / h] |
3.03 (0.87) |
2.89 (0.71) |
2.85 (0.69) |
2.97 (0.81) |
| * CL / F = Ústna vôľa. |
vstrebávanie
Absolútna biologická dostupnosť rosiglitazónu je 99%. Maximálne plazmatické koncentrácie sa pozorujú asi 1 hodinu po podaní. Podávanie rosiglitazónu spolu s jedlom neviedlo k žiadnej zmene v celkovej expozícii (AUC), ale došlo k približne 28% zníženiu Cmax a oneskoreniu Tmax (1,75 hodiny). Je nepravdepodobné, že tieto zmeny budú klinicky významné; Preto sa AVANDIA môže podávať s jedlom alebo bez jedla.
distribúcia
Priemerný (CV%) perorálny distribučný objem (Vss / F) rosiglitazónu je približne 17,6 (30%) litrov na základe farmakokinetickej analýzy populácie. Rosiglitazón sa približne z 99,8% viaže na plazmatické bielkoviny, predovšetkým na albumín.
metabolizmus
Rosiglitazón sa extenzívne metabolizuje bez toho, aby sa nezmenilo liečivo vylúčené močom. Hlavnými spôsobmi metabolizmu boli N-demetylácia a hydroxylácia, po ktorej nasledovala konjugácia so sulfátom a kyselinou glukurónovou. Všetky cirkulujúce metabolity sú podstatne menej účinné ako materské látky, a preto sa neočakáva, že prispievajú k inzulínovej senzibilizačnej aktivite rosiglitazónu.
Údaje in vitro ukazujú, že rosiglitazón je prevažne metabolizovaný izoenzýmom 2C8 cytochrómu P450 (CYP), pričom CYP2C9 prispieva ako menšia cesta.
vylučovanie
Po perorálnom alebo intravenóznom podaní [14C] rosiglitazón maleátu sa približne 64% a 23% dávky vylúčilo močom a stolicou. Plazmatický polčas materiálu príbuzného [14C] sa pohyboval od 103 do 158 hodín.
Populačná farmakokinetika u pacientov s diabetom 2. typu
Populačná farmakokinetická analýza z 3 veľkých klinických štúdií vrátane 642 mužov a 405 žien s cukrovkou 2. typu (vo veku 35 rokov) do 80 rokov) preukázali, že farmakokinetika rosiglitazónu nie je ovplyvnená vekom, rasou, fajčením ani alkoholom Spotreba. Ukázalo sa, že perorálny klírens (CL / F) aj distribučný objem v ústnom rovnovážnom stave (Vss / F) sa zvyšujú so zvyšovaním telesnej hmotnosti. V rozsahu hmotnosti pozorovanom pri týchto analýzach (50 až 150 kg) sa rozsah predpokladaných hodnôt CL / F a Vss / F menil <1,7-násobok, respektíve <2,3-násobok.
Okrem toho sa preukázalo, že rosiglitazón CL / F je ovplyvňovaný hmotnosťou aj pohlavím, pričom je nižší (približne 15%) u pacientiek.
Osobitné skupiny obyvateľstva
geriatrickej
Výsledky farmakokinetickej analýzy populácie (n = 716 <65 rokov; n = 331 × 65 rokov) ukázalo, že vek nemá významný vplyv na farmakokinetiku rosiglitazónu.
rod
Výsledky populačnej farmakokinetickej analýzy ukázali, že priemerný perorálny klírens rosiglitazónu v r pacientky (n = 405) boli približne o 6% nižšie v porovnaní s mužskými pacientmi s rovnakou telesnou hmotnosťou (n = 642).
Ako monoterapia av kombinácii s metformínom AVANDIA zlepšila kontrolu glykémie u mužov aj žien. V kombinovaných štúdiách s metformínom sa preukázala účinnosť bez rodových rozdielov v glykemickej odpovedi.
V štúdiách monoterapie sa pozorovala väčšia terapeutická odpoveď u žien; u obéznejších pacientov však boli rodové rozdiely menej zrejmé. Pre daný index telesnej hmotnosti (BMI) majú ženy tendenciu mať väčšiu tukovú hmotu ako muži. Pretože molekulárny cieľ PPARÎ3 je exprimovaný v tukových tkanivách, táto diferenciačná charakteristika môže prinajmenšom čiastočne zodpovedať za väčšiu reakciu na AVANDIA u žien. Keďže terapia by mala byť individualizovaná, nie je potrebná žiadna úprava dávky len na základe pohlavia.
Hepatálne poškodenie
Neviazaný perorálny klírens rosiglitazónu bol významne nižší u pacientov so stredne ťažkým až ťažkým ochorením pečene (Child-Pugh trieda B / C) v porovnaní so zdravými jedincami. Výsledkom bolo, že neviazané Cmax a AUC0-inf sa zvýšili 2- a 3-násobne. Eliminačný polčas rosiglitazónu bol u pacientov s ochorením pečene asi o 2 hodiny dlhší v porovnaní so zdravými jedincami.
Terapia AVANDIA sa nemá začať, ak pacient vykazuje klinické dôkazy o aktívnej látke ochorenie pečene alebo zvýšené hladiny sérových transamináz (ALT> 2,5-násobok hornej hranice normy) na začiatku liečby [pozri UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA].
Pediatric
Farmakokinetické parametre rosiglitazónu u detských pacientov boli stanovené pomocou populačnej farmakokinetickej analýzy s riedkymi údajmi z 96 detskí pacienti v jednej pediatrickej klinickej štúdii zahŕňajúcej 33 mužov a 63 žien vo veku od 10 do 17 rokov (hmotnosť v rozmedzí od 35 do 35 rokov) 178,3 kg). Priemerná populácia CL / F a V / F rosiglitazónu bola 3,15 l / h, respektíve 13,5 l. Tieto odhady CL / F a V / F boli konzistentné s odhadmi typických parametrov z predchádzajúcej analýzy populácie dospelých.
Porucha funkcie obličiek
Neexistujú klinicky významné rozdiely vo farmakokinetike rosiglitazónu u pacientov s miernym závažným poškodením obličiek alebo u hemodialyzovaných pacientov v porovnaní s jedincami s normálnou obličkou Funkcie. U týchto pacientov, ktorí dostávajú AVANDIA, nie je preto potrebná úprava dávkovania. Keďže je metformín kontraindikovaný u pacientov s poškodením obličiek, je súčasné podávanie metformínu s AVANDIA u týchto pacientov kontraindikované.
závod
Výsledky populačnej farmakokinetickej analýzy zahŕňajúcej subjekty belošského, čierneho a iného etnického pôvodu naznačujú, že rasa nemá žiadny vplyv na farmakokinetiku rosiglitazónu.
Interakcie liečivo-liečivo
Lieky, ktoré inhibujú, indukujú alebo sú metabolizované cytochrómom P450
Štúdie metabolizmu liečiv in vitro naznačujú, že rosiglitazón pri klinicky relevantných koncentráciách neinhibuje žiadny z hlavných enzýmov P450. Údaje in vitro ukazujú, že rosiglitazón je prevažne metabolizovaný prostredníctvom CYP2C8 av menšej miere 2C9. Ukázalo sa, že AVANDIA (4 mg dvakrát denne) nemá klinicky významný vplyv na farmakokinetiku nifedipínové a perorálne kontraceptíva (etinylestradiol a noretindron), ktoré sa metabolizujú prevažne podľa CYP3A4.
gemfibrozil
Súčasné podávanie gemfibrozilu (600 mg dvakrát denne), inhibítora CYP2C8 a rosiglitazónu (4 mg jedenkrát denne) denne) po dobu 7 dní zvýšená AUC rosiglitazónu o 127% v porovnaní s podávaním rosiglitazónu (4 mg raz denne) sám. Vzhľadom na potenciál nežiaducich účinkov súvisiacich s dávkou rosiglitazónu môže byť pri zavedení gemfibrozilu potrebné znížiť dávku rosiglitazónu [pozri DROGOVÉ INTERAKCIE].
rifampín
Uvádza sa, že podávanie rifampínu (600 mg raz denne), induktor CYP2C8, počas 6 dní znižuje AUC rosiglitazónu o 66% v porovnaní s podávaním samotného rosiglitazónu (8 mg) [pozri DROGOVÉ INTERAKCIE].4
glyburidu
AVANDIA (2 mg dvakrát denne) užívaná súčasne s glyburidom (3,75 až 10 mg / deň) počas 7 dní sa nezmenila priemerné ustálené 24-hodinové koncentrácie glukózy v plazme u diabetických pacientov stabilizované na glyburide terapie. Opakované dávky AVANDIA (8 mg jedenkrát denne) počas 8 dní u zdravých dospelých kaukazských jedincov spôsobili zníženie AUC a Cmax glyburidu približne o 30%. U japonských jedincov sa AUC a Cmax glyburidu po súčasnom podaní AVANDIA mierne zvýšili.
glimepirid
Jednorazové perorálne dávky glimepiridu u 14 zdravých dospelých jedincov nemali klinicky významný vplyv na farmakokinetiku AVANDIA v rovnovážnom stave. Žiadne klinicky významné zníženie AUC a C glimepiridumax boli pozorované po opakovaných dávkach AVANDIA (8 mg jedenkrát denne) počas 8 dní u zdravých dospelých jedincov.
metformín
Súčasné podávanie AVANDIE (2 mg dvakrát denne) a metformínu (500 mg dvakrát denne) zdravým spôsobom dobrovoľníci počas 4 dní nemali žiadny vplyv na farmakokinetiku rovnovážneho stavu metformínu alebo rosiglitazón.
akarbóza
Súbežné podávanie akarbózy (100 mg trikrát denne) zdravým dobrovoľníkom počas 7 dní nemalo klinicky významný vplyv na farmakokinetiku jednorazovej perorálnej dávky AVANDIA.
digoxín
Opakované perorálne dávkovanie AVANDIE (8 mg jedenkrát denne) počas 14 dní nezmenilo farmakokinetiku digoxínu v rovnovážnom stave (0,375 mg jedenkrát denne) u zdravých dobrovoľníkov.
warfarín
Opakované dávkovanie AVANDIE nemalo klinicky významný vplyv na farmakokinetiku warfarínových enantiomérov v rovnovážnom stave.
etanol
Jednorazové podanie mierneho množstva alkoholu nezvýšilo riziko akútnej hypoglykémie u pacientov s diabetes mellitus 2. typu liečených AVANDIA.
ranitidín
Predchádzajúca liečba ranitidínom (150 mg dvakrát denne počas 4 dní) nezmenila farmakokinetiku jednotlivých perorálnych ani intravenóznych dávok rosiglitazónu u zdravých dobrovoľníkov.
Tieto výsledky naznačujú, že absorpcia orálneho rosiglitazónu sa nemení za podmienok sprevádzaných zvýšením gastrointestinálneho pH.
top
Neklinická toxikológia
Karcinogenéza, mutagenéza, zhoršenie plodnosti
karcinogenézy:
U myší Charles-Charles CD-1 sa vykonala dvojročná štúdia karcinogenity v dávkach 0,4, 1,5 a 6 mg / kg / deň u strava (najvyššia dávka zodpovedá približne 12-násobku ľudskej AUC pri maximálnej odporúčanej dennej dávke u človeka) dávka). Potkanom Sprague-Dawley sa podávali orálne žalúdočnou sondou po dobu 2 rokov v dávkach 0,05, 0,3 a 2 mg / kg / deň (ekvivalent najvyššej dávky) na približne 10 a 20-násobok ľudskej AUC pri maximálnej odporúčanej dennej dávke u ľudí pre samce a samice potkanov, v tomto poradí).
Rosiglitazón nebol u myší karcinogénny. U myší sa pri dávkach 1,5 mg / kg / deň (približne 2-násobok ľudskej AUC pri maximálnej odporúčanej ľudskej dennej dávke) zvýšil výskyt hyperplázie tukového tkaniva. U potkanov sa významne zvýšil výskyt benígnych nádorov tukového tkaniva (lipómy). v dávkach 0,3 mg / kg / deň (približne 2-násobok ľudskej AUC pri maximálnej odporúčanej ľudskej dennej dávke). Tieto proliferatívne zmeny u obidvoch druhov sa považujú za dôsledok pretrvávajúcej farmakologickej nadmernej stimulácie tukového tkaniva.
Mutagenita:
Rosiglitazón nebol mutagénny ani klastogénny v in vitro bakteriálnych testoch na génovú mutáciu, in vitro test chromozómových aberácií v ľudských lymfocytoch, test myších mikronukleov in vivo a UDS potkanov in vivo / in vitro Test. V teste na myšacom lymfóme in vitro sa v prítomnosti metabolickej aktivácie pozorovalo malé (asi dvojnásobné) zvýšenie mutácie.
Zhoršenie plodnosti:
Rosiglitazón nemal žiadny vplyv na párenie alebo fertilitu samcov potkanov podávaných do 40 mg / kg / deň (približne 116-násobok ľudskej AUC pri maximálnej odporúčanej dennej dávke u ľudí). Rosiglitazón zmenil estrálnu cyklickosť (2 mg / kg / deň) a zníženú plodnosť (40 mg / kg / deň) samíc potkanov v spojení s nižšou plazmatické hladiny progesterónu a estradiolu (približne 20 a 200-násobok ľudskej AUC pri maximálnej odporúčanej ľudskej dennej dávke, v tomto poradí). Žiadne takéto účinky neboli zaznamenané pri dávke 0,2 mg / kg / deň (približne 3-násobok ľudskej AUC pri maximálnej odporúčanej ľudskej dennej dávke). U mladých potkanov, ktorým sa podávala dávka od veku 27 dní do pohlavnej zrelosti (až do 40 mg / kg / deň), nemal žiadny vplyv na reprodukčnú schopnosť samcov, alebo o estrálnej cyklickosti, párení alebo výskyte gravidity u žien (približne 68-násobok AUC u ľudí pri maximálnej odporúčanej dennej dávke u ľudí) dávka). U opíc rosiglitazón (0,6 a 4,6 mg / kg / deň; približne 3 a 15-násobok ľudskej AUC pri maximálnej odporúčanej dennej dávke pre človeka), znížil nárast folikulárnej fázy v sérovom estradiole s následným znížením nárastu luteinizačného hormónu, nižšími hladinami progesterónu v luteálnej fáze a amenorrhea. Mechanizmus týchto účinkov sa javí ako priama inhibícia ovariálnej steroidogenézy.
Toxikológia zvierat
Hmotnosť srdca sa zvýšila u myší (3 mg / kg / deň), potkanov (5 mg / kg / deň) a psov (2 mg / kg / deň) s rosiglitazónom. liečby (približne 5, 22 a 2-násobok ľudskej AUC pri maximálnej odporúčanej ľudskej dennej dávke). Účinky na juvenilné potkany boli konzistentné s účinkami pozorovanými u dospelých. Morfometrické meranie ukázalo, že v srdcových komorových tkanivách bola hypertrofia, ktorá môže byť spôsobená zvýšenou srdcovou prácou v dôsledku expanzie objemu plazmy.
top
Klinické štúdie
monoterapia
V klinických štúdiách viedla liečba AVANDIA k zlepšeniu kontroly glykémie, merané pomocou FPG a HbA1c, so súčasným znížením inzulínu a C-peptidu. Tiež sa znížila postprandiálna glukóza a inzulín. Toto je v súlade s mechanizmom účinku AVANDIA ako inzulínového senzibilizátora.
Maximálna odporúčaná denná dávka je 8 mg. Štúdie zamerané na dávkovanie naznačujú, že pri celkovej dennej dávke 12 mg sa nedosiahol žiadny ďalší prínos.
Krátkodobé klinické štúdie: Celkom 2 315 pacientov s cukrovkou 2. typu, predtým liečených samotnou diétou alebo antidiabetickými liekmi, bolo liečených AVANDIA ako monoterapia u 6 dvojito slepých štúdie, ktoré zahŕňali dve 26-týždňové placebom kontrolované štúdie, jednu 52týždňovú štúdiu kontrolovanú glyburidom a tri placebom kontrolované štúdie rozsahu dávok v trvaní 8 až 12 týždňov. Predchádzajúce antidiabetické lieky boli stiahnuté a pacienti pred randomizáciou vstúpili do 2- až 4-týždňového zábehu s placebom.
Dve 26-týždňové, dvojito zaslepené, placebom kontrolované štúdie, u pacientov s cukrovkou 2. typu (n = 1 400) s neadekvátnou glykémiou kontrola (priemerná základná hodnota FPG približne 228 mg / dl [101 až 425 mg / dl] a priemerná základná hodnota HbA1c 8,9% [5,2% až 16,2%]), boli vykonané. Liečba AVANDIA priniesla štatisticky významné zlepšenie v FPG a HbA1c v porovnaní so základnou hodnotou a v porovnaní s placebom. Údaje z jednej z týchto štúdií sú zhrnuté v tabuľke 9.
Tabuľka 9: Glykemické parametre v 26-týždňovej placebom kontrolovanej skúške
| placebo N = 173 |
AVANDIA | AVANDIA | |||
| 4 mg jedenkrát denne N = 180 |
2 mg dvakrát denne N = 186 |
8 mg jedenkrát denne N = 181 |
4 mg dvakrát denne N = 187 |
||
| FPG (mg / dl) | |||||
| Základná hodnota (stredná hodnota) | 225 | 229 | 225 | 228 | 228 |
| Zmena oproti základnej hodnote (priemer) | 8 | -25 | -35 | -42 | -55 |
| Rozdiel oproti placebu (upravený priemer) | - | -31* | -43* | -49* | -62* |
| % pacientov s 30 mg / dl klesá oproti východiskovým hodnotám | 19% | 45% | 54% | 58% | 70% |
| HbA1c (%) | |||||
| Základná hodnota (stredná hodnota) | 8.9 | 8.9 | 8.9 | 8.9 | 9.0 |
| Zmena oproti základnej hodnote (priemer) | 0.8 | 0.0 | -0.1 | -0.3 | -0.7 |
| Rozdiel oproti placebu (upravený priemer) | - | -0.8* | -0.9* | -1.1* | -1.5* |
| % pacientov s â ‰ ¥ 0,7% poklesom oproti východiskovým hodnotám | 9% | 28% | 29% | 39% | 54% |
| * p <0,0001 v porovnaní s placebom. |
Pri podaní v rovnakej celkovej dennej dávke bol AVANDIA vo všeobecnosti účinnejší pri znižovaní FPG a HbA1c, keď sa podával v rozdelených dávkach dvakrát denne v porovnaní s dávkami jedenkrát denne. Avšak v prípade HbA1c nebol rozdiel medzi dávkami 4 mg jedenkrát denne a 2 mg dvakrát denne štatisticky významný.
Dlhodobé klinické štúdie
Dlhodobé udržanie účinku sa hodnotilo v 52-týždňovej, dvojito zaslepenej, glyburidom kontrolovanej štúdii u pacientov s cukrovkou 2. typu. Pacienti boli randomizovaní na liečbu AVANDIA 2 mg dvakrát denne (N = 195) alebo AVANDIA 4 mg dvakrát denne (N = 189) alebo glyburidom (N = 202) počas 52 týždňov. Pacienti, ktorí dostávali glyburid, dostali počiatočnú dávku 2,5 mg / deň alebo 5,0 mg / deň. Dávka sa potom titrovala v prírastkoch 2,5 mg / deň v priebehu nasledujúcich 12 týždňov, až do maximálnej dávky 15,0 mg / deň, aby sa optimalizovala glykemická kontrola. Potom sa dávka glyburidu udržiavala konštantná.
Stredná titrovaná dávka glyburidu bola 7,5 mg. Všetky ošetrenia viedli k štatisticky významnému zlepšeniu kontroly glykémie od základnej línie (obrázok 4 a obrázok 5). Na konci 52. týždňa bolo zníženie FPG a HbA1c oproti východiskovým hodnotám -40,8 mg / dl a -0,53% pri AVANDIA 4 mg dvakrát denne; -25,4 mg / dl a -0,27% s AVANDIA 2 mg dvakrát denne; a -30,0 mg / dl a -0,72% s glyburidom. V prípade HbA1c nebol rozdiel medzi AVANDIA 4 mg dvakrát denne a glyburidom štatisticky významný v 52. týždni. Počiatočný pokles FPG s glyburidom bol vyšší ako pri AVANDIA; tento účinok bol však časom menej odolný.
Zlepšenie glykemickej kontroly pozorované pri AVANDIA 4 mg dvakrát denne v 26. týždni sa udržiavalo až do 52. týždňa štúdie.
Obrázok 4. Priemerný FPG v priebehu času v 52-týždňovej štúdii kontrolovanej glyburidom

Obrázok 5. Priemerný HbA1c v priebehu času v 52-týždňovej štúdii kontrolovanej glyburidom
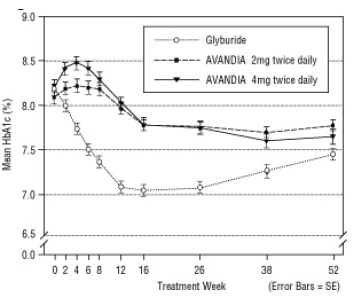
Hypoglykémia bola hlásená u 12,1% pacientov liečených glyburidom oproti 0,5% (2 mg dvakrát denne) a 1,6% (4 mg dvakrát denne) pacientov liečených AVANDIA. Zlepšenie glykemickej kontroly bolo spojené s priemerným prírastkom hmotnosti 1,75 kg a 2,95 kg pre pacienti liečení AVANDIA 2 mg a 4 mg dvakrát denne, v porovnaní s 1,9 kg liečených glyburidom pacienti. U pacientov liečených AVANDIA boli C-peptid, inzulín, pro-inzulín a pro-inzulínové štiepené produkty významne znížená dávkovo usporiadaným spôsobom v porovnaní so zvýšením glyburidu ošetreného pacienti.
Diabetes Outcome Progression Trial (ADOPT) bola multicentrická, dvojito zaslepená kontrolovaná štúdia (N = 4 351), ktorá sa uskutočňovala počas 4 až 6 rokov s cieľom porovnať bezpečnosť a účinnosť. AVANDIA, metformínu a glyburidu v monoterapii u pacientov, u ktorých bola nedávno diagnostikovaná diabetes mellitus 2. typu (â ‰ years 3 roky) nedostatočne kontrolovaná diétou a cvičenia. Priemerný vek pacientov v tejto štúdii bol 57 rokov a väčšina pacientov (83%) nemala v anamnéze kardiovaskulárne ochorenie. Priemerné základné hodnoty FPG a HbA1c boli 152 mg / dl a 7,4%. Pacienti boli randomizovaní, aby dostávali buď AVANDIA 4 mg jedenkrát denne, glyburid 2,5 mg jedenkrát denne alebo metformín 500 mg jedenkrát denne a dávky boli titrovaný na optimálnu kontrolu glykémie až do maxima 4 mg dvakrát denne pre AVANDIA, 7,5 mg dvakrát denne pre glyburid a 1 000 mg dvakrát denne pre metformín. Primárnym výsledkom účinnosti bol čas po sebe idúcich FPG> 180 mg / dl po najmenej 6 týždňoch liečby na maximum tolerovaná dávka študovaného liečiva alebo čas do nedostatočnej kontroly glykémie, ako bolo stanovené nezávislým rozhodnutím výbor.
Kumulatívny výskyt primárneho výsledku účinnosti po 5 rokoch bol 15% pri AVANDIA, 21% pri metformíne a 34% s glyburidom (pomer rizika 0,68 [95% CI 0,55, 0,85] oproti metformínu, HR 0,37 [95% CI 0,30, 0,45] proti glyburidu).
Údaje o kardiovaskulárnych a nežiaducich udalostiach (vrátane účinkov na telesnú hmotnosť a zlomeniny kostí) od ADOPT pre AVANDIA, metformín a glyburid sú opísané v UPOZORNENIA A BEZPEČNOSTNÉ OPATRENIA a NEŽIADUCE REAKCIE, resp. Rovnako ako pri všetkých liekoch sa musia výsledky účinnosti posudzovať spolu s informáciami o bezpečnosti, aby sa vyhodnotil potenciálny prínos a riziko pre jednotlivého pacienta.
Kombinácia s metformínom alebo sulfonylmočovinou
Pridanie AVANDIA k metformínu alebo sulfonylmočovine malo za následok významné zníženie hyperglykémie v porovnaní s ktorýmkoľvek z týchto činidiel samotných. Tieto výsledky zodpovedajú aditívnemu účinku na kontrolu glykémie, keď sa AVANDIA používa ako kombinovaná terapia.
Kombinácia s metformínom
Celkovo sa 670 pacientov s cukrovkou 2. typu zúčastnilo na dvoch 26-týždňových, randomizovaných, dvojito zaslepených, placebom / aktívne kontrolované štúdie určené na vyhodnotenie účinnosti AVANDIA v kombinácii s metformín. AVANDIA podávaná v dávkovacích režimoch jedenkrát alebo dvakrát denne sa pridala k liečbe pacientov, ktorí neboli dostatočne kontrolovaní maximálnou dávkou metformínu (2,5 g / deň).
V jednej štúdii pacienti nedostatočne kontrolovali 2,5 g / deň metformínu (priemerná východisková hodnota 216 mg / dl FPG a priemerná východisková hodnota) HbA1c 8,8%) bolo randomizovaných, aby dostávali 4 mg AVANDIA jedenkrát denne, 8 mg AVANDIA jedenkrát denne alebo placebo okrem metformín. Štatisticky významné zlepšenie v FPG a HbA1c sa pozorovalo u pacientov liečených kombináciou metformín a 4 mg AVANDIA jedenkrát denne a 8 mg AVANDIA jedenkrát denne, v porovnaní s pacientmi pokračujúcimi samotným metformínom (Tabuľka 10).
Tabuľka 10. Glykemické parametre v 26-týždňovej kombinovanej štúdii s AVANDIA Plus Metformin
| metformín N = 113 |
AVANDIA 4 mg jedenkrát denne + metformín N = 116 |
AVANDIA 8 mg jedenkrát denne + metformín N = 110 |
|
| FPG (mg / dl) | |||
| Základná hodnota (stredná hodnota) | 214 | 215 | 220 |
| Zmena oproti základnej hodnote (priemer) | 6 | -33 | -48 |
| Rozdiel od samotného metformínu (upravený priemer) | - | -40* | -53* |
| % pacientov s 30 mg / dl klesá oproti východiskovým hodnotám | 20% | 45% | 61% |
| HbA1c (%) | |||
| Základná hodnota (stredná hodnota) | 8.6 | 8.9 | 8.9 |
| Zmena oproti základnej hodnote (priemer) | 0.5 | -0.6 | -0.8 |
| Rozdiel od samotného metformínu (upravený priemer) | - | -1.0* | -1.2* |
| % pacientov s â ‰ ¥ 0,7% poklesom oproti východiskovým hodnotám | 11% | 45% | 52% |
| * p <0,0001 v porovnaní s metformínom. |
V druhej 26-týždňovej štúdii boli pacienti s diabetes mellitus 2. typu nedostatočne kontrolovaní 2,5 g / deň metformínu, ktorí boli randomizovaní, aby dostali kombináciu AVANDIA 4 mg dvakrát denne a metformín (N = 105) vykázal štatisticky významné zlepšenie glykemickej kontroly so stredným liečebným účinkom na FPG -56 mg / dl a priemerným liečebným účinkom pre HbA1c o -0,8% v porovnaní s samotný metformín. Kombinácia metformínu a AVANDIA viedla k nižším hladinám FPG a HbA1c ako ktorékoľvek z týchto látok samotných.
Pacienti, ktorí neboli dostatočne kontrolovaní maximálnou dávkou metformínu (2,5 g / deň) a ktorí boli prešiel na monoterapiu s AVANDIA preukázal stratu kontroly glykémie, o čom svedčí zvýšenie FPG a HbA1c. V tejto skupine boli tiež pozorované zvýšenia LDL a VLDL.
Kombinácia so sulfonylmočovinou
Celkom 3 457 pacientov s cukrovkou 2. typu sa zúčastnilo na desiatich 24 - 26-týždňových randomizovaných, dvojito zaslepených, placebom / kontrolovaných štúdiách a jednej Dvojročná dvojito zaslepená, aktívne kontrolovaná štúdia u starších pacientov určená na hodnotenie účinnosti a bezpečnosti AVANDIA v kombinácii s sulfonylurea. Podával sa AVANDIA 2 mg, 4 mg alebo 8 mg denne, jedenkrát denne (3 štúdie) alebo v rozdelených dávkach dvakrát denne (7 štúdií), pacientom nedostatočne kontrolovaným submaximálnou alebo maximálnou dávkou sulfonylurea.
V týchto štúdiách kombinácia AVANDIA 4 mg alebo 8 mg denne (podávaná v jednej dávke alebo dvakrát denne v rozdelených dávkach) a sulfonylmočovina významne znížila FPG a HbA1c v porovnaní s placebom plus sulfonylmočovinou alebo ďalšou titráciou sulfonylurea. Tabuľka 11 ukazuje súhrnné údaje pre 8 štúdií, v ktorých sa AVANDIA pridaná k sulfonylmočovine porovnávala s placebom plus sulfonylmočovinou.
Tabuľka 11. Glykemické parametre v 24- až 26-týždňových kombinovaných štúdiách AVANDIA Plus Sulfonylmočovina
| Dávkovanie dvakrát denne (5 štúdií) | sulfonylmočovina N = 397 |
AVANDIA 2 mg dvakrát denne + sulfonylmočovina N = 497 |
sulfonylmočovina N = 248 |
AVANDIA 4 mg dvakrát denne + sulfonylmočovina N = 346 |
| FPG (mg / dl) | ||||
| Základná hodnota (stredná hodnota) | 204 | 198 | 188 | 187 |
| Zmena oproti základnej hodnote (priemer) | 11 | -29 | 8 | -43 |
| Rozdiel od samotnej sulfonylmočoviny (upravený priemer) | - | -42* | - | -53* |
| % pacientov s 30 mg / dl klesá oproti východiskovým hodnotám | 17% | 49% | 15% | 61% |
| HbA1c (%) | ||||
| Základná hodnota (stredná hodnota) | 9.4 | 9.5 | 9.3 | 9.6 |
| Zmena oproti základnej hodnote (priemer) | 0.2 | -1.0 | 0.0 | -1.6 |
| Rozdiel od samotnej sulfonylmočoviny (upravený priemer) | - | -1.1* | - | -1.4* |
| % pacientov s â ‰ ¥ 0,7% poklesom oproti východiskovým hodnotám | 21% | 60% | 23% | 75% |
| Dávkovanie jedenkrát denne (3 štúdie) | sulfonylmočovina N = 172 |
AVANDIA 4 mg jedenkrát denne + sulfonylmočovina N = 172 |
sulfonylmočovina N = 173 |
AVANDIA 8 mg jedenkrát denne + sulfonylmočovina N = 176 |
| FPG (mg / dl) | ||||
| Základná hodnota (stredná hodnota) | 198 | 206 | 188 | 192 |
| Zmena oproti základnej hodnote (priemer) | 17 | -25 | 17 | -43 |
| Rozdiel od samotnej sulfonylmočoviny (upravený priemer) | - | -47* | - | -66* |
| % pacientov s 30 mg / dl klesá oproti východiskovým hodnotám | 17% | 48% | 19% | 55% |
| HbA1c (%) | ||||
| Základná hodnota (stredná hodnota) | 8.6 | 8.8 | 8.9 | 8.9 |
| Zmena oproti základnej hodnote (priemer) | 0.4 | -0.5 | 0.1 | -1.2 |
| Rozdiel od samotnej sulfonylmočoviny (upravený priemer) | - | -0.9* | - | -1.4* |
| % pacientov s â ‰ ¥ 0,7% poklesom oproti východiskovým hodnotám | 11% | 36% | 20% | 68% |
| * p <0,0001 v porovnaní so samotnou sulfonylmočovinou. |
Jedna z 24- až 26-týždňových štúdií zahŕňala pacientov, ktorí boli nedostatočne kontrolovaní maximálnymi dávkami glyburidu a prešli na monoterapiu na 4 mg AVANDIA denne; v tejto skupine bola demonštrovaná strata glykemickej kontroly, o čom svedčí zvýšenie FPG a HbA1c.
V dvojročnej dvojito zaslepenej štúdii boli starší pacienti (vo veku 59 až 89 rokov) na polovicu maximálnej sulfonylmočoviny (glipizid 10 mg dvakrát denne) randomizovaní na pridanie AVANDIA (n = 115, 4 mg raz denne do 8 mg podľa potreby) alebo k pokračujúcej titrácii glipizidu (n = 110) až do maximálnej dávky 20 mg dvakrát denne. Priemerná východisková hodnota FPG a HbA1c bola 157 mg / dl a 7,72% pre rameno AVANDIA plus glipizid a 159 mg / dl a 7,65% pre rameno titrácie glipizidu nahor. Strata glykémie (FPG G ‰ 180 mg / dl) sa vyskytla u významne nižšieho podielu pacientov (2%) na AVANDIA plus glipizid v porovnaní s pacientmi v skupine s titračnou dávkou glipizidu (28,7%). Približne 78% pacientov v kombinovanej terapii ukončilo 2 roky liečby, zatiaľ čo iba 51% pacientov ukončilo monoterapiu glipizidom. Účinok kombinovanej terapie na FPG a HbA1c bol trvalý počas dvojročného obdobia štúdie u pacientov dosiahnutie priemeru 132 mg / dl pre FPG a priemeru 6,98% pre HbA1c v porovnaní so žiadnou zmenou glipizidu rameno.
Kombinácia so sulfonylmočovinou plus metformínom
V dvoch 24- až 26-týždňových, dvojito zaslepených, placebom kontrolovaných štúdiách navrhnutých na vyhodnotenie účinnosti a bezpečnosti AVANDIA v kombinácii so sulfonylmočovinou plus metformínom, AVANDIA 4 mg alebo 8 mg denne, bol podávaný v rozdelených dávkach dvakrát denne, pacientom, ktoré neboli dostatočne kontrolované submaximálnymi (10 mg) a maximálnymi (20 mg) dávkami glyburidu a maximálnou dávkou metformínu (2 g / deň). U pacientov liečených kombináciou sulfonylmočoviny sa pozorovalo štatisticky významné zlepšenie FPG a HbA1c plus metformín a 4 mg AVANDIA a 8 mg AVANDIA verzus pacienti pokračovali v liečbe sulfonylmočovinou a metformínom, ako je uvedené v tabuľke 12.
Tabuľka 12. Glykemické parametre v 26-týždňovej kombinovanej štúdii AVANDIA Plus Sulfonylmočovina a metformín
| Sulfonylmočovina + metformín N = 273 |
AVANDIA 2 mg dvakrát denne + sulfonylmočovina + metformín N = 276 |
AVANDIA 4 mg dvakrát denne + sulfonylmočovina + metformín N = 277 |
|
| FPG (mg / dl) | |||
| Základná hodnota (stredná hodnota) | 189 | 190 | 192 |
| Zmena oproti základnej hodnote (priemer) | 14 | -19 | -40 |
| Rozdiel od sulfonylmočoviny plus metformínu (upravený priemer) | - | -30* | -52* |
| % pacientov s 30 mg / dl klesá oproti východiskovým hodnotám | 16% | 46% | 62% |
| HbA1c (%) | |||
| Základná hodnota (stredná hodnota) | 8.7 | 8.6 | 8.7 |
| Zmena oproti základnej hodnote (priemer) | 0.2 | -0.4 | -0.9 |
| Rozdiel od sulfonylmočoviny plus metformínu (upravený priemer) | - | -0.6* | -1.1* |
| % pacientov s â ‰ ¥ 0,7% poklesom oproti východiskovým hodnotám | 16% | 39% | 63% |
| * p <0,0001 v porovnaní s placebom. |
top
Referencie
- Stručný dokument správy potravín a liečiv. Spoločné zasadnutie poradných výborov pre metabolické lieky endokrinného pôvodu, bezpečnosti liekov a riadenia rizík. Júl 2007.
- Vyšetrovatelia skúšok DREAM. Účinok rosiglitazónu na frekvenciu cukrovky so zníženou toleranciou glukózy alebo so zníženou glukózou nalačno: randomizovaná kontrola lanceta 2006;368:1096-1105.
- Home PD, Pocock SJ, Beck-Nielsen H., a kol. Rosiglitazón vyhodnotený na kardiovaskulárne výsledky - predbežná analýza. NEJM 2007; 357: 1-11.
- Park JY, Kim KA, Kang MH a kol. Účinok rifampínu na farmakokinetiku rosiglitazónu u zdravých jedincov. Clin Pharmacol Ther 2004; 75: 157-162.
top
Ako dodávané / skladovacie a manipulačné
Každá päťuholníková filmom obalená tableta TILTAB obsahuje rosiglitazón vo forme maleátu takto: 2 mg ružovej farby, s vyrazeným SB na jednej strane a 2 na druhej; 4 mg oranžovej farby s vyrazením SB na jednej strane a 4 na druhej strane; 8 mg-červeno-hnedá s vyrazeným SB na jednej strane a 8 na druhej strane.
- 2 mg fľaše s obsahom 60: NDC 0029-3158-18
- 4 mg fľaše s obsahom 30: NDC 0029-3159-13
- Fľaše 4 mg s obsahom 90: NDC 0029-3159-00
- 8 mg fľaše po 30: NDC 0029-3160-13
- 8 mg fľaše 90: NDC 0029-3160-59
Uchovávajte pri teplote 25 ° C; exkurzie 15 až 30 ° C (59 až 86 ° F). Dávkujte do tesnej nádoby odolnej proti svetlu.
naposledy aktualizované 2. 2. 2008
Avandia, rosiglitazón maleát, informácie o pacientovi (v jednoduchej angličtine)
Podrobné informácie o príznakoch, príznakoch, príčinách, liečbe cukrovky
Informácie v tejto monografii nie sú určené na pokrytie všetkých možných použití, pokynov, bezpečnostných opatrení, liekových interakcií alebo nepriaznivých účinkov. Tieto informácie sú všeobecné a nie sú určené ako osobitné lekárske rady. Ak máte otázky týkajúce sa liekov, ktoré užívate alebo by ste chceli získať viac informácií, obráťte sa na svojho lekára, lekárnika alebo zdravotnú sestru.
späť k:Prejdite si všetky lieky na diabetes



